Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №5 Строение атома и периодическая система Д.И.Менделеева
Содержание
- 1. Лекция №5 Строение атома и периодическая система Д.И.Менделеева
- 2. Корпускулярно-волновой дуализм Частицы (корпускулы) микромира могут проявлять волновые
- 3. Принцип неопределенности Невозможно одновременно точно измерить скорость частицы
- 4. Уравнение Шрёдингера Уравнение Шрёдингера связывает полную энергию
- 5. Квантовые числа 1) Главное квантовое число n определяет
- 6. Орбитальное квантовое число2) Орбитальное квантовое число l
- 7. если n = 1, то l =
- 8. Расщепление энергетических уровней на подуровниПри n =
- 9. Магнитное квантовое число3) Магнитное квантовое число m
- 10. Спиновое квантовое числоСпин – собственный момент количества
- 11. ЭЛЕКТРОННЫЕ И ЭЛЕКТРОННО-СТРУКТУРНЫЕ ФОРМУЛЫ ЭЛЕМЕНТОВ - это
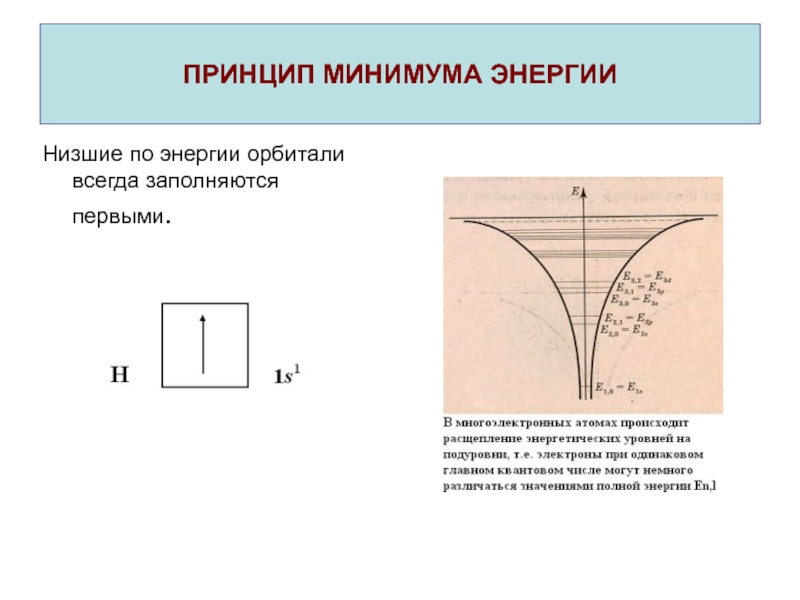
- 12. ПРИНЦИП МИНИМУМА ЭНЕРГИИНизшие по энергии орбитали всегда заполняются первыми.
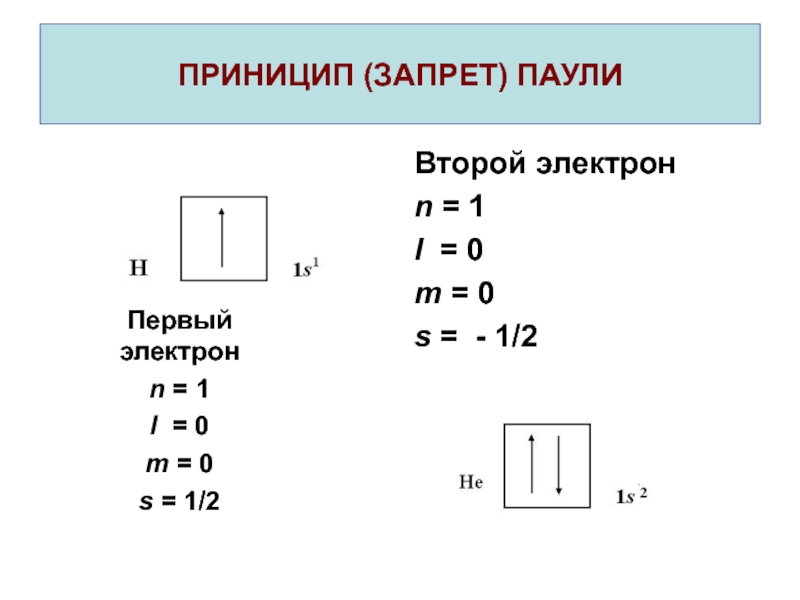
- 13. ПРИНИЦИП (ЗАПРЕТ) ПАУЛИ В атоме не может быть
- 14. ПРИНИЦИП (ЗАПРЕТ) ПАУЛИВторой электронn = 1l =
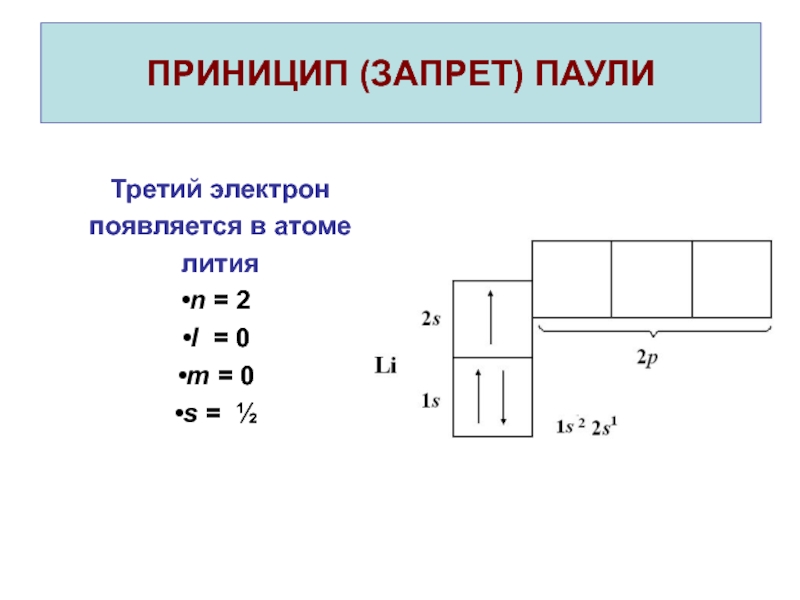
- 15. ПРИНИЦИП (ЗАПРЕТ) ПАУЛИ Третий электрон появляется в атоме литияn = 2l = 0m = 0s = ½
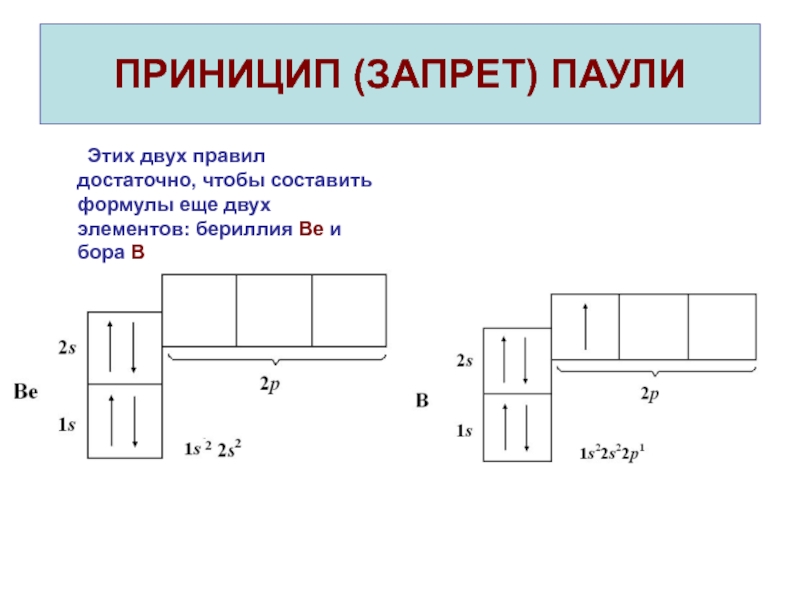
- 16. ПРИНИЦИП (ЗАПРЕТ) ПАУЛИ Этих двух правил достаточно, чтобы
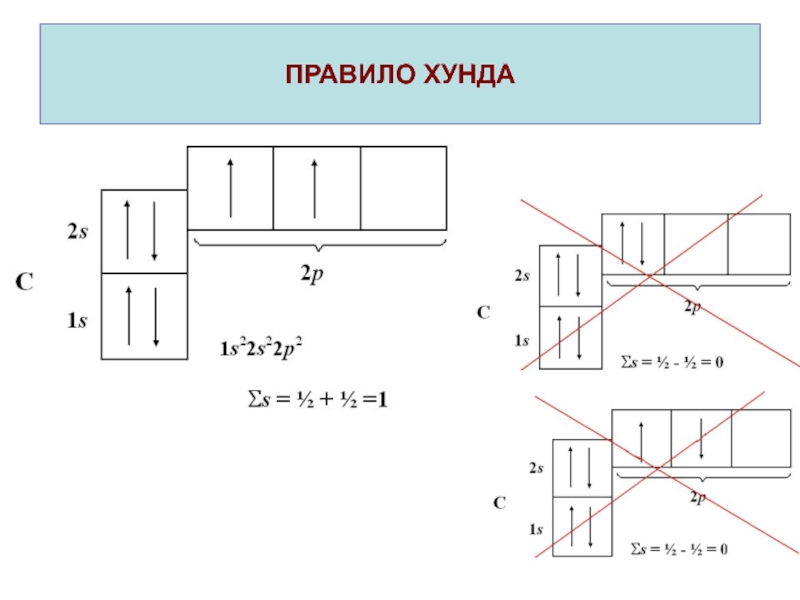
- 17. ПРАВИЛО ХУНДА Электроны заполняют орбитали одного подуровня в
- 18. ПРАВИЛО ХУНДА
- 19. Скачать презентанцию
Корпускулярно-волновой дуализм Частицы (корпускулы) микромира могут проявлять волновые свойства. Эта двойственность (дуализм) микрочастиц описывается уравнением де Бройля: где - (лямбда) длина волны (свойство волнового движения), m – масса частицы, v – ее
Слайды и текст этой презентации
Слайд 1Лекция №5
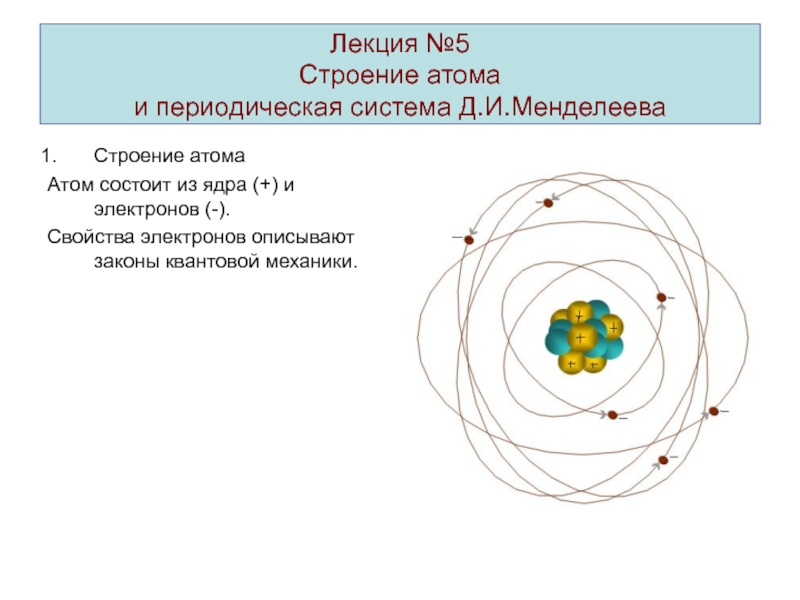
Строение атома
и периодическая система Д.И.Менделеева
Строение атома
Атом состоит из
ядра (+) и электронов (-).
Слайд 2Корпускулярно-волновой дуализм
Частицы (корпускулы) микромира могут проявлять волновые свойства. Эта двойственность
(дуализм) микрочастиц описывается уравнением де Бройля:
где - (лямбда) длина
волны (свойство волнового движения), m – масса частицы, v – ее скорость (mv – свойство движущейся частицы), h – постоянная Планка.Слайд 3Принцип неопределенности
Невозможно одновременно точно измерить скорость частицы и её положение
в пространстве.
Соотношение Гейзенберга:
где Δx – погрешность определения координаты, Δvx –
погрешность определения скорости вдоль этой координаты.Слайд 4Уравнение Шрёдингера
Уравнение Шрёдингера связывает полную энергию частицы Е, потенциальную
энергию Еп, массу частицы m, и волновую функцию Ψ:
me –
масса электрона.Каждое из решений уравнения включает в себя волновую функцию и полную энергию частицы и определяется квантовыми числами.
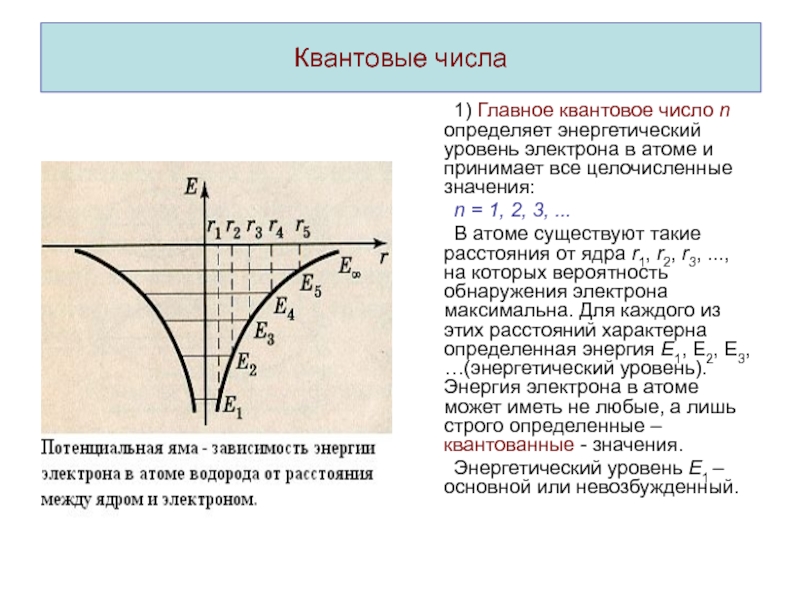
Слайд 5Квантовые числа
1) Главное квантовое число n определяет энергетический уровень электрона
в атоме и принимает все целочисленные значения:
n = 1, 2,
3, ...В атоме существуют такие расстояния от ядра r1, r2, r3, ..., на которых вероятность обнаружения электрона максимальна. Для каждого из этих расстояний характерна определенная энергия Е1, Е2, Е3, …(энергетический уровень). Энергия электрона в атоме может иметь не любые, а лишь строго определенные – квантованные - значения.
Энергетический уровень Е1 – основной или невозбужденный.
Слайд 6Орбитальное квантовое число
2) Орбитальное квантовое число l характеризует пространственную форму
электронного облака.
Возможные значения l для каждого уровня задаются главным
квантовым числом: l принимает значения
от 0 до n -1.
Слайд 7если n = 1, то l = 0
если n =
2, то l = 0, 1
если n = 3, то
l = 0, 1, 2если n = 4, то l = 0, 1, 2, 3
Число возможных значений l равно n
Числовые значения l имеют буквенные обозначения:
Числовое значение l 0 1 2 3
Буквенное обозначение s p d f
Каждому значению l соответствует определенная форма электронного облака
Значения орбитального квантового числа
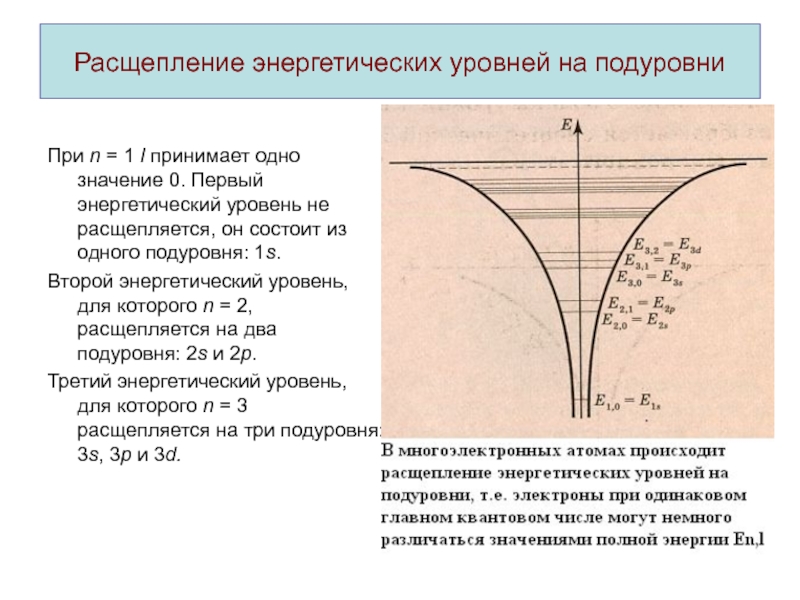
Слайд 8Расщепление энергетических уровней на подуровни
При n = 1 l принимает
одно значение 0. Первый энергетический уровень не расщепляется, он состоит
из одного подуровня: 1s.Второй энергетический уровень, для которого n = 2, расщепляется на два подуровня: 2s и 2p.
Третий энергетический уровень, для которого n = 3 расщепляется на три подуровня: 3s, 3p и 3d.
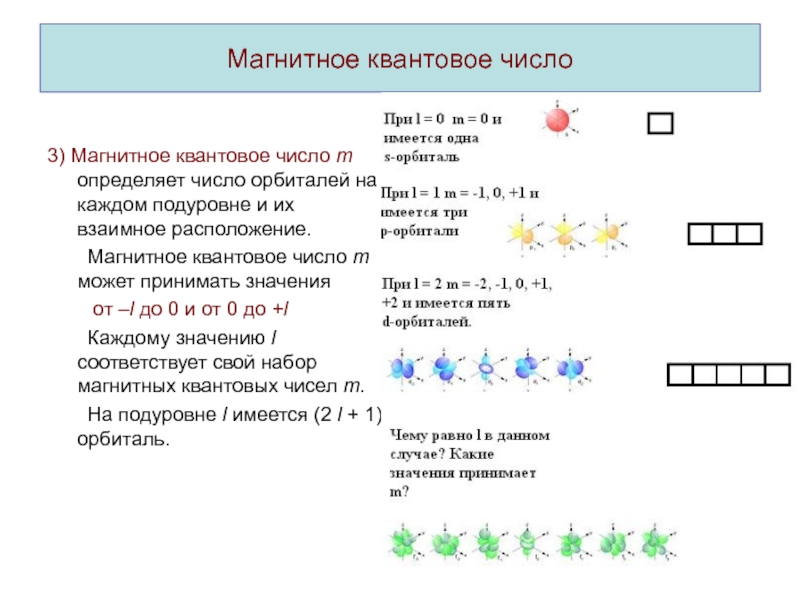
Слайд 9Магнитное квантовое число
3) Магнитное квантовое число m определяет число орбиталей
на каждом подуровне и их взаимное расположение.
Магнитное квантовое число m
может принимать значенияот –l до 0 и от 0 до +l
Каждому значению l соответствует свой набор магнитных квантовых чисел m.
На подуровне l имеется (2 l + 1) орбиталь.
Слайд 10Спиновое квантовое число
Спин – собственный момент количества движения электрона.
Спиновое
квантовое число принимает два значения: +1/2 и -1/2.
Spin – быстрое
вращение.Слайд 11ЭЛЕКТРОННЫЕ И ЭЛЕКТРОННО-СТРУКТУРНЫЕ ФОРМУЛЫ ЭЛЕМЕНТОВ
- это запись распределения электронов
в атоме по уровням, подуровням и орбиталям.
Порядок заполнения энергетических уровней,
подуровней и орбиталей определяется тремя правилами.Слайд 13ПРИНИЦИП (ЗАПРЕТ) ПАУЛИ
В атоме не может быть двух электронов с
одинаковым набором всех четырех квантовых чисел.
Вольфганг ПАУЛИ (Pauli, Wolfgang)
(25.4.1900
- 15.12.1958) швейцарский физик-теоретик.