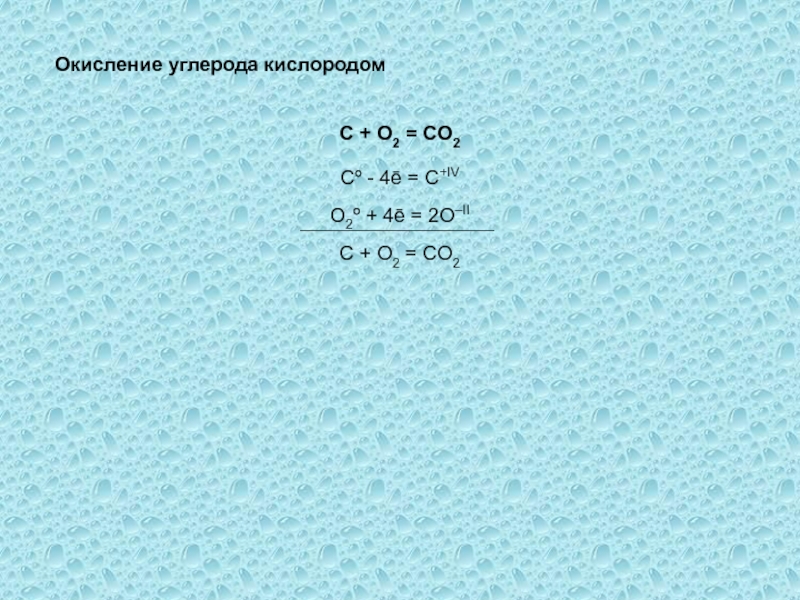
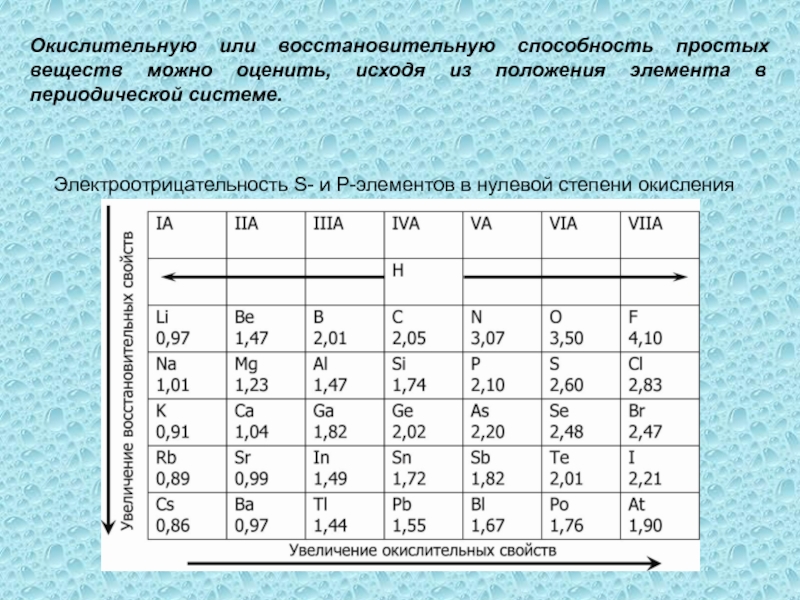
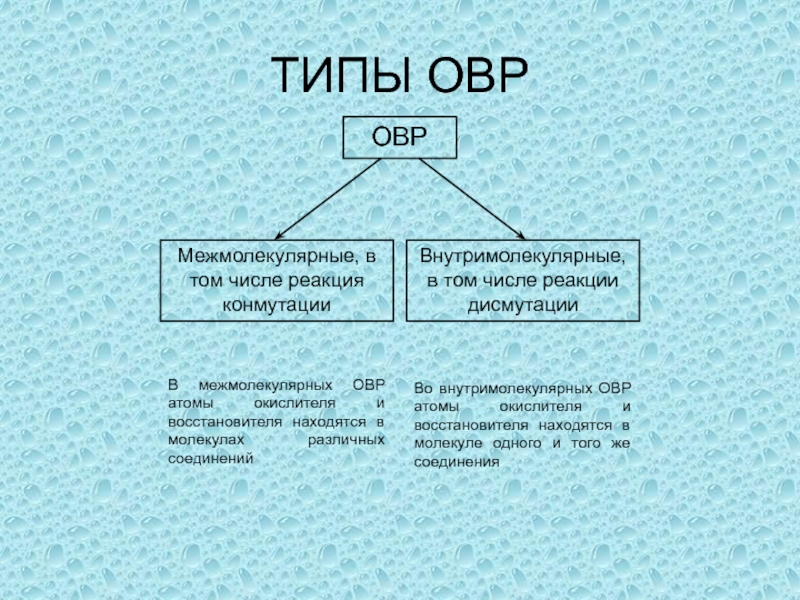
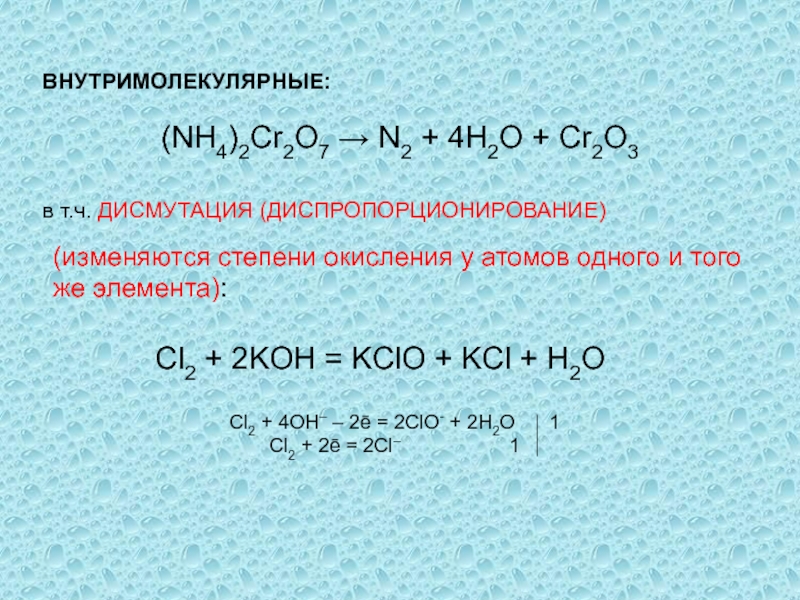
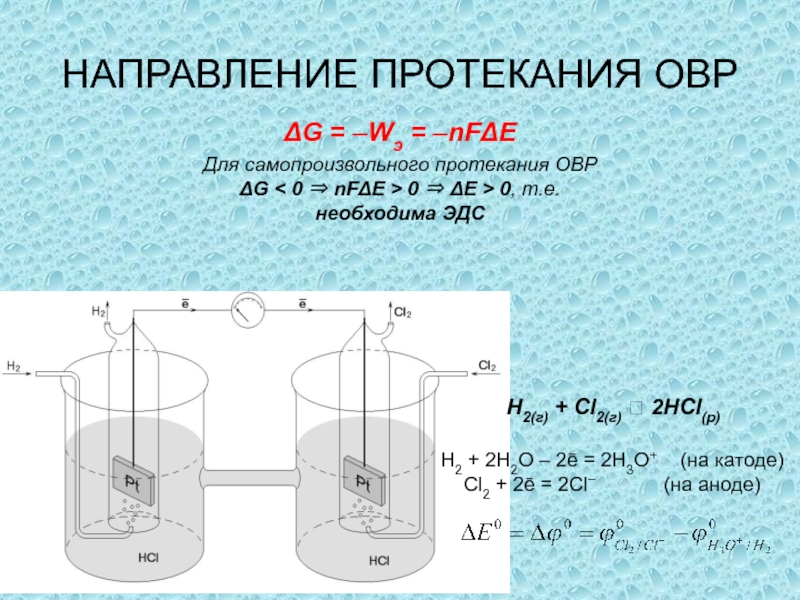
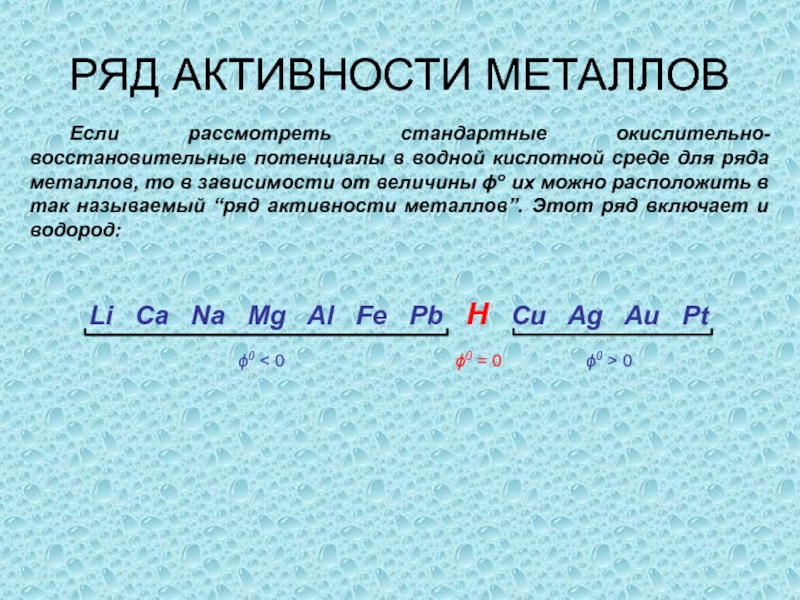
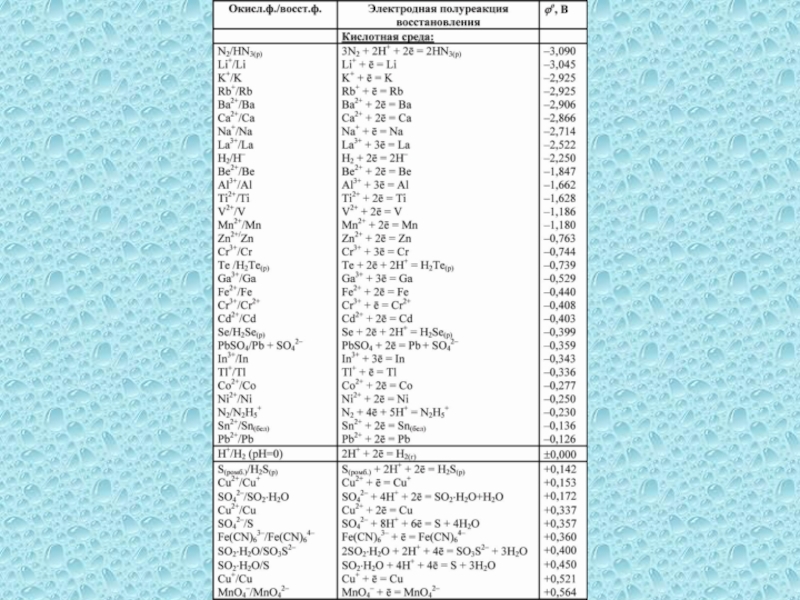
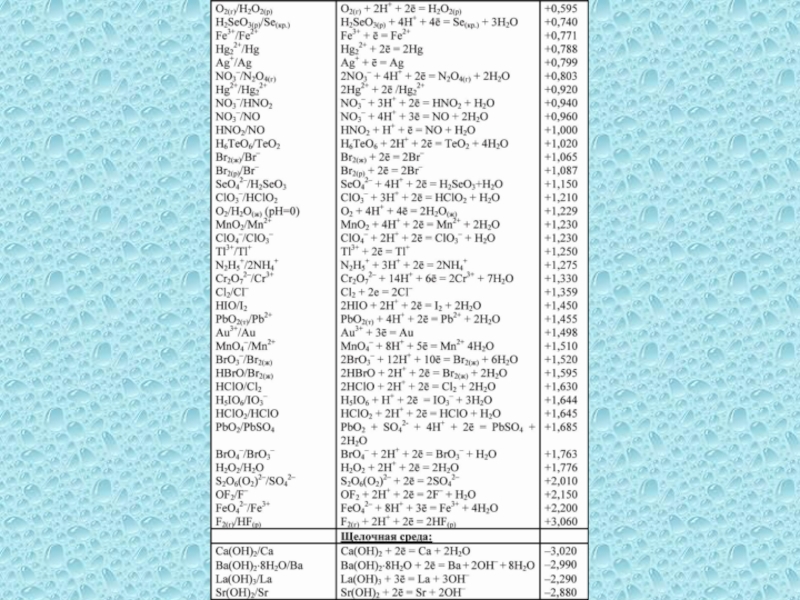
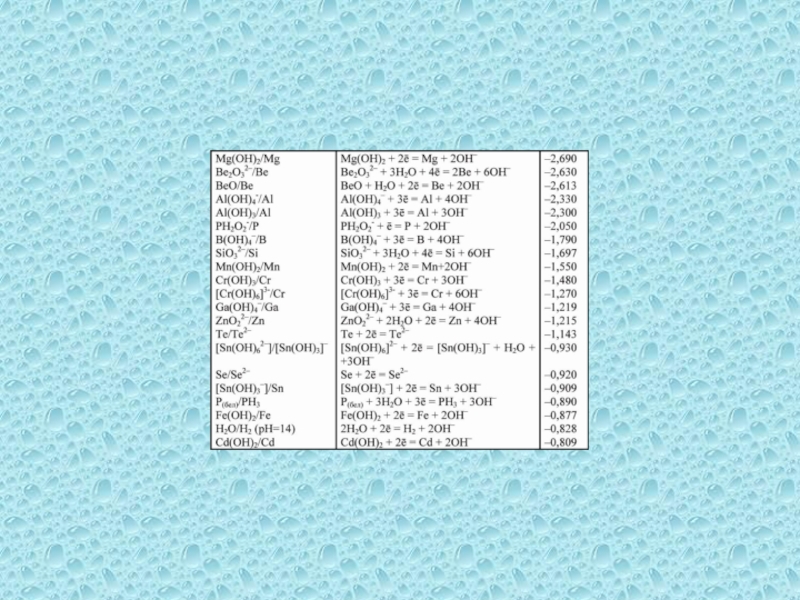
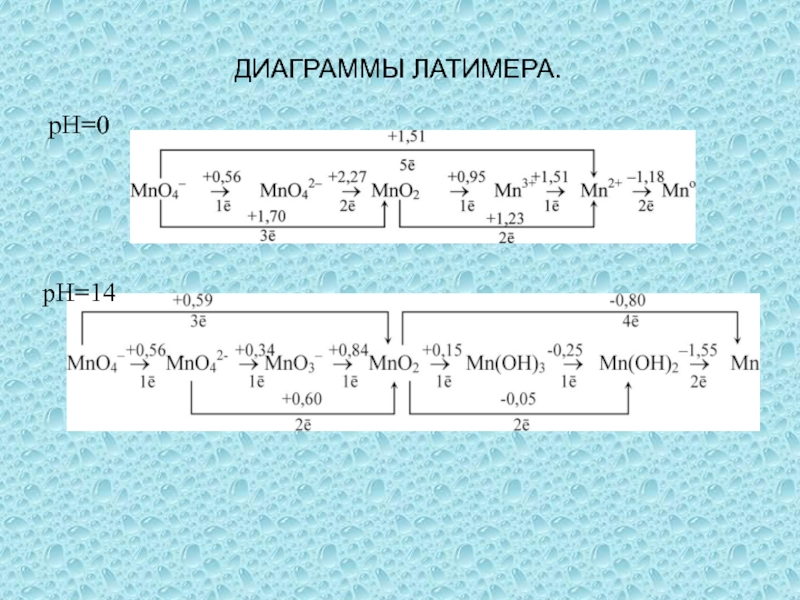
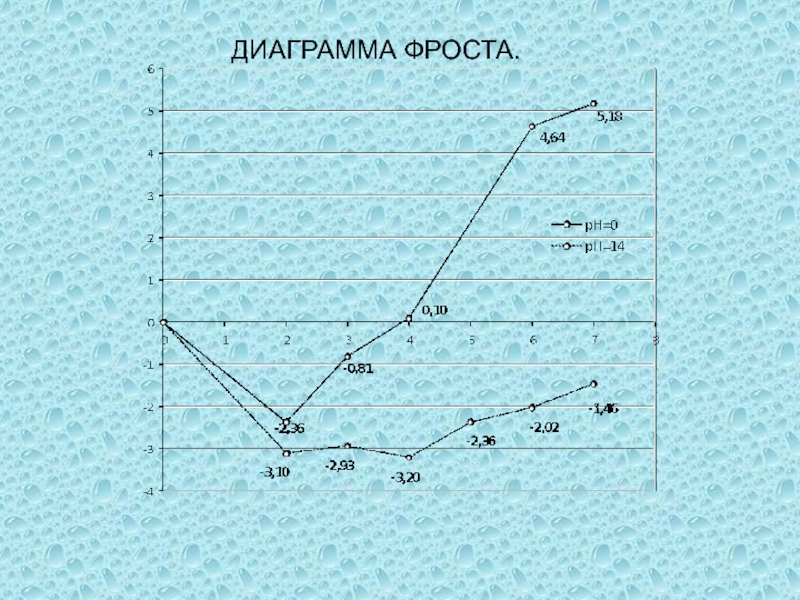
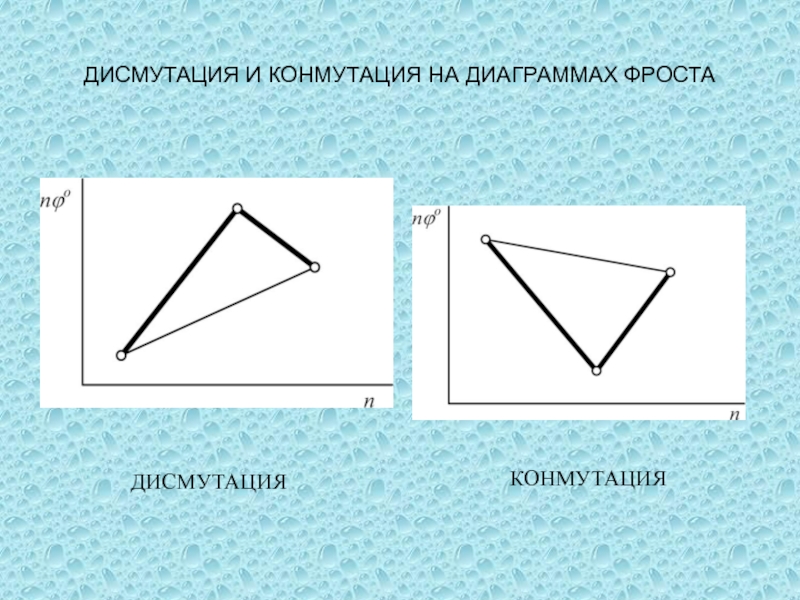
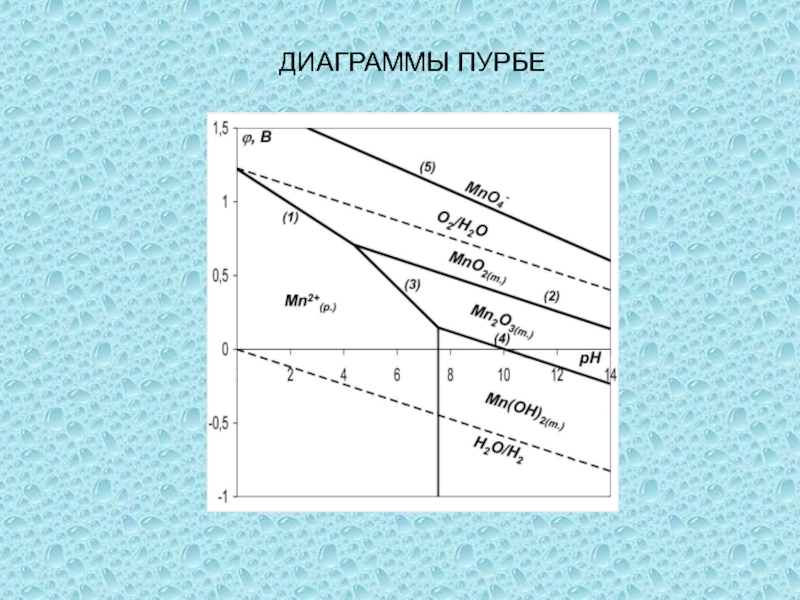
одного или нескольких веществ, называются окислительно-восстановительными (ОВР), в ходе которых
степени окисления (СО) атомов, входящих в состав реагирующих частиц, изменяются.Степень окисления (СО) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы, считая все химические связи в ней ионными.