Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Мария Дмитриевна Смирнова Smirnova@sch2101.ru Vk.com/masha2101 1 ХИМИЯ 8
Содержание
- 1. Мария Дмитриевна Смирнова Smirnova@sch2101.ru Vk.com/masha2101 1 ХИМИЯ 8
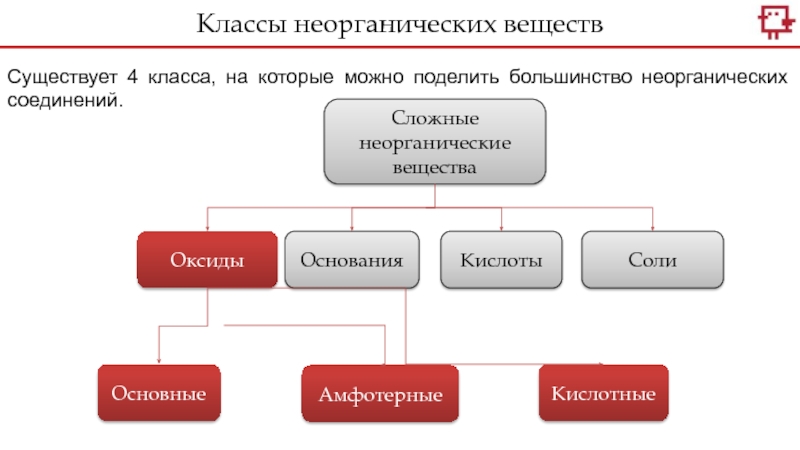
- 2. Существует 4 класса, на которые можно поделить большинство неорганических соединений.Классы неорганических веществСложные неорганические веществаОксидыОснованияКислотыСолиОсновныеАмфотерныеКислотные
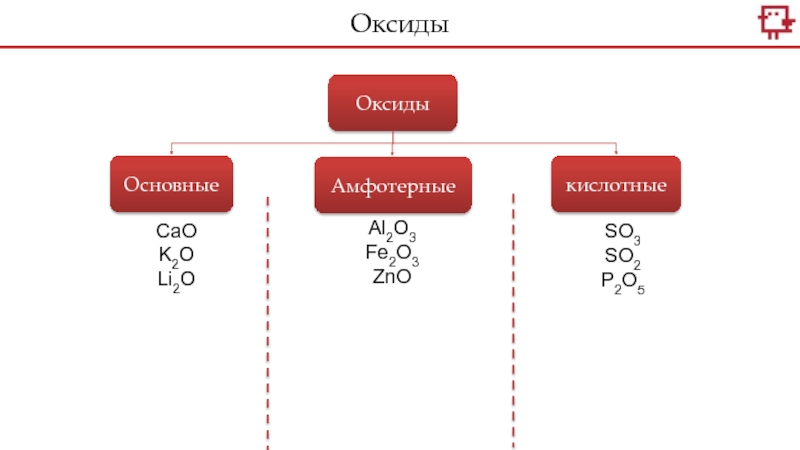
- 3. ОксидыОксидыОсновныеАмфотерныекислотныеCaOK2OLi2OAl2O3Fe2O3ZnOSO3SO2P2O5
- 4. Оксиды. Химические свойства
- 5. Оксиды. Химические свойства
- 6. N2O5 + H2SO4 CaO + H2SO4 Mn2O7 + H2SO4 Оксиды. Химические свойства
- 7. N2O5 не основныйCaO + H2SO4 CaSO4 + H2OMn2O7 HMnO4Оксиды. Химические свойства
- 8. H2O + H2O CaO + H2O OF2+ H2O Оксиды. Химические свойства
- 9. H2O не основныйCaO + H2O Ca(OH)2OF2 не основныйОксиды. Химические свойства
- 10. SO3+ SO2CO + CO2MgO + P2O5Оксиды. Химические свойства
- 11. Чего-то не хватает?K2O + P2O5 K3PO4Оксиды. Химические свойства
- 12. N2O5 + Mg(OH)2 RbO + KOHP2O5 + NaOHОксиды. Химические свойства
- 13. N2O5 + Mg(OH)2 RbO + KOHP2O5 +
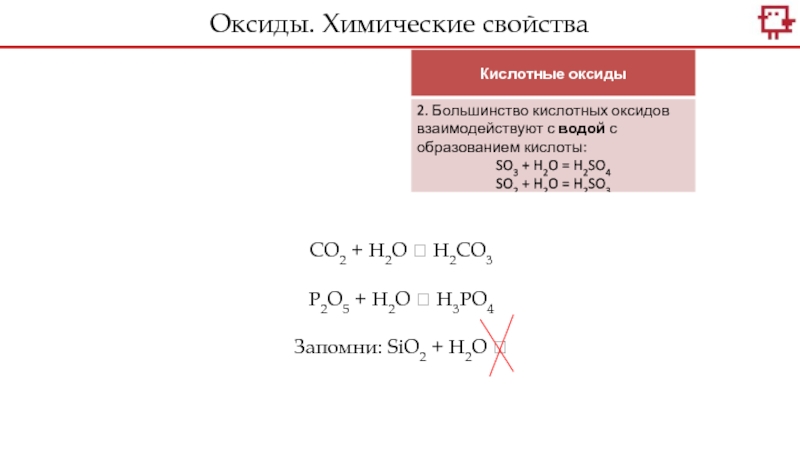
- 14. CO2 + H2O P2O5 + H2O SiO2 + H2O Оксиды. Химические свойства
- 15. CO2 + H2O H2CO3 P2O5 + H2O H3PO4Запомни: SiO2 + H2O Оксиды. Химические свойства
- 16. Составит три уравнения реакций:Летучие кислоты: HF HCl
- 17. Напишите уравнения реакций, подходящих для схемы:Ca
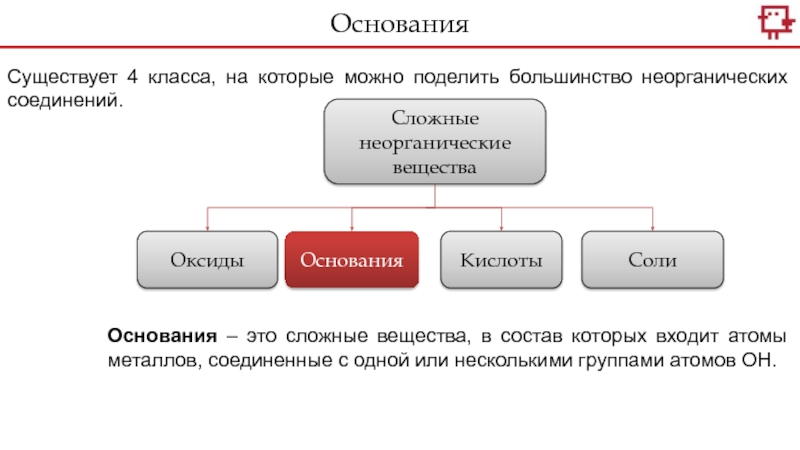
- 18. ОснованияСуществует 4 класса, на которые можно поделить
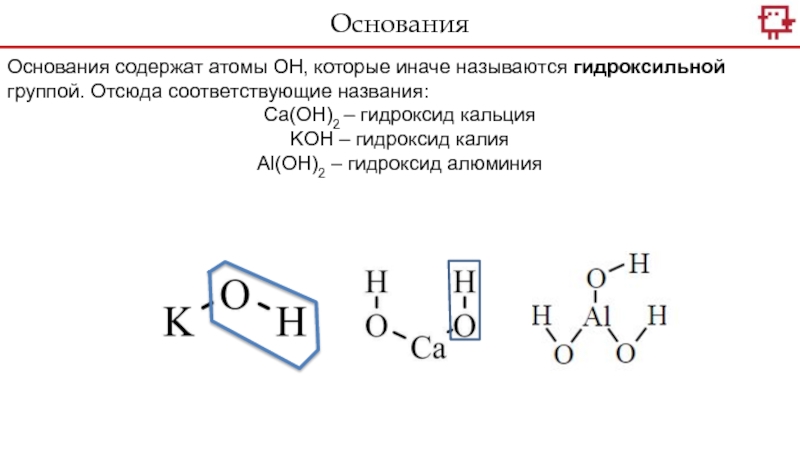
- 19. Основания содержат атомы ОН, которые иначе называются
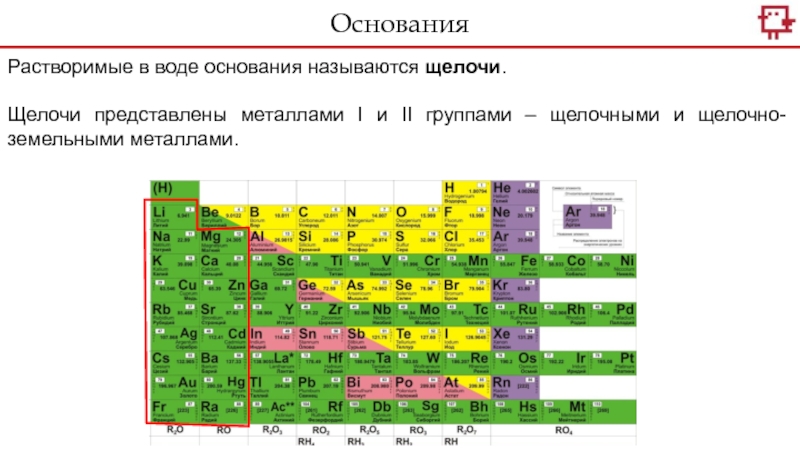
- 20. Растворимые в воде основания называются щелочи.Щелочи представлены
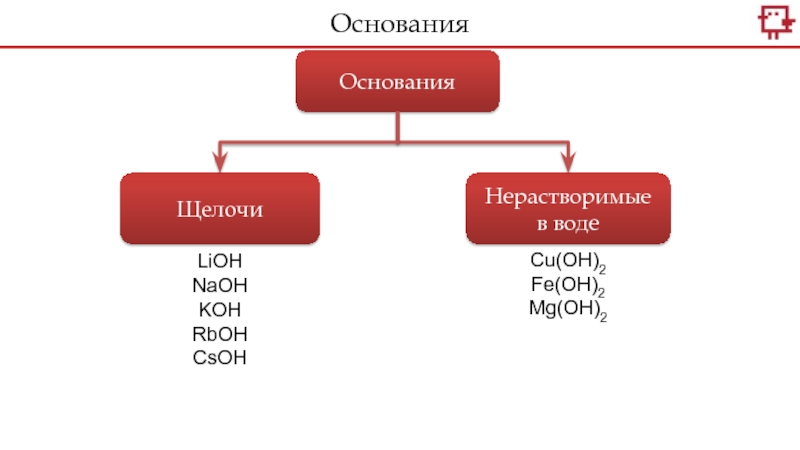
- 21. ОснованияЩелочиНерастворимые в водеCu(OH)2Fe(OH)2Mg(OH)2LiOHNaOHKOHRbOHCsOHОснования
- 22. ОснованияПолучение оснований:Щелочи можно получить при взаимодействии активных
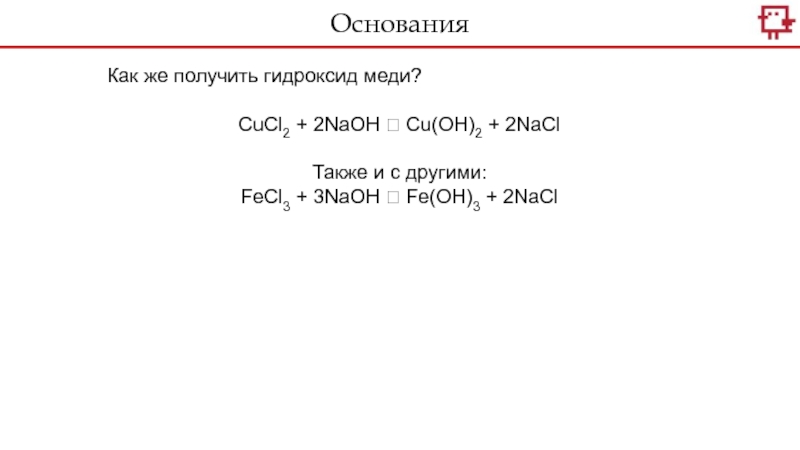
- 23. Как же получить гидроксид меди?CuCl2 + 2NaOH
- 24. Скачать презентанцию
Существует 4 класса, на которые можно поделить большинство неорганических соединений.Классы неорганических веществСложные неорганические веществаОксидыОснованияКислотыСолиОсновныеАмфотерныеКислотные
Слайды и текст этой презентации
Слайд 1Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
ХИМИЯ
8 класс
Вода и классы химических веществ
Слайд 2Существует 4 класса, на которые можно поделить большинство неорганических соединений.
Классы
неорганических веществ
Слайд 13N2O5 + Mg(OH)2
RbO + KOH
P2O5 + 6NaOH 2Na3PO4 +___
H2O
Не растворимо
Не кислотный оксид
Оксиды. Химические свойства
Слайд 16Составит три уравнения реакций:
Летучие
кислоты:
HF
HCl
HBr
HI
H2S
HNO3
H2CO3
H2SO3
Нелетучие кислоты:
H2SO4
H3PO4
H2SiO3
H3BO3
Оксиды. Химические свойства
Слайд 17Напишите уравнения реакций, подходящих для схемы:
Ca CaO Ca(OH)2
P
P2O5 H3PO4
N2O5 + LiOH
Оксиды. Химические свойства
Слайд 18Основания
Существует 4 класса, на которые можно поделить большинство неорганических соединений.
Сложные
неорганические вещества
Оксиды
Основания
Кислоты
Соли
Основания – это сложные вещества, в состав которых входит
атомы металлов, соединенные с одной или несколькими группами атомов ОН. Слайд 19Основания содержат атомы ОН, которые иначе называются гидроксильной группой. Отсюда
соответствующие названия:
Са(ОН)2 – гидроксид кальция
KOH – гидроксид калия
Al(OН)2 – гидроксид
алюминия Основания
Слайд 20Растворимые в воде основания называются щелочи.
Щелочи представлены металлами I и
II группами – щелочными и щелочно-земельными металлами.
Основания
Слайд 22Основания
Получение оснований:
Щелочи можно получить при взаимодействии активных металлов и их
оксидов с водой.
СаО + Н2О = Са(ОН)2
Са + Н2О
= Са(ОН)2 + Н2Металлы, образующие не растворимые щелочи с водой не реагируют.
Сu + H2O
CuO + H2O
Как же получить гидроксид меди?