Слайд 1Материал подготовлен кандидатом технических наук Кузьминой Ириной Викторовной
Очистка и
контроль качества
природных и сточных вод
Вода и ее свойства
Практические
работы, часть 2
«Новороссийский колледж строительства и экономики» (ГАПОУ КК «НКСЭ»)
Слайд 2Я, Кузьмина Ирина Викторовна, кандидат технических наук с большим опытом
преподавания в высшей школе, обобщила полезную для Вас информацию по
дисциплине «Очистка и контроль качества природных и сточных вод».
Слайд 3Вернуться к содержанию
Для выхода из программы нажмите «Esc» на клавиатуре
Переход
к тому действию, о котором гласит надпись, выделенная вишневым или
желтым цветом
Справочная таблица
Вернемся к …
Esc
Кнопки для перемещения вперед и назад по материалу занятий
Инструкция по использованию
интерфейса
Слайд 4Содержание
Практическая работа № 5 «Влияние температуры на скорость реакции».
Практическая работа
№ 6 «Реакции обмена».
Гидролиз. Практическая работа № 7 «Гидролиз солей».
Практическая работа № 8 «Химическое равновесие в гомогенных системах».
Практическая работа № 9 «Химическое равновесие в гетерогенных системах».
Использованные источники.
Слайд 5Практическая работа № 5
«Влияние температуры на скорость реакции»
Слайд 6Цель – Познакомиться с влиянием температуры на скорость реакции.
Приборы и
реактивы: химическая посуда, H2SO4, Zn, Na2S2O3, H2O.
Слайд 7Опыт 1. В два сосуда Ландольта опускаем по 3 гранулы
цинка и добавляем раствор серной кислоты. Различие состоит в том,
что один раствор комнатной температуры, а другой подогрели.
H2SO4 + Zn ZnSO4 + H2
Наблюдаемый эффект: реакция протекает быстрее там, где был подогретый раствор.
Слайд 8Прибор позволяет выявить влияние на скорость химической реакции следующих факторов:
природы реагирующих веществ;
концентрации;
площади соприкосновения реагирующих веществ;
температуры;
катализатора;
ингибитора.
Прибор для демонстрации зависимости
скорости химических реакций
от различных условий
Слайд 9Принцип работы прибора состоит во взаимодействии твердой фазы (гранул цинка)
и жидкой (раствора кислоты) в сосудах Ландольта, в результате чего
выделяется газ, который по пластиковым трубкам поступает в манометрические трубки, давит на окрашенную жидкость и вызывает ее подъем. О различной скорости химической реакции в двух сосудах Ландольта судят по разности уровней жидкости в манометрических трубках.
Слайд 10Прибор состоит из двух сосудов Ландольта (1), связанных с поворотным
устройством (2), двух силиконовых трубок (3) с двумя стеклянными воронками
вверху и двумя внизу. Верхние воронки (4) предотвращают выброс жидкости из трубок в случае очень быстрого ее подъема; нижние (5) служат резервуаром для окрашенной жидкости при заполнении трубок по всей длине шкалы. Манометричес-кие трубки и сосуды Ландольта соединяются силиконовыми трубками (6) с резиновыми пробками на концах (7). Прибор смонтирован на платформе (8) с оцифрованной шкалой (9).
Слайд 11Опыт 2. В три стакана наливаем раствор серной кислоты, в
3 другие – раствор тиосульфата натрия. Объем у всех растворов
одинаковый. Одну пару стаканов с H2SO4 и Na2S2O3 поставим в кристаллизатор, другую пару – в термостат с температурой 35 оС, третью пару в стакан с кипящей водой. Через 10 минут растворы попарно смешаем.
кристаллизатор
термостат
3 2 1
2
1
3
Слайд 12H2SO4 + Na2S2O3 Na2SO4 + H2SO3S
+6
–2 +4 0
H2SO3S H2SO3 + S
Наблюдаемый эффект: желтый осадок появляется тем быстрее, чем выше температура.
Вывод: реакция протекает тем быстрее, чем выше температура.
кристаллизатор
термостат
3 2 1
2
1
3
Слайд 13Практическая работа № 6
«Реакции обмена»
Слайд 14Цель – Познакомиться с условиями протекания обменных реакций.
Приборы и реактивы:
химическая посуда, NaOH, KOH, H2SO4, НCl, CuSO4, Na2CO3, BaCl2, Na2SO4,
AlCl3.
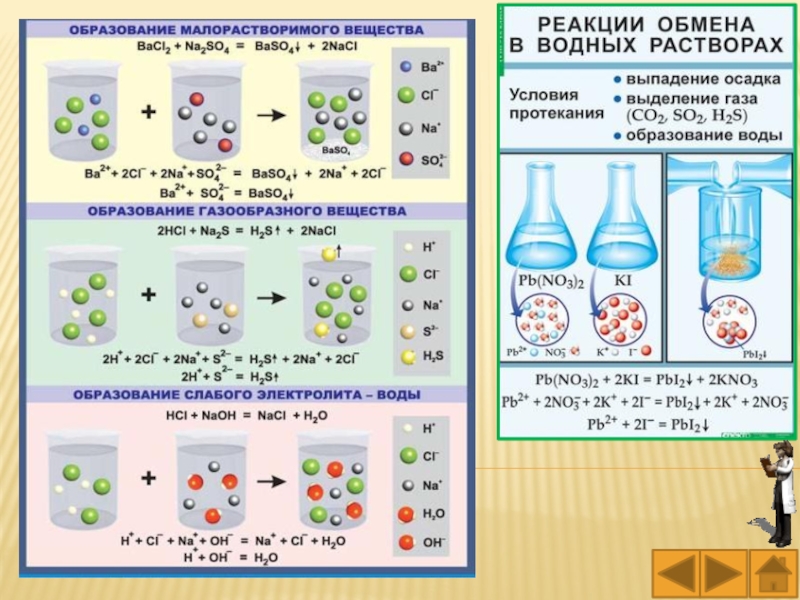
Слайд 15Обменные реакции в растворах электролитов протекают в направлении связывания ионов,
в направлении образования более слабых электролитов, более устойчивых соединений с
меньшим значением константы диссоциации или константы нестойкости.
Реакции обмена в растворах электролитов протекают практически до конца, если выпадает осадок, выделяется газ или образуется слабый электролит (например вода или комплексный ион).
Слайд 18Задание. Определите между какими парами веществ, приведенных в таблице, возможно
химическое взаимодействие и почему? Напишите молекулярное, полное и краткое ионное
уравнения возможных реакций.
Из справочника выпишите произведение растворимости полученных осадков.
Слайд 19Опыт 1. В пробирку внесите несколько капель раствора сульфата меди
(II), а затем добавьте несколько капель раствора гидроксида натрия.
2CuSO4 +
2NaOH → (CuOH)2SO4↓+ Na2SО4
2Cu2++2SO42– +2Na++2OH–→(CuOH)2SO4↓+2Na++SО42–
2Cu2++SO42– +2OH–→(CuOH)2SO4↓
(CuOH)2SO4 + 2NaOH → 2Cu(OH)2↓+ Na2SО4
(CuOH)2SO4 +2Na++2OH–→2Cu(OH)2↓+2Na++SО42–
(CuOH)2SO4 +2OH–→2Cu(OH)2↓ + SО42–
Наблюдаемый эффект: Выпадает голубой осадок, который при добавлении NaOH темнеет.
Произведение растворимости:
гидроксида меди (II) – ПР(Cu(OH)2) = 8,310 –20,
гидроксосульфата меди (II) – ПР((CuOH)2SO4) = 8,310 –12. ПР(Cu(OH)2) < ПР((CuOH)2SO4), поэтому преимущественно образуется гидроксид меди (II).
Вывод: сульфат меди (II) и гидроксид натрия взаимодействуют, так как образуется осадок.
Слайд 20Аналогично оформите остальные опыты.
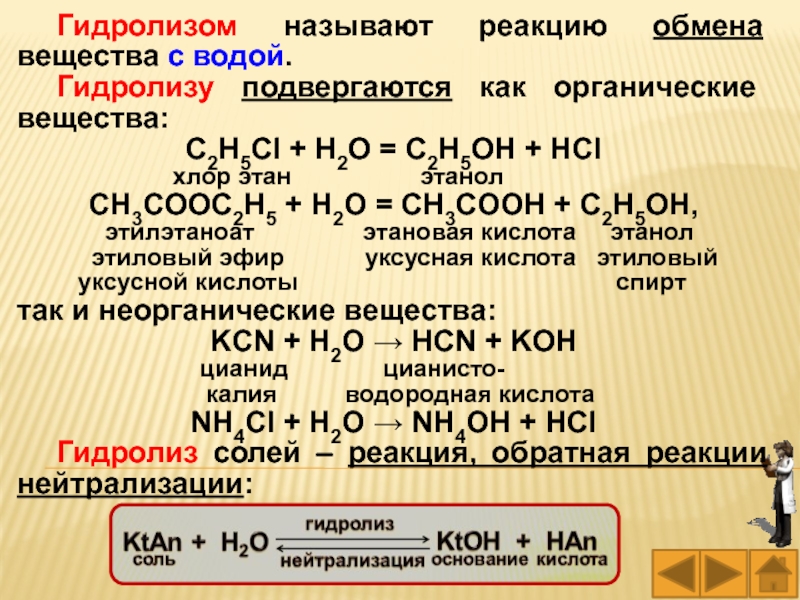
Слайд 22Гидролизом называют реакцию обмена вещества с водой.
Гидролизу подвергаются как органические
вещества:
C2H5Cl + H2O = C2H5OH + HCl
хлор этан этанол
CH3COOC2H5 + H2O = CH3COOH + C2H5OH,
этилэтаноат этановая кислота этанол
этиловый эфир уксусная кислота этиловый
уксусной кислоты спирт
так и неорганические вещества:
KCN + H2O → HCN + KOH
цианид цианисто-
калия водородная кислота
NH4Cl + H2O → NH4OH + HCl
Гидролиз солей – реакция, обратная реакции нейтрализации:
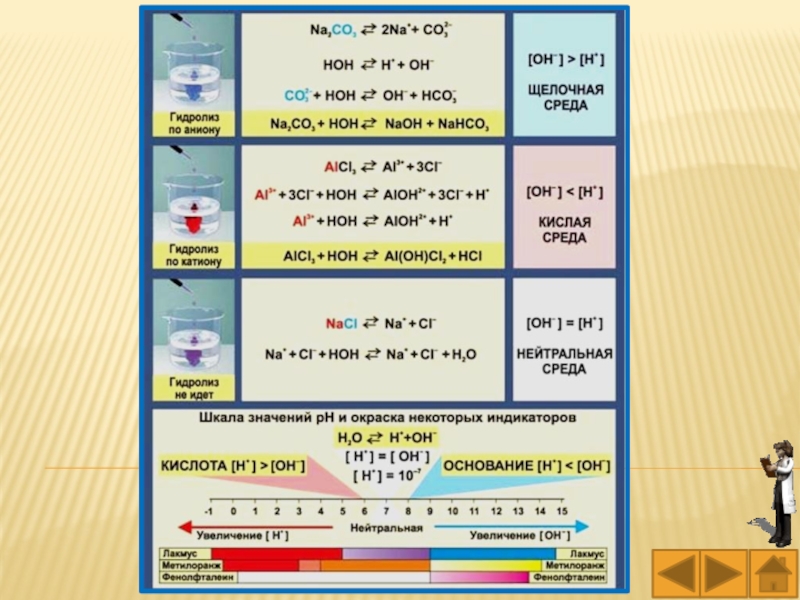
Слайд 23Гидролизу не подвергаются соли, образованные катионом сильного основания (Li+, Na+,
K+, Rb+, Cs+, Ba2+, Sr2+, Ca2+ и др.) и анионом
сильной кислоты (I –, Br –, Cl –, ClO –, SO42–, NO3–, MnO4–, и др.). В растворах таких солей среда нейтральная.
Гидролизу подвергаются растворимые соли, образованные:
слабой кислотой и сильным основанием,
слабым основанием и сильной кислотой,
слабой кислотой и слабым основанием.
Если в таблице растворимости стоит прочерк, то это означает, что соль в растворе не существует, т. к. подвергается полному и необратимому гидролизу.
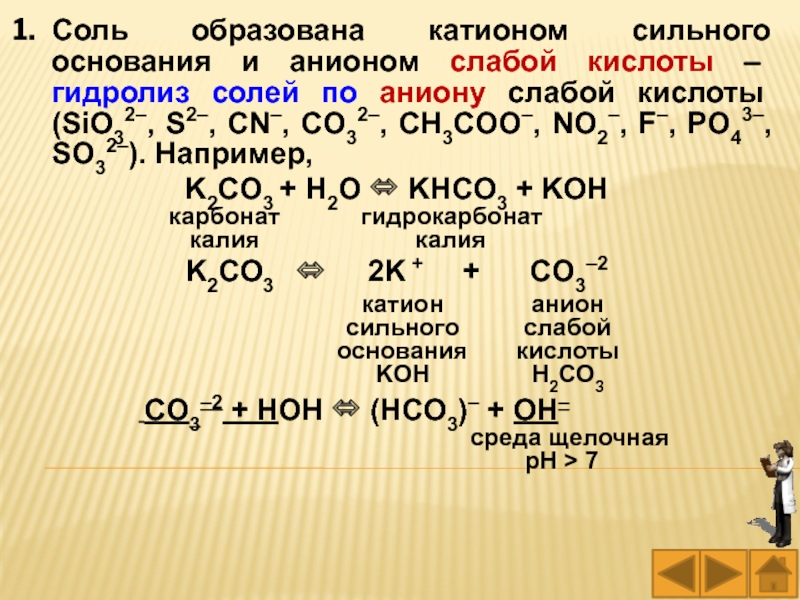
Слайд 24Соль образована катионом сильного основания и анионом слабой кислоты –
гидролиз солей по аниону слабой кислоты (SiO32–, S2–, CN–,
CO32–, CH3COO–, NO2–, F–, PO43–, SO32–). Например,
K2CO3 + H2O KHCО3 + KOH
карбонат гидрокарбонат
калия калия
K2CO3 2K + + CO3–2
CO3–2 + HOН (HCO3)– + OH–
среда щелочная
рН > 7
Слайд 25Гидролиз солей, образованных анионом слабой кислоты, усиливается (то есть равновесие
смещается вправо) при:
а) нагревании, так как гидролиз – процесс эндотермический;
б) разбавлении раствора, то есть уменьшении концентрации соли;
в) подкислении раствора, то есть при добавлении в раствор кислоты.
Гидролиз подавляется (равновесие смещается влево) при:
а) охлаждении раствора;
б) увеличении концентрации соли;
в) подщелачивании раствора.
Слайд 26Соль образована катионом слабого основания и анионом сильной кислоты –
гидролиз солей по катиону слабого основания (NH4+, Mg2+, Al3+, Cr3+,
Fe2+, Ni2+, Co2+, Zn2+, Pb2+, Sn2+, Cu2+ и других нерастворимых в воде оснований). Например,
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4
сульфат гидроксосульфат
меди (II) меди (II)
CuSO4 Cu +2 + SO4–2
Cu+2 + HOН CuOH+ + H+
среда кислая
рН < 7
Слайд 27В растворе солей, гидролизующихся по катиону, среда кислая, pH
таких солей усиливается при
а) нагревании,
б) разбавлении раствора,
в) добавлении в раствор
щелочи.
Гидролиз подавляется при охлаждении раствора, увеличении концентрации соли и подкислении.
Слайд 28Соль образована катионом слабого основания и анионом слабой кислоты –
гидролиз солей по катиону слабого основания и аниону слабой кислоты.
Например,
CH3COONH4 + H2O CH3COOH + NH4OH
ацетат аммония этановая кислота гидроксид
уксусная кислота аммония
CH3COONH4 CH3COO– + NH4+
NH4+ + HOН NH4OH + H+
CH3COO– + HOН CH3COOH + OH–
среда нейтральная рН 7
Слайд 29В растворе таких солей pH определяется силой образующихся кислоты и
основания. В растворе ацетата аммония среда близкая к нейтральной, так
как K(CH3COOH) = 1,76•10–5, K(NH4OH) = 1,79•10–5.
Гидролиз таких солей усиливается при нагревании и не зависит от концентрации соли.
Слайд 30Степень и константа гидролиза
Степень гидролиза (h) – доля вещества, подвергшаяся
гидролизу (отношение числа молекул, подвергшихся гидролизу, к общему числу молекул):
Слайд 31Степень гидролиза зависит от:
константы диссоциации образующегося слабого электролита (чем слабее
образующиеся кислота и/или основание, тем больше h),
температуры (h возрастает
при увеличении температуры),
концентрации соли (h увеличивается при уменьшении концентрации соли, то есть при разбавлении),
кислотности среды (от pH раствора).
Слайд 32Константа гидролиза – константа равновесия обратимого процесса гидролиза:
KF + H2O
HF + KOH
F – + HOН HF +
OH –
(концентрация воды в выражение для константы гидролиза не входит, так как вода – растворитель, ее концентрацию можно считать величиной постоянной).
Слайд 33HF – слабая кислота, диссоциирует обратимо:
HF H+
+ F –.
Подставляя эту величину в формулу для константы гидролиза,
получаем
Слайд 34Константа гидролиза зависит от природы соли и от температуры, но
не зависит от концентрации соли.
Для солей, образованных слабой кислотой (гидролиз
по аниону)
Для солей, образованных слабым основанием (гидролиз по катиону)
Слайд 35Для солей, гидролизующихся и по катиону, и по аниону
Чем слабее
образующиеся кислота и/или основание, то есть, чем меньше их константа
диссоциации, тем больше константа гидролиза, тем сильнее гидролизуется соль. Величина константы гидролиза возрастает также с увеличением температуры.
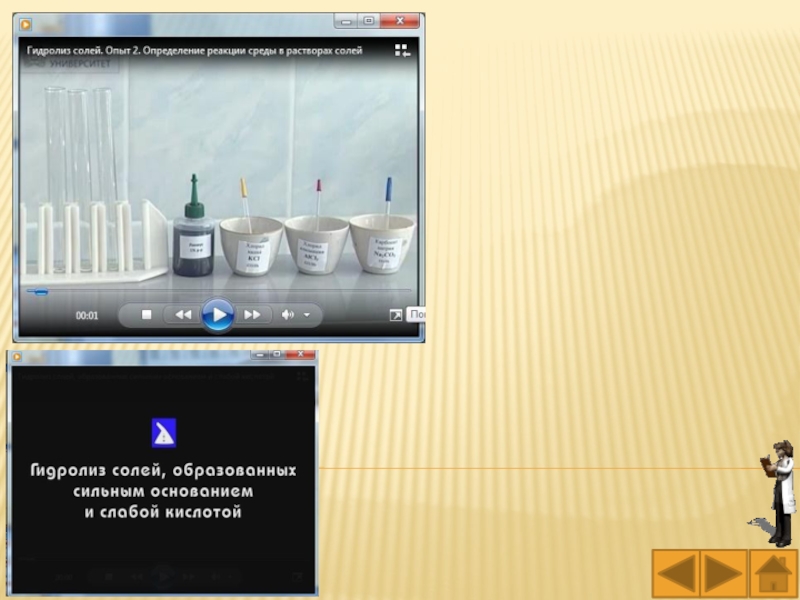
Слайд 39Практическая работа № 7
«Гидролиз солей»
Слайд 40Цель – Познакомиться с условиями протекания реакций гидролиза.
Приборы и реактивы:
химическая посуда, AlCl3, Na2CO3, KI, NH4CNS.
Слайд 41Опыт 1. В пробирку внесите кристаллик хлорида алюминия и добавьте
немного воды.
АlCl3 + H2O AlOHBr2 + HCl
АlCl3
Al+3 + 3Cl –
Al+3 + HOН AlOH+2 + H+
среда кислая
рН < 7
K(H2O) = 1•10–14, K(Al(OH)3) = 1,38•10–9.
Слайд 42Наблюдаемый эффект: с помощью универсаль-ного индикатора установили , что рН
= 3.
Константа гидролиза: Kгидр.(АlCl3) = 7,25•10–6.
Вывод: гидролиз протекает по катиону,
т.к. соль образована катионом слабого основания и анионом сильной кислоты.
Аналогично оформите остальные опыты.
Слайд 43Практическая работа № 8 «Химическое равновесие в гомогенных системах»
Слайд 44Цель – Познакомиться с условиями смещения химического равновесия в гомогенных
системах.
Приборы и реактивы: химическая посуда, Н2O, FeCl3, NH4Cl, NH4CNS, (NO2+N2O4).
Слайд 45Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие
Для
изучения влияния концентрации реагирующих веществ на химическое равновесие удобно воспользоваться
реакцией между хлоридом железа (III) и роданидом аммония, которая выражается уравнением:
FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl.
Слайд 46FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl.
Из веществ этой системы
Fe(CNS)3 интенсивно окрашен в красный цвет, разбавленный раствор FeCl3 в
бледно-желтый, а растворы NH4CNS и NH4Cl – бесцветны. Поэтому всякое изменение концентрации Fe(CNS)3 сказывается на изменении окраски раствора. Это позволяет наблюдать, в каком направлении сдвигается равновесие при изменении концентрации реагирующих веществ.
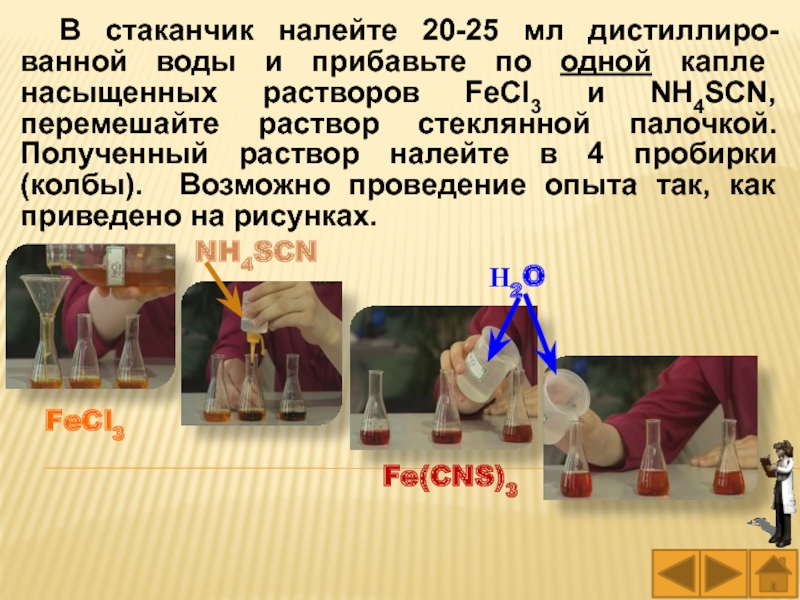
Слайд 47В стаканчик налейте 20-25 мл дистиллиро-ванной воды и прибавьте по
одной капле насыщенных растворов FeCl3 и NH4SCN, перемешайте раствор стеклянной
палочкой. Полученный раствор налейте в 4 пробирки (колбы). Возможно проведение опыта так, как приведено на рисунках.
FeCl3
NH4SCN
Fe(CNS)3
Н2O
Слайд 48Добавьте:
в первую пробирку (колбу) одну каплю насыщенного раствора FeCl3,
во вторую
пробирку (колбу) одну каплю насыщенного раствора NH4SCN,
в третью пробирку (колбу)
щепотку кристаллов NH4Cl.
Четвертую пробирку (колбу) оставьте для сравнения.
Слайд 49Результаты эксперимента
FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl
1
2
3
4
Слайд 50Направление смещение химического равновесия можно определить с помощью принципа Ле–Шателье:
если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется
давление, температура, концентрация реагирующих веществ), то в системе происходят процессы, направленные на уменьшение внешнего воздействия.
Слайд 51Константа химического равновесия представляет собой дробь, в числителе которой стоит
произведение равновесных концентраций (если реакция протекает в растворе) или равновесных
парциальных давлений (для реакций в газовой фазе) продуктов реакций, возведенных в степени, показатели которых равны стехиометрическим коэффициентам, а в знаменателе произведение концентраций (или парциальных давлений) исходных веществ, возведенных в соответствующие степени. В первом случае константу равновесия обозначим КС, а во втором КР. В случае обратимых гетерогенных реакций концентрация вещества, находящегося в твердой фазе, в величину константы равновесия не входит.
Слайд 52FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl
В первую пробирку добавляли
FeCl3 – окраска раствора усилилась, т. к. прибавленный хлорид железа
прореагировал с оставшимся в растворе бесцветным роданидом аммония – равновесие сместилось в сторону продуктов реакции.
Во вторую пробирку добавляли NH4SCN, – окраска раствора стала еще темнее, чем в первой пробирке т. к. концентрация исходных веществ увеличивается сильнее (возводится в куб) – равновесие сместилось в сторону продуктов реакции.
В третью пробирку добавляли NH4Cl – окраска раствора стала светлее, т. к. уменьшается концентрация Fe(CNS)3, который тереходит в слабоокрашенный хлорид железа – равновесие сместилось в сторону исходных веществ.
Слайд 53Вывод: чтобы сместить химическое равновесие вправо, нужно увеличить концентрацию исходных
веществ, а в лево – в сторону продуктов реакции.
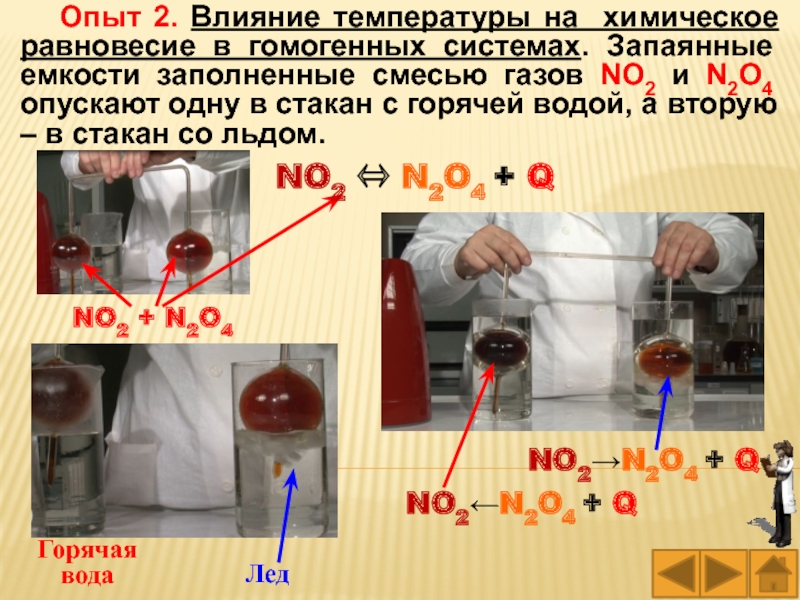
Слайд 54Опыт 2. Влияние температуры на химическое равновесие в гомогенных системах.
Запаянные емкости заполненные смесью газов NO2 и N2O4 опускают одну
в стакан с горячей водой, а вторую – в стакан со льдом.
Лед
Горячая вода
NO2 + N2O4
NO2N2O4 + Q
NO2N2O4 + Q
NO2 N2O4 + Q
Слайд 55Реакция перехода оксида азота (IV) в димер этого оксида является
экзотермической:
NO2 N2O4 + Q,
поэтому при охлаждении равновесие смещает-ся в
сторону продуктов реакции, а при нагревании – в сторону исходных веществ.
Слайд 56Практическая работа № 9 «Химическое равновесие в гетерогенных системах»
Слайд 57Цель – Познакомиться с условиями смещения химического равновесия в гетерогенных
системах.
Приборы и реактивы: химическая посуда, индикатор (фенолфталеин), NaOH, NH4OH.
Слайд 58Опыт 1. Влияние температуры на смещение химического равновесия.
В растворе гидроксида
аммония всегда соблюдается равновесие:
NH3 + H2O NH4OH NH4+
+ OH–
аммиак гидроксид ион гидроксид-
аммония аммония ион
В стакан с раствором гидроксида аммония добавляем фенолфталеин – раствор стал малиновым.
Слайд 59В стакан с раствором гидроксида натрия добавляем фенолфталеин – раствор
стал малиновым.
NaOH
NH4OH
NaOH Na+ + OH–
Слайд 60Разольем полученные растворы в колбы.
Слайд 61При нагревании полученных растворов изменение окраски (обесцвечивание) происхо-дит в колбах
с гидроксидом аммония – равновесие смещается в сторону образования аммиака:
NH3
+ H2O NH4OH
Слайд 62При охлаждении колбы с раствором гидроксида аммония окраска постепенно восстанавливается
– равновесие смещается в сторону образования гидроксид-иона:
NH4OH NH4+ +
OH–
Лед
Слайд 63NH3 + H2O NH4OH NH4+ + OH–
Экзотермическая реакция
Эндотермическая
реакция
Вывод: для увеличения выхода образования аммиака раствор нужно охладить, а
для увеличения выхода образования гидроксида аммония раствор нужно нагреть.
Слайд 64Ивчатов А. Л., Малов В. И. Химия воды и микробиология.
– М.: ИНФРА-М, 2006. – 218 с.
Новошннский И. И., Новошинская
Н. С. Химия: учебник для 10(11) класса общеобразовательных учреждений/И. И. Новошинский, Н. С. Новошинская. – М.: ООО «Русское слово – учебник», 2014. (ФГОС. Инновационная школа).
Саенко О.Е. Аналитическая химия: учебник для средних специальных учебных заведений / О.Е. Саенко – Ростов н/Д.: Феникс, 2014.– 288 с. – (Среднее профессиональное образование)
В. Д. Валова (Копылова), Е. И. Паршина. Аналитическая химия и физико-химические методы анализа. Практикум. – М.: Дашков и Ко, 2012.– 200 с. – (Учебное издание для бакалавров)
Т.И. Хаханина, Н.Г. Никитина. Аналитическая химия и практикум: учебник для СПО. – М.: Юрайт, 2015.– 278 с. – (Учебное издание для бакалавров)
Использованные источники
Слайд 65Габриелян О. С., Остроумов И. Г. Химия для профессий и
специальностей технического профиля: учебник для студ. учреждений сред. проф. образования.
– М.: ИЦ «Академия», 2014.
Габриелян О.С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественнонаучного профиля: учебник для студ. учреждений сред. проф. образования. – М.: ИЦ «Академия», 2014.
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред. проф. образования. – М.: ИЦ «Академия», 2014.
Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. Образования. – М.: ИЦ «Академия», 2014.
Использованные источники
Слайд 66Химическое равновесие – Википедия ru.wikipedia.org›
Химическое равновесие в растворах.wmv youtube.com
video.yandex.ru›химическое равновесие ... опыты
yandex.ru/images›химическое равновесие ... опыты
Влияние температуры на скорость реакции youtube.com
Влияние температуры на скорость химических
… youtube.com
yandex.ru/images›Влияние температуры на скорость реакции ... опыты
yandex.ru/images›Гидролиз солей ... опыты
Гидролиз солей - youtube.com
Использованные источники