Слайд 1Методы оценки врождённого иммунитета
Родина А.С. Группа 3.4.01
Слайд 2Врождённый иммунитет – наследственно закреплённая система защиты многоклеточных организмов от
любых патогенных и непатогенных организмов, а также эндогенных продуктов тканевой
деструкции.
Характеристика:
Обеспечивает распознавание и элиминацию патогенов в первые несколько минут/часов после их проникновения в организм, когда механизмы адаптивного иммунитета еще отсутствуют
Его функции осуществляются через клеточные ( макрофаги, ДК, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-и NKT- клетки, B1-лимфоциты и γδТ-клетки) и гуморальные факторы (естественные АТ, цитокины, комплемент, белки острой фазы, катионные противомикробные липиды, лизоцим)
Слайд 3Клетки врождённого иммунитета не образуют клонов
Клетки врождённого иммунитета не подвергаются
негативной и позитивной селекции
Распознавание патогенов происходит с помощью многочисленные
рецепторные структуры ( Scavenger-рецепторы, маннозные рецепторы, рецепторы комплемента, лектиновые рецепторы, PRR )
Факторы врождённого иммунитета не изменяются в процессе жизни организма, контролируются генами зародышевой линии и наследуются
Его активация не формирует продолжительной иммунной памяти, но необходима для развития адаптивного и.о.
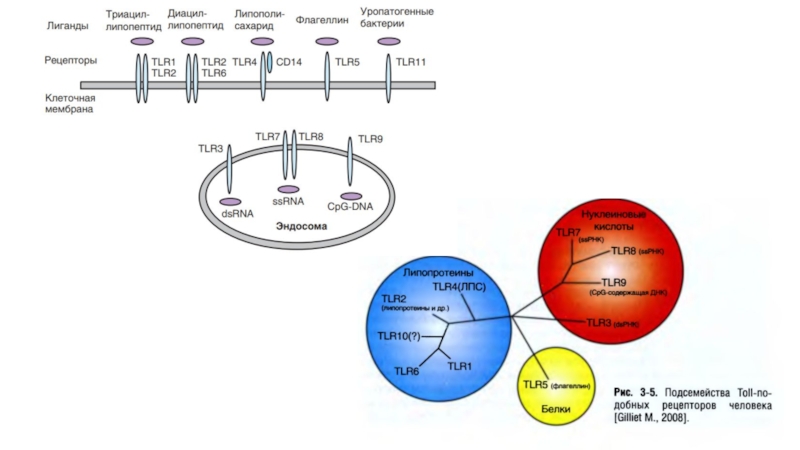
Слайд 4Toll-like receptors (TLR)
TLR — трансмембранные гликопротеины I типа (т.е.
с NH2-концом, направленным наружу клетки). Их молекулярная масса составляет 90–115
кДа.
Внеклеточная часть молекул TLR образована доменом, содержащим 19–25 повторяющихся последовательностей — богатых лейцином повторов — LRR (от
Leucine-rich repeats). Эти последовательности состоят из 24–29 аминокислотных
остатков и содержат мотив xxLxLxL (L — лейцин, х — любые другие остатки), а
также дополнительные консервативные остатки лейцина (обычно 4–6 остатков
в каждой). Этот внеклеточный домен TLR называют LRR-доменом.
Слайд 5Цитоплазматическая (C-концевая) часть рецептора представлена
TIR-доменом (Toll/IL-1 receptor and resistance domain),
ответственным за взаимодействие с адаптерными молекулами сигнальных путей. TIR-домен
состоит из
центрального β-слоя (образован 5 β-цепями), окруженного 5
α-спиралями.
Между LRR- и TIR-доменами расположен короткий трансмембранный участок, отвечающий за выбор типа мембраны (клеточная или лизосомальная) и встраивание в нее.
В результате TLR, распознающие паттерны на поверхности бактерий, грибов, простейших, а также продукты жизнедеятельности микроорганизмов (TLR-1, TLR-2, TLR-4, TLR-5, TLR-6, TLR-11), локализованы на внешней клеточной мембране.
Внутри клетки (в эндосомах/лизосомах) расположены TLR, распознающие нуклеиновые кислоты (TLR-3, TLR-7, TLR-8, TLR-9), при этом их паттернраспознающая часть направлена внутрь гранулы. Важно отметить, что TLR-4 может присутствовать не только на наружной мембране, но и в эндолизосомах.
Слайд 7TLR в покоящихся клетках — мономерные
молекулы, но при взаимодействии с
лигандами они формируют димеры — обычно гомодимеры; однако при распознавании
грамположительных бактерий и их липидсодержащих компонентов TLR-1, TLR-2 и TLR-6 формируют гетеродимеры состава TLR-2/TLR-1 и TLR-2/TLR-6
Слайд 9Оценка экспрессии TLR
Взятие периферической крови в гепаринизированные пробирки
Выделение
мононуклеарных клеток на градиенте фиколл-урографина
Культивирование МНК в среде РПМИ 1640
(24ч)
Инкубация полученных МНК с FITC-меченными антителами к СD14+, РЕ-меченными антителами к TLR2 и TLR4 с соответствующими изотипическими контролями (30 мин при 40С).
Анализ экспрессии CD14, TLR2 и TLR4 на проточном цитофлуориметре
Оценка процента моноцитов, несущих на своей поверхности TLR2 и TLR4, и средней интенсивности флуоресценции в усл.ед.
Слайд 10Определение функциональной активности TLR
Взятие периферической крови в гепаринизированные пробирки
Выделение мононуклеарных клеток на градиенте фиколл-урографина
Культивирование МНК в среде РПМИ
- 1640 (24ч)
Выделенные МПК помещаются в 96-ти луночный планшет и культивируются (24ч) с добавлением TLR-лиганда: пептидогликан 5 мкг/мл, зимозан 10,0 мкг/мл, ЛПС 0,1 мкг/мл, флагеллин 0,5 мкг/мл, Poly(I:C) 20 мкг/мл и олигодезоксинуклеотид (ОДН) CpG 1,0 мкг/мл, действующие через TLR1/2, TLR2/6, TLR4, TLR5, TLR3 и TLR9, соответственно.
Контроль – МНК, культивируемые только в полной среде (спонтанная выработка TNF-α)
Осаждение МНК центрифугированием при 400 g в течение 15 мин с получением супернатанта
Определение концентрации цитокинов в супернатанте с помощью ИФА (тест-системы)
КС(коэф. стимуляции) - отношение концентрации цитокина в супернатантах стимулированных лигандами МНК к концентрации цитокинов в супернатантах нестимулированных МНК.
Слайд 11γδТ- лимфоциты
Выделяют циркулирующие и резидентные γδТ-лимфоциты.
Циркулирующие γδТ-лимфоциты составляют в
среднем 1-10% от мононуклеаров периферической крови (МПК). Экспрессируют: СD3+Vγ9Vδ2+TCR
РезидентныеγδТ-лимфоциты
имеют СD3+Vδ1+ или СD3+Vδ3+ТCR и доминируют в слизистых оболочках желудочно-кишечного, респираторного и урогенитального трактов. Большинство резидентных γδТ-клеток развиваются тимуснезависимым способом. Помимо выполнения эффекторной цитотоксической функции, резидентные γδТ-лимфоциты играют большую роль в иммунорегуляции и иммунологическом надзоре организма. Также было показано, что резидентные внутриэпителиальные Т-клетки с γδTCR находятся в дифференцированном, но покоящемся состоянии («activated-yet-resting Т-cells») и участвуют в реализации механизмов врожденного иммунитета.
Слайд 12Определение функциональной активности γδТ- лимфоцитов
Взятие периферической крови в гепаринизированные
пробирки
Выделение МПК с помощью центрифугирования в градиенте плотности
Выделенные
МПК помещаются в 96-ти луночный планшет. Часть лунок культивируется только с добавлением среды, другая - с добавлением бактериального антигена (например ЛПС). В лунках отдельного планшета выделенные МПК культивируются с митогеном ФМА (форбол-миристат-ацетат) c иономицином кальция.
Инкубация обоих планшетов с Брефельдином А, который блокирует транспорт из ЭПР в аппарат Гольджи. (5 часов)
Пермеабилизация органическими растворителями или детергентами (раствор сапонина, Trition-X-100, Tween-20) (несколько минут)
Отмывка, центрифугирование, культивиррование меченными моноклональными антителами на цитокины и маркёры на поверхности мембран: FITC (Pan- γδT ), PE (Vδ2 γδ TCR), PerCP-Cy5.5 (CD3), PE-Cy7 (IL-4), APC (TNF- α), APC-Cy7 (IFN-γ) (30мин)
Отмывка, фиксация параформальдегидом, получение результатов в проточной цитофлоуметрии
Так, было показано, что у ВИЧ-положительных пациентов не только снижено количество γδТ- лимфоцитов, но также и способность выработки цитокинов.

Слайд 13Определение количества γδТ- лимфоцитов
Взятие периферической крови в гепаринизированные пробирки
Выделение
МПК с помощью центрифугирования в градиенте плотности
Культивирование с моноклональными
АТ
Определение методом проточной цитофлоуриметрии
В ряде исследований было установлено, что снижение CD3+CD4+ клеток у ВИЧ-инфицированных лиц находится в тесной взаимосвязи с падением количества Т-клеток, несущих TCRγδ рецептор, что подтверждается данными зарубежных исследований о положительной корреляции γδТ-клеток с уровнем CD3+CD4+ лимфоцитов. Механизмы количественного
и качественного истощения субпопуляции γδТ-клеток неизвестны, частично потому, что эти клетки не несут рецептор CD4 и, следовательно,
устойчивы к ВИЧ.
Слайд 15NK – клетки
Основные маркёры: CD16 (FcγRIII к IgG), CD56.
У человека были идентифицированы 2 субпопуляции NK-клеток - CD56bright и
CD56dim
Большинство CD56dim NK-клеток экспрессируют высокий уровень FcγRIII CD16 и перфорина, в то время как CD56bright NK-клетки являются CD16- neg/low и перфориннегативными. CD56dim NK-клетки обладают непосредственной цитотоксической активностью, в то время как CD56bright NK-клетки приобретают ее только после добавления IL-2.
CD56bright субпопуляция составляет приблизительно 10– 20% от общего количества NK-клеток и преимущественно локализованы в лимфатических узлах и экспрессируют L-селектин и рецепторы хемокинов CCR5 и CCR7.
CD56dim NK-клетки, практически отсутствуют в лимфатических узлах, но составляют 95% NK-клеток крови и 85% NK-клеток селезенки. Они экспрессируют рецепторы для хемокинов CCR4, CXCR1 и CX3CR1
Основные функции:
Лизис опухолевых и инфицированных вирусами клеток
Регуляция врожденного и адаптивного иммунных ответов за счет секреции цитокинов (IFN-γ, TNFα и ИЛ-10), ростовых факторов (GM-CSF, G-CSF и ИЛ-3) и хемокинов (CCL3, CCL4, CCL5, XCL1 и CXCL8)

Слайд 16Оценка цитотоксичности NK-клеток
Взятие периферической крови в гепаринизированные пробирки
Выделение мононуклеарных
клеток на градиенте фиколл-урографина
Смешивание с культурой клеток К-562, контроль –
К-562 в полной среде, инкубация.
Цитофлоуметрия с использованием двух меток – на живые клетки-мишени и на мертвые клетки
Процент убитых клеток получается путём вычитания результата контроля из опытного результата
Слайд 17Оценка выработки цитокинов NK-клетками
Взятие периферической крови в гепаринизированные пробирки
Выделение МПК с помощью центрифугирования в градиенте плотности
Выделение NK-клеток
методом иммуномагнитной сепарации
Культивация на среде РПМИ 1640
NK-клетки в концентрации 1,5 млн/мл икубируюся в 96-луночных иммунологических планшетах в полной питательной среде с цитокинами, IL-2, LPS в СО2-инкубаторе в течение 18 ч.
Клетки осаждаются, отбираются супернатанты для иммуноферментного анализа,
Добавляли брефелдин А в концентрации 10 мкг/мл либо моненсин в концентрации 5 мкг/мл и инкубировали клетки дополнительно 4 ч.
Супернатанты от стимулированных клеток замораживали => Иммуноферментный анализ продукции IFN-γ
Клетки окрашивали флуоресцентномечеными антителами к поверхностным маркерам и проводили их фиксацию 2%-ным раствором параформальдегида.
Пермеабилизация в растворе PBS, содержащем 1% FCS, 0,02% азида натрия и 1% тритона Х-100.
Клетки окрашиваются флуоресцентномечеными антителами к IFN-γ или TNF-α и анализируется методом проточной цитофлуориметрии. Уровень продукции IFN-γ определяется по доле продуцирующих клеток.

Слайд 18Методы оценки системы комплемента
1) Определение гемолитической активности комплемента . Для исследования
компонентов классического пути активации комплемента определяют его гемолитическую активность. Суть
метода заключается в следующем:
- разные разведения сыворотки больного и нормальной сыворотки добавляют к эритроцитам барана, покрытым антителами;
- степень гемолиза оценивают фотометрически по выходу гемоглобина в раствор.
За единицу гемолитической активности комплемента принимают величину, обратную тому разведению сыворотки, при котором разрушаются 50% эритроцитов.
Существуют модификации метода, основанные на применении небольших объемов исследуемой сыворотки. Определение гемолитической активности комплемента по 100% гемолизу основано на гемолизе в геле. Суть этого метода заключается в следующем:
- в геле, содержащем покрытые антителами эритроциты барана, делают лунки;
- в лунки вносят разные разведения исследуемой и нормальной сывороток;
- гемолитическую активность комплемента оценивают по диаметру зон гемолиза.
Активность комплемента зависит от целого ряда факторов, поэтому нарушение правил забора и хранения сыворотки обычно приводит к ошибочным результатам исследования.
Определение гемолитической активности комплемента позволяет обнаружить недостаточность компонентов комплемента , прежде всего участвующих в образовании мембраноатакующего комплекса.

Слайд 19Методы оценки системы комплемента
2) Тесты определения ЦИК, используемые в клинической
практике, основаны на:
преципитации ЦИК полиэтиленгликолем 6000 (ПЭГ-6000);
взаимодействии ЦИК
с комплементом (C1q-тест);
связывании ЦИК с аутоантителами, такими, как моноклональный ревматоидный фактор (mRF-тест)
Слайд 20Методы определения хемотаксиса
ДЕЙСТВИЕ ХЕМОАТТРАКТАНТА
ХЕМОКИНЕЗ
ХЕМОТАКСИС
Слайд 221.2.Трансвелл планшеты
24-,12- или 6-ти луночные планшеты,
Лунки разделены на две
камеры
Слайд 23Трансвелл планшеты
Суспензия клеток в верхнюю лунку, хемоаттрактант – в
нижнюю
Контроль – лунки со средой ( спонтанная миграция )
Инкубация : 37 ⁰С, 5% СО2 , t= 1-2 ч
Оценка: подсчёт в суспензии или после фиксации с окрашиванием
Слайд 252. Определение иммунофенотипа нейтрофилов
Слайд 263. Определение фагоцитарного индекса
Клетки (200млн/мл) + ФИТЦ (0,1 мг/мл)
12ч в карбонатно-бикарбонатном буфере, pH = 9.5, +4 ⁰С. Несвязавшийся
ФИТЦ удаляют трёхкратной отмывкой при 1000g.
В лунки 96-ти луночного планшета добавляют взвесь меченного стафилококка и взвешенныую лейкоцитарную смесь ( 1 к 10 ).
Инкубация 20 мин при 37 ⁰С. Отмывка ФСБ с 0.02% ЭДТА. Фиксация ФСБ + 2% параформальдегида + 0.02% ЭДТА. Хранение до 2 суток при T = +4 ⁰C.
Слайд 27Определение фагоцитарного индекса
Слайд 284. Определение фагоцитарного числа
Основные этапы реакции те же, что и
при определении фагоцитарного индекса.
Слайд 295.Определение внутриклеточной гибели микроорганизмов в лейкоцитах
Микроскопический метод (наиболее показательно
с Candida)
Бактериологический метод (для разрушения лейкоцитов – дистиллированная вода)
+ Радиометрический метод
Слайд 306.Определение внутриклеточной гибели микроорганизмов в лейкоцитах
Слайд 317.Определение переваривающей способности лейкоцитов
Слайд 328.Оценка дегрануляции нейтрофилов
Слайд 33Использованная литература
Бердюгина О.В., Ершова А.В. КОЛИЧЕСТВЕННАЯ И ФУНКЦИОНАЛЬНАЯ ОЦЕНКА СОСТОЯНИЯ
Т-ЛИМФОЦИТОВ ПРИ ТУБЕРКУЛЕМАХ ЛЕГКОГО // Современные проблемы науки и образования.
– 2016. – № 1.
Gamma/Delta T-Cell Functional Responses Differ after Pathogenic Human Immunodeficiency Virus and Nonpathogenic Simian Immunodeficiency Virus Infections. David A. Kosub, Ginger Lehrman, Jeffrey M. Milush, Dejiang Zhou, Elizabeth Chacko, Amanda Leone, Shari Gordon, Guido Silvestri, James G. Else, Philip Keiser, Mamta K. Jain, Donald L. Sodora. Journal of Virology Jan 2008, 82 (3) 1155-1165;
Zurochka A.V., Gavrilova T.V., Shestakova E.V., Kvyatkovskaya S.V., Mirkina T.V., Chereshnev V.A. EVALUATION OF INTERDEPENDENCE BETWEEN γδT-CELL LEVELS AND CD3+CD4+ T-LYMPHOCYTE CONTENTS IN HIV-INFECTED PATIENTS. Medical Immunology (Russia). 2010;12(4-5):425-428. (In Russ.)
Л.В.Ковальчук, М.В.Хореева и др. Рецепторы врожденного иммунитета: подходы к количественной и функциональной оценке TLR человека. Иммунопатология и клиническая иммунология 2008, 223-227.
Ковальчук, Л. В., Хорева, М. В., Никонова, А. С., Константинова, Е. В., Юдин, А. А., & Николаева, М. А. (2010). Изучение системы Toll-подобных рецепторов врожденного иммунитета в острый период после инфаркта миокарда. Вестник Российского государственного медицинского университета, (1), 19-24.
БАХУС Галина Олеговна НОВЫЕ ПОДХОДЫ К ОЦЕНКЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ С ПОМОЩЬЮ ПРОТОЧНОЙ ЛАЗЕРНОЙ ЦИТОМЕТРИИ 14.00.36-Аллергология и иммунология АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата биологических наук