Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы разделения и концентрирования Спецкурс Лектор – проф. С.Г. Дмитриенко
Содержание
- 1. Методы разделения и концентрирования Спецкурс Лектор – проф. С.Г. Дмитриенко
- 2. Лекция 1 Общая характеристика методов разделения и концентрирования
- 3. Направления развития современной аналитической химии
- 4. Разделение и концентрирование веществ: место в химическом
- 5. Интересно! Современное развитие аналитического приборостроения и компьютерной
- 6. Зачем нужны методы разделения и концентрирования? 1.
- 7. Историческая справка Развитие методов разделения и концентрирования
- 8. ДАННЫЕ ВОЗ:Промышленностью разных стран мира выпускается или
- 9. 1. Выделение примесей из различных объектов и
- 10. Замена водной матрицы на другую,
- 11. Основные понятия и термины
- 12. РазделениеРазделение – операция (процесс), в результате
- 13. Концентрирование — операция (процесс), в результате которой
- 14. Микрокомпоненты – компоненты, содержащиеся в промышленных, геологических,
- 15. Основные понятия и термины. Абсолютное концентрирование
- 16. Основные понятия и термины. Относительное концентрированиеОтносительное
- 17. 1. Абсолютное концентрированиеУпаривание матрицы при анализе вод,
- 18. 2. Относительное концентрирование В тех же
- 19. Индивидуальное концентрирование – это операция, в результате
- 20. 1.Удалением матрицыКогда?а) в случае, когда она имеет
- 21. Комбинированные методы – это методы, которые основаны
- 22. Гибридные методы – это методы, которые
- 23. Примеры гибридных методов анализа 1. Хроматографические методы.
- 24. «On-line» методы анализа В этих методах анализа
- 25. Достоинства концентрирования 1. Снижаются относительные и абсолютные
- 26. Недостатки концентрированияУсложняется и удлиняется
- 27. 1. Коэффициент распределенияCA(1) , C A(2)
- 28. 2. Степень извлечения
- 29. 3. Коэффициент разделения
- 30. 4. Коэффициент концентрирования
- 31. Классификация методов разделения и концентрирования по природе
- 32. Классификация методов по фазовому состоянию системы в
- 33. В методах разделения и концентрирования веществ, основанных
- 34. Мембранные методы разделения (основаны на индуцируемом межфазном
- 35. Методы внутрифазного разделения (основаны на разделении компонентов
- 36. Критерии оценки: Возможность индивидуального К. Возможность группового
- 37. Сорбция Жидкостная экстракция (Э.) Сверхкритическая
- 38. Общая характеристика экстракционных методов разделения и концентрирования
- 39. Слайд 39
- 40. Жидкость-жидкостная экстракцияЭКСТРАКЦИЯ (Э.) это процесс
- 41. Достоинства метода: Универсальность; Возможность выбора большого числа
- 42. ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ Экстрагент – органический
- 43. ПРИ ОПИСАНИИ Э. И ВЫБОРЕ УСЛОВИЙ НАС
- 44. Условия экстракции вещества Нейтрализация заряда. Чтобы
- 45. Способы осуществления Э. Периодическая Э.Vв = 0,1
- 46. Способы осуществления жидкость-жидкостной микроэкстракции (ЖЖМЭ)ЖЖМЭ - экстракция
- 47. Э. в одну каплю органического растворителя (Single
- 48. Дисперсионная жидкостно-жидкостная микро-экстракция (dispersive liquid-liquid мicroextraction, DLLME,
- 49. Гомогенная экстракция или экстракция гидрофильными растворителямиЭкстрагенты
- 50. Гомогенная экстракция или экстракция гидрофильными растворителямиПреимущества
- 51. Мицеллярная экстракция или экстракция на основе точки
- 52. Мицеллярная экстракцияЗа счет чего происходит расслаивание системы
- 53. Преимущества мицеллярной Э. Высокая степень извлечения
- 54. 5. Экстракция расплавамиЭкстрагенты:1. Расплав орг. реагента (8
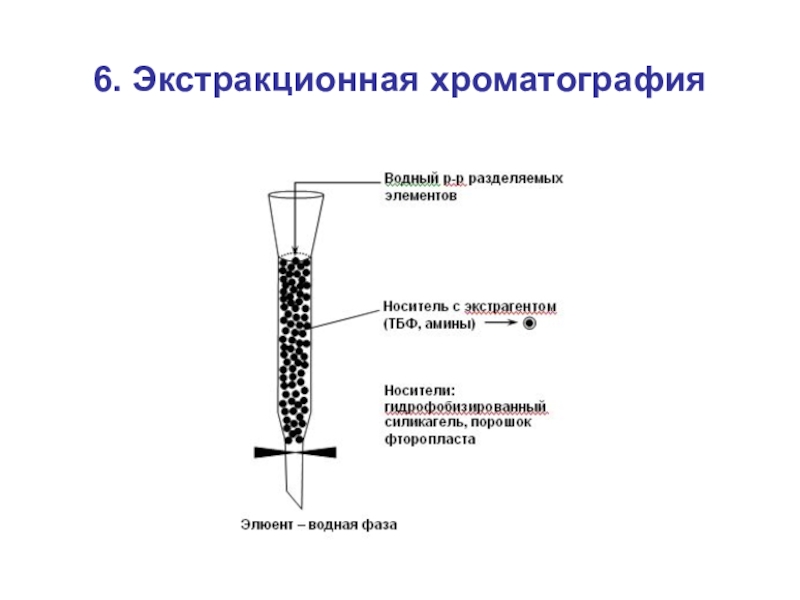
- 55. 6. Экстракционная хроматография
- 56. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ЭКСТРАКЦИИКонстанта распределения (КD) 2. Коэффициент
- 57. 3. Степень извлечениягде Q(o) и
- 58. 54. Степень извлечения после n-кратной экстракцииПример: Коэффициент
- 59. 5. Константа экстракции (Кex)М(в) + mHL(о) α
- 60. Спасибо за внимание
- 61. ВопросыНазовите основные виды концентрирования.Что такое коэффициент распределения,
- 62. 2. Непрерывная (полупротивоточная) Э. Приборы для непрерывной
- 63. Классификация методов разделения и концентрирования по фазовому
- 64. Классификация методов разделения и концентрирования по фазовому
- 65. Методы разделения, основанные на образовании веществом новой фазы
- 66. Мембранные методы разделения
- 67. Методы внутрифазного разделения
- 68. Скачать презентанцию
Слайды и текст этой презентации
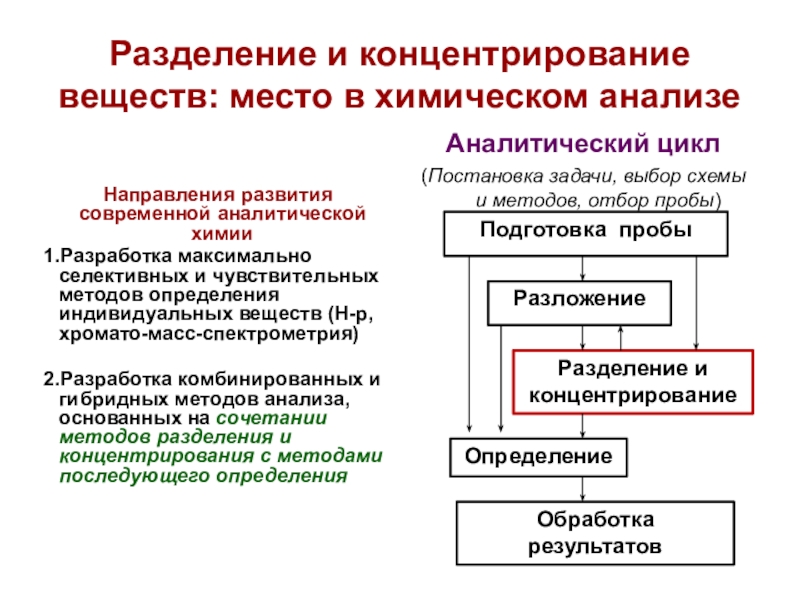
Слайд 4Разделение и концентрирование веществ: место в химическом анализе
Направления развития
современной аналитической химии
1.Разработка максимально селективных и чувствительных методов определения индивидуальных
веществ (Н-р, хромато-масс-спектрометрия)2.Разработка комбинированных и гибридных методов анализа, основанных на сочетании методов разделения и концентрирования с методами последующего определения
Аналитический цикл
(Постановка задачи, выбор схемы и методов, отбор пробы)
Подготовка пробы
Разложение
Разделение и концентрирование
Определение
Обработка результатов
Слайд 5Интересно!
Современное развитие аналитического приборостроения и компьютерной техники обеспечивает
надежное проведение стадий определения и обработки результатов анализа, которое достаточно
часто осуществляется в автоматическом режиме.Напротив стадия пробоподготовки, составной и неотъемлемой частью которой являются операции разделения и концентрирования, по-прежнему остается наиболее трудоемкой и наименее точной операцией химического анализа Если длительность измерения и обработки результатов имеет порядок минут и реже секунд, то продолжительность пробоподготовки – порядок часов и реже минут. (61% суммарного времени анализа)
По мнению специалистов, работающих в области экоаналитического контроля суммарная погрешность анализа выглядит так:
стадия измерения сигнала – 10%;
пробоподготовка – 45%
пробоотбор – 45%
Ошибки, допущенные при отборе проб и их подготовке, могут полностью исказить результаты химического анализа.
Слайд 6Зачем нужны методы разделения и концентрирования?
1. Для устранения мешающего
влияния
Способы устранения мешающего влияния:
1.1. Изменение формы
существования компонентов
а) маскирование
(связывание в комплексы);б)изменение степени окисления;
в) переведение мешающего
компонента в менее
реакционноспособную форму
1.2. Разделение нужных и мешающих компонентов
2. Для снижения относительных и абсолютных пределов обнаружения
2. Для устранения матричных эффектов
3. Для уменьшения погрешностей, связанных с отбором пробы (особенно если микрокомпоненты распределены в ней неравномерно)
4. На стадии концентрирования удобно вводить внутренние стандарты
5. Для снижения стоимости анализа
Слайд 7Историческая справка
Развитие методов разделения и концентрирования всегда стимулировали требования
практики
1950-1970-е годы: Обострение потребности в веществах особой чистоты (материалы
для ядерной энергетики, полупроводники). Необходимость одновременного определения большого числа элементов с очень низкими пределами обнаружения
1970-1980-е годы: Формирование методологии концентрирование следов элементов:
1. Золотов Ю.А., Кузьмин Н.М. Экстракционное концентрирование. М.: Химия, 1971.
2. Золотов Ю.А., Кузьмин Н.М. Концентрирование микроэлементов. М.: Химия, 1982.
3. Кузьмин Н.М., Золотов Ю.А. Концентрирование следов элементов. М.: Наука, 1988.
1970-2000-е годы: Обострение потребности в анализе объектов окружающей среды. Необходимость определения токсикантов на уровне ПДК.
1. Концентрирование следов органических соединений /Под ред. Н.М. Кузьмина. М.: Наука, 1990.(пробл. анал. хим.; Т. 10).
2000-е годы: Анализ биологических и медицинских объектов
Слайд 8ДАННЫЕ ВОЗ:
Промышленностью разных стран мира выпускается или используется около 500000
соединений (в основном органических). Из них:
40000 опасные для человека;12000 токсичные.
Из них нормируется 1500 соединений.
Обязательному определению подлежат:
130 США
30 Россия
Особо остро стоит проблема определения наиболее токсичных орг. веществ (полиароаматических углеводородов, полихлордибензодиоксинов, полихлордибензофуранов, полихлорбифенилов, пестицидов; ПДК: 1014 - 1010 %).
СОВРЕМЕННАЯ МЕТОДОЛОГИЯ ОПРЕДЕЛЕНИЯ
МАЛЫХ КОНЦЕНТРАЦИЙ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ В ВОДАХ
Слайд 91. Выделение примесей из различных объектов и их концентрирование;
2. Высокочувствительное
селективное определение выделенных примесей (в основном методами капиллярной газовой хроматографии
и ВЭЖХ)МЕТОДОЛОГИЯ АНАЛИЗА ОБЪЕКТОВ НА
ОРГАНИЧЕСКИЕ ПРИМЕСИ ВКЛЮЧАЕТ:
Слайд 10 Замена водной матрицы на другую,
более пригодную для анализа;
Увеличение концентрации примесей в новой
матрице;Отделение определяемых примесей от других компонентов смеси
ОСНОВНЫЕ ЗАДАЧИ ПРОБОПОДГОТОВКИ
И КОНЦЕНТРИРОВАНИЯ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ:
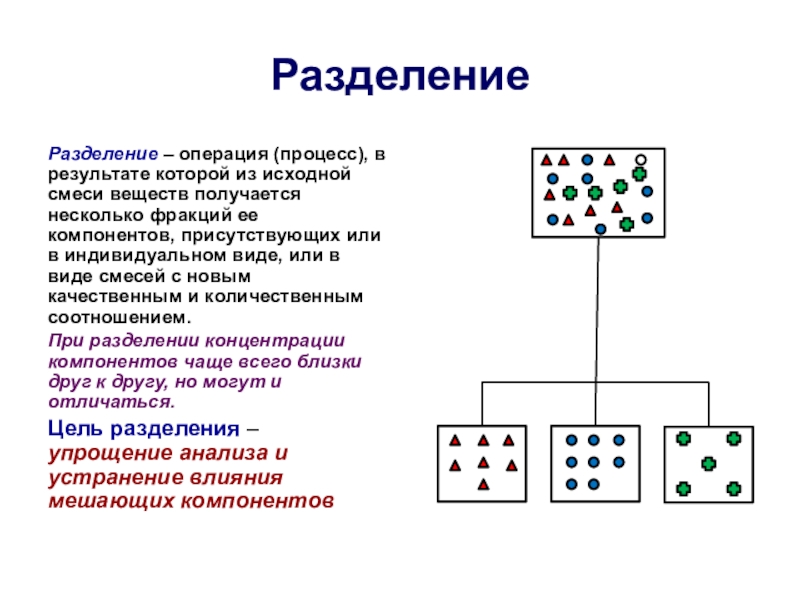
Слайд 12Разделение
Разделение – операция (процесс), в результате которой из исходной
смеси веществ получается несколько фракций ее компонентов, присутствующих или в
индивидуальном виде, или в виде смесей с новым качественным и количественным соотношением.При разделении концентрации компонентов чаще всего близки друг к другу, но могут и отличаться.
Цель разделения – упрощение анализа и устранение влияния мешающих компонентов
Слайд 13Концентрирование — операция (процесс), в результате которой повышается отношение концентрации
или количества микрокомпонентов по отношению к матрице или матричным компонентам.
Концентрирование
проводят в условиях, когда концентрации компонентов резко отличаются. Цель концентрирования – повышение чувствительности определения (снижение пределов обнаружения) и замена матрицы на подходящий концентрат
Основные понятия и термины.
Концентрирование
Слайд 14Микрокомпоненты – компоненты, содержащиеся в промышленных, геологических, биологических и других
материалах, а также в объектах окружающей среды, в концентрациях менее
100 мкг/г.Матрица – среда, в которой находятся микрокомпоненты.
Часто в качестве матрицы выступает вода или водный раствор кислот или солей.
В случае твердых образцов концентрирование проводят после переведения образца в раствор, в этом случае в растворе наряду с микрокомпонентами присутствуют матричные компоненты.
Основные понятия и термины
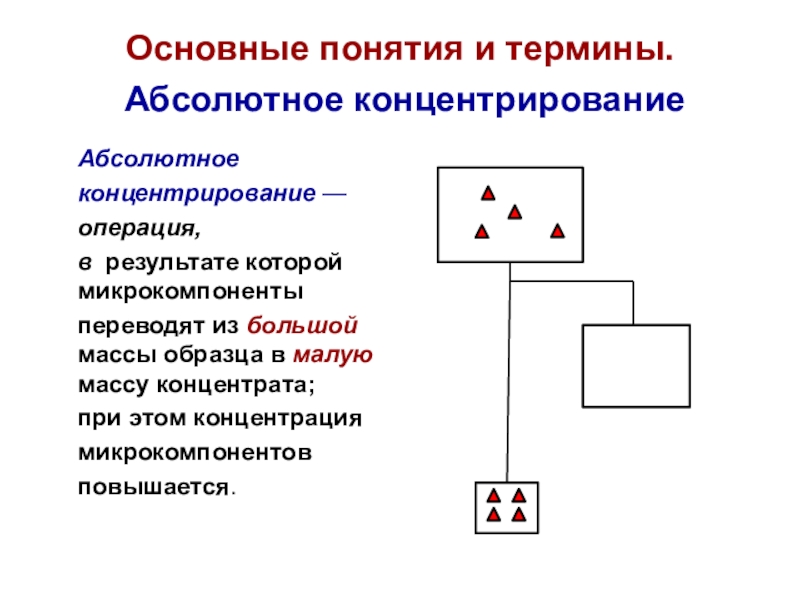
Слайд 15Основные понятия и термины.
Абсолютное концентрирование
Абсолютное
концентрирование —
операция,
в результате которой
микрокомпоненты
переводят из большой массы образца в малую массу концентрата;
при этом концентрация
микрокомпонентов
повышается.
0
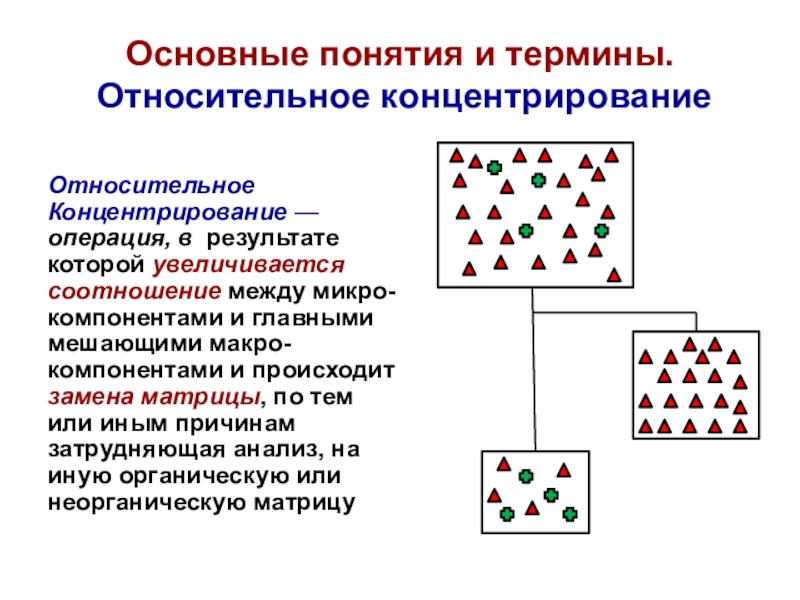
Слайд 16Основные понятия и термины.
Относительное концентрирование
Относительное
Концентрирование —
операция, в результате
которой
увеличивается
соотношение между микро-
компонентами и главными
мешающими макро-
компонентами и происходит
замена матрицы, по
тем или иным причинамзатрудняющая анализ, на
иную органическую или
неорганическую матрицу
0
Слайд 171. Абсолютное концентрирование
Упаривание матрицы при анализе вод, растворов минеральных кислот,
органических растворителей
Например, при упаривании 20 мл раствора свинца до 1
мл мы увеличиваем отношение массы определяемого компонента к общей массе пробы в 20 раз (при условии, что определяемый компонент полностью остался в растворе). Другими словами, мы сконцентрировали в 20 раз.
ПРИМЕРЫ
Слайд 182. Относительное концентрирование
В тех же 20 мл раствора
свинца содержался еще и цинк, причем его было в 100
раз больше, чем свинца. Мы провели концентрирование свинца, например экстракцией в 20 мл, при этом количество цинка сократили в 20 раз, теперь его лишь в 5 раз больше, чем свинца.Мы можем получить концентрат того же объема в 20 мл, при этом концентрация свинца не изменилась, но зато изменилась концентрация цинка.
Важно: те количества цинка, что перешли в экстракт, уже не будут мешать последующему определению свинца
На практике относительное и абсолютное концентрирование часто комбинируют: заменяют матричные компоненты на иную матрицу и «сжимают» концентрат микрокомпонентов до необходимой массы, например. выпариванием
ПРИМЕРЫ
Слайд 19Индивидуальное концентрирование – это операция, в результате которой из анализируемого
объекта выделяют один микрокомпонент или последовательно несколько микрокомпонентов
Групповое концентрирование –
это операция, в результате которой из анализируемого объекта за один прием выделяют сразу несколько микрокомпонентов Основные понятия и термины
Слайд 201.Удалением матрицы
Когда?
а) в случае, когда она имеет простой состав
(1-2 элемента) и можно подобрать соответствующий метод концентрирования (испарение,
экстракция );б) при проведении группового концентрирования
1.Выделением микрокомпонентов
Когда?
а)в случае многоэлементной матрицы и некоторых методов концентрирования (соосаждение );
б) при проведении избирательного концентрирования
Как проводят концентрирование ?
Слайд 21 Комбинированные методы – это методы, которые основаны на последовательном использовании
независимых приемов разделения (концентрирования) и определения
Нет строгой привязки метода разделения
к какому-то определенному методу определения.Определение проводят не в концентрате, а в растворе, полученном после дополнительной подготовки концентрата. Концентрат может быть проанализирован любым методом.
Сочетание концентрирования
с последующим определением
Комбинированные и гибридные методы анализа (1970-е годы, чл-корр. АН СССР Ю.А. Золотов)
Слайд 22 Гибридные методы – это методы, которые основаны на тесном
сочетании методов разделения (концентрирования) и последующего определения, взаимном влиянии этих
приемов, приводящем к образованию нерасторжимой комбинации, нередко реализуемой в виде единого аналитического прибора.Важно!
Концентрат или продукт разделения в большинстве случаев не надо подвергать дополнительной подготовке и приспосабливать к последующему определению.
Гибридные методы часто превосходят комбинированные по метрологическим характеристикам и затратам, их проще автоматизировать.
Сочетание концентрирования
с последующим определением
Слайд 23Примеры гибридных методов анализа
1. Хроматографические методы.
Разделение компонентов осуществляют
с помощью хроматографической колонки, а определение – с использованием различных
детекторов.2. Инверсионная вольтамперометрия.
В одном приборе осуществляется групповое концентрирование микрокомпонентов на поверхности индикаторного электрода с последующим электрохимическим растворением концентрата и регистрацией величины тока электрорастворения.
3. Сорбционно-спектроскопические и экстракционно-спектроскопические методы, сочетающие сорбционное (экстракционное) концентрирование микрокомпонентов с их определением непосредственно в твердом концентрате (экстракте) с помощью различных спектроскопических методов.
Слайд 24«On-line» методы анализа
В этих методах анализа реализуется все более
плотное сочетание концентрирования не только с определением, но и отбором
пробы и ее предварительной подготовкой. Такая гибридизация все чаще осуществляется автоматически, в том числе в потоке. Методы характеризуются высокими чувствительностью и производительностью, а также воспроизводимостью, обусловленной использованием замкнутых систем и точным дозированием растворов.Примеры
1. Проточные сорбционно-спектроскопические методы
В непрерывном режиме осуществляют концентрирование элементов на микроколонке, их десорбцию и определение в пламени атомно-абсорбционного спектрометра.
2.Сорбционно-ВЭЖХ методы
В циклическом режиме последовательно осуществляют сорбционное концентрирование микрокомпонентов, их десорбцию, разделение на колонке и определение.
При этом концентрат получают в неравновесных условиях и «целиком» доставляют в детектор в потоке жидкости или газа.
Слайд 25Достоинства концентрирования
1. Снижаются относительные и абсолютные пределы обнаружения
2. Устраняется
матричный эффект
3. Уменьшается погрешность, связанная с отбором пробы, особенно если
микрокомпоненты распределены в ней неравномерно4. На стадии концентрирования удобно вводить внутренние стандарты
5. Обеспечивается приемлемая стоимость анализа
Слайд 26
Недостатки концентрирования
Усложняется и удлиняется определение
Возрастает вероятность потерь и
загрязнений
Уменьшается число определяемых компонентов (иногда)
Слайд 27
1. Коэффициент распределения
CA(1) , C A(2) – общие концентрации вещества
А в концентрате (1) и равновесной водной фазе (2)
Количественные характеристики
концентрированияСлайд 282. Степень извлечения
R,% = qк/qпр×100
где q(к) и qпр)
– абсолютные количества микроэлемента в концентрате и исходной пробе
Слайд 29
3. Коэффициент разделения
αА/В =DA
:DBУсловие хорошего разделения двух веществ :
αА/В 104, и
DA·DB ≃ 1.
Почему?
Для количественного разделения двух веществ А и В, необходимо, чтобы 99 % вещества А перешло в концентрат, а 99 % вещества В осталось в равновесной водной фазе.
Слайд 304. Коэффициент концентрирования
К =(qк /Q к
): (qпр /Q пр )qк и qпр – абсолютные количества микроэлемента в
концентрате и исходной пробе,
Q к и Q пр – абсолютные количества макроэлемента в концентрате и исходной пробе
Коэффициент концентрирования показывает, во сколько раз изменяется отношение абсолютных количеств микро- и макрокомпонентов в концентрате по сравнению с этим же отношением в исходной пробе.
Слайд 31Классификация методов разделения и концентрирования по природе процесса
1. Химические и
физико-химические методы
Экстракционные
Сорбционные
Осаждение и соосаждениеЧастичное растворение матрицы
Электрохимические
Пробирная плавка
2. Физические методы
Испарение (упаривание, дистилляция, сублимация)
Кристаллизационные
Диффузионные
Фильтрационные
Методы диализа
.
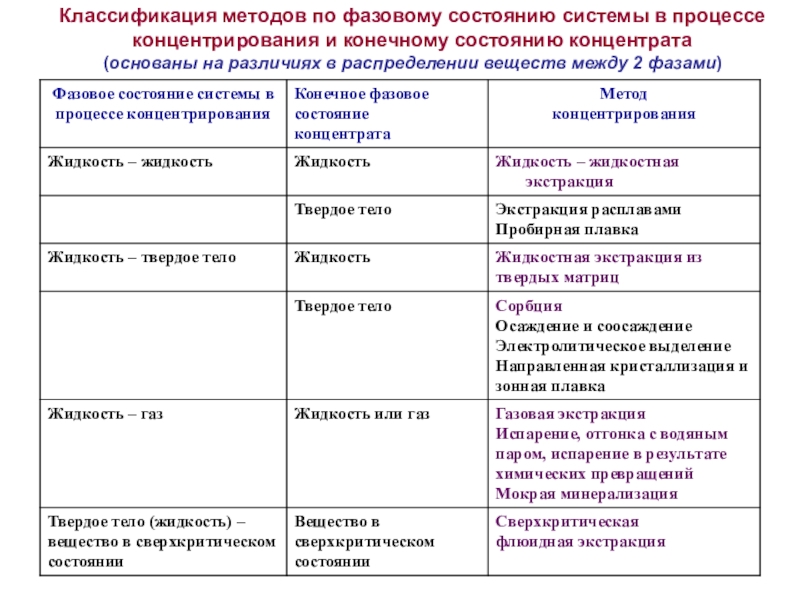
Слайд 32Классификация методов по фазовому состоянию системы в процессе концентрирования и
конечному состоянию концентрата
(основаны на различиях в распределении веществ между 2
фазами)Слайд 33В методах разделения и концентрирования веществ, основанных на различиях в
межфазном распределении, всегда существуют ограничения по массопереносу.
Из одной фазы
в другую не может перейти вещества больше, чем это следует из коэффициента распределения. Для решения задач, требующих увеличения массопереноса без возрастания объема разделяющей фазы, более перспективными оказались две группы методов, основанные:
1) на индуцируемом межфазном переносе вещества из одной фазы в другую, через разделяющую их третью фазу, являющуюся мембраной, или
2) на разделении компонентов в пределах одной гомогенной фазы под воздействием электрического, магнитного, гравитационного или теплового полей.
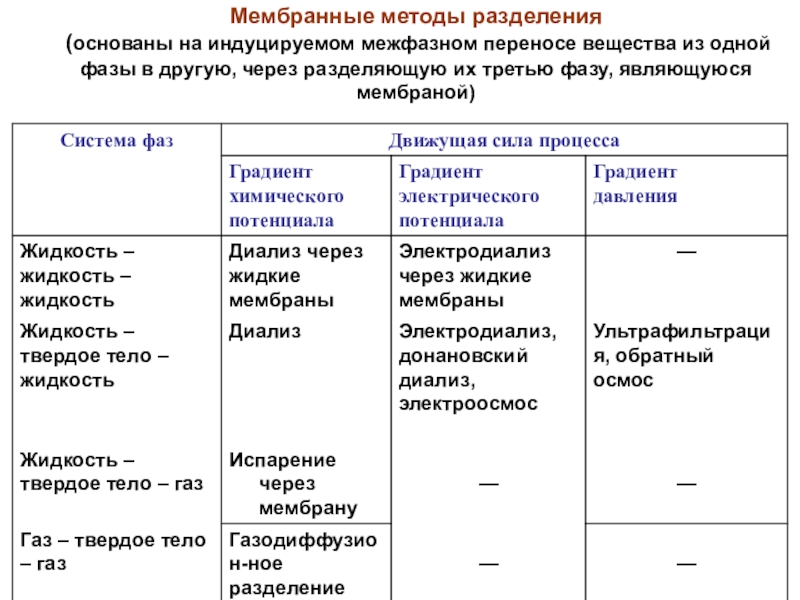
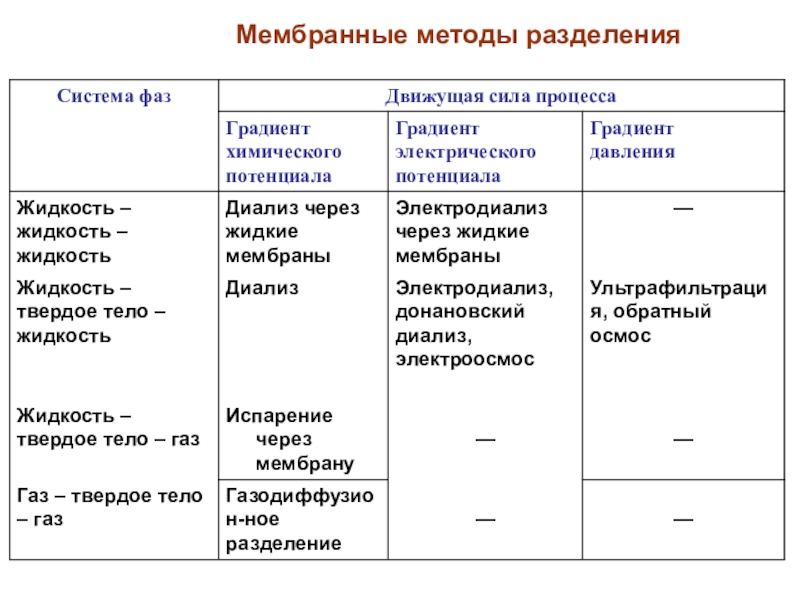
Слайд 34Мембранные методы разделения
(основаны на индуцируемом межфазном переносе вещества из
одной фазы в другую, через разделяющую их третью фазу, являющуюся
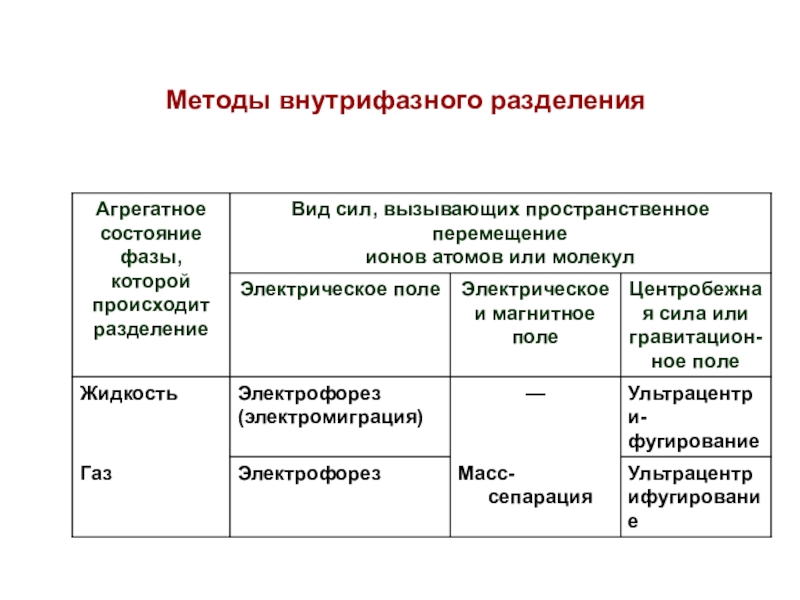
мембраной)Слайд 35Методы внутрифазного разделения
(основаны на разделении компонентов в пределах одной
гомогенной фазы под воздействием электрического, магнитного, гравитационного или теплового полей)
Слайд 36Критерии оценки:
Возможность индивидуального К.
Возможность группового К.
Величина коэффициента
концентрирования.
Воспроизводимость результатов К
(влияние матрицы, опасность
потерь и т.п.).Возможность сочетания с другими методами К.
Возможность сочетания с методами последующего определения.
Возможность автоматизации.
Экспрессность.
Простота.
Доступность.
Применимость к широкому кругу задач
(объекты различной природы, микрокомпоненты различной природы и др.).
Требования к квалификации исполнителя.
Обеспеченность приборами, устройствами.
Распространенность.
Обеспеченность методиками.
Экономичность метода.
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ
МЕТОДОВ КОНЦЕНТРИРОВАНИЯ (К)
Слайд 37
Сорбция Жидкостная экстракция (Э.)
Сверхкритическая флюидная Э.
Газовая Э.
Мокрая и сухая минерализация Другие методы
К.РАСПРОСТРАНЕННОСТЬ МЕТОДОВ К. ПРИ АНАЛИЗЕ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ
Слайд 39 ЭКСТРАКЦИЯ (Э),
ЭКСТРАГИРОВАНИЕ
(extraction –извлечение, от лат. Еxtraho – вытягиваю,
извлекаю )
это перевод одного или несколькихкомпонентов из жидкости или твердого тела в другую
жидкую или газообразную фазу.
Различают:
Жидкость-жидкостную экстракцию
Жидкостную экстракцию из твердых тел
Экстракция в аппарате Сокслета
Ультразвуковая Э. и Э. микроволновом поле
Экстракция в субкритических условиях
Экстракция субкритической водой
Сверхкритическую флюидную экстракцию
Твердофазную экстракцию
Газовую экстракцию
Слайд 40 Жидкость-жидкостная экстракция
ЭКСТРАКЦИЯ (Э.) это процесс распределения вещества между
двумя несмешивающимися растворителями и
соответствующий метод выделения, разделения и концентрирования, основанный на таком распределенииСлайд 41Достоинства метода:
Универсальность;
Возможность выбора большого числа
экстрагентов;
Возможность регулирования селективности (рН,
состав фаз, температура);
Простота и доступность оборудованияНедостатки
Необходимость работы с горючими и токсичными растворителями (300 мл CH2Cl2 загрязняет на уровне ПДК 5106% 6 млн. литров воды или 6 млн. м3 воздуха);
Необходимость использования растворителей высокой степени чистоты
ЖИДКОСТЬ-ЖИДКОСТНАЯ ЭКСТРАКЦИЯ
Слайд 42ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ
Экстрагент – органический растворитель, содержащий или
не содержащий другие компоненты и экстрагирующий вещество.
Экстракционный реагент – соединение,
ответственное за образование экстрагируемого компонента.Разбавители – инертные органические растворители (CHCl3, CCl4 , C6H6 и др.) , применяемые для улучшения физических и экстракционных свойств экстракционного реагента.
Экстракт – фаза, отделенная от водной фазы и содержащая экстрагированные соединения.
Реэкстракция – перевод вещества из органической фазы в водную
Реэкстрагент –раствор, используемый для реэкстракции.
Экстракционная система – две взаимно нерастворимые жидкости и распределяемый между ними компонент
Слайд 43ПРИ ОПИСАНИИ Э. И ВЫБОРЕ УСЛОВИЙ
НАС БУДУТ ИНТЕРЕСОВАТЬ:
1. Движущая
сила процесса
2. Тип экстрагента, характер его взаимодействия с экстрагируемым
компонентом3. Способ осуществления Э.
4. Количественные характеристики Э.
Слайд 44Условия экстракции вещества
Нейтрализация заряда. Чтобы ион металла и другие
заряженные частицы перешли в органическую фазу, необходимо нейтрализовать заряд. Ионы
металла можно связать в незаряженный комплекс; заряженные частицы можно экстрагировать в виде ионных ассоциатов2. Гидрофобность. Чтобы соединение полностью экстрагировалось, необходимо обеспечить его гидрофобность, т. е. должны, как правило, отсутствовать гидрофильные группы (— SO3H, — OH, — COOH и др.) и внешняя органическая часть соединения должна быть достаточно объемистой и могла блокировать гидрофильную часть молекулы.
3. Размер молекулы. С увеличением размера молекул экстрагирующегося соединения степень извлечения обычно повышается, поскольку крупные молекулы сильнее нарушают структуру воды.
4. Заряд ионов в составе ИА. Экстракция ионных ассоциатов ухудшается с увеличением заряда и уменьшением размера ионов. При прочих равных условиях обычно лучше экстрагируются однозарядные ионы, хуже — двух- и особенно трехзарядные.
5. Устойчивость комплексов. При прочих равных условиях более устойчивые комплексы экстрагируются лучше.
Гидратация ↔ Сольватация
∆Gгидр. ∆Gcольв.)
Чем больше энергия сольватации и меньше энергия гидратации
экстрагирующихся соединений, тем выше степень извлечения
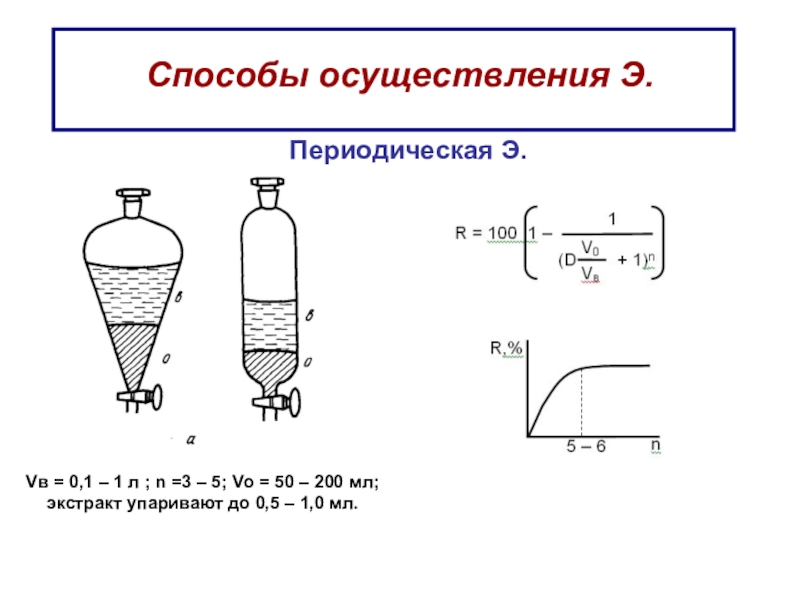
Слайд 45Способы осуществления Э.
Периодическая Э.
Vв = 0,1 – 1 л
; n =3 – 5; Vо = 50 – 200
мл;экстракт упаривают до 0,5 – 1,0 мл.
Слайд 46Способы осуществления жидкость-жидкостной микроэкстракции (ЖЖМЭ)
ЖЖМЭ - экстракция из водного раствора
в небольшое количество несмешиваемого с водой растворителя (от 50 мкл
до 1 мл)Преимущества ЖЖМЭ: экономия растворителей, миниатюризация процесса, экспрессность
Способы осуществления ЖЖМЭ
1. Микроэкстракция методом одной капли
2. Дисперсионная жидкостная микроэкстракция
3. Гомогенная экстракция
4. Мицеллярная экстракция
Слайд 47Э. в одну каплю органического растворителя (Single drop microextraction)
Ее
проводят в микроэкстракторе, который представляет собой пробирку емкостью 1 см3 с
конусным дном и устройством для магнитного перемешивания.В верхнюю часть пробирки вводят фторопластовый стержень с лункой на конце (зонд), в него помещают каплю экстрагента. Зонд погружают в анализируемый раствор, раствор перемешивают в течение 5 мин, при этом капля остается в лунке.
По окончании экстракции экстракт анализируют методом газовой хроматографии.
Слайд 48Дисперсионная жидкостно-жидкостная микро-экстракция (dispersive liquid-liquid мicroextraction, DLLME, 2006 г)
Экстрагент: органический растворитель, плохо или совсем не смешивающийся с водой;
Диспергент (диспергирующий растворитель): органический полярный растворитель, хорошо смешивающийся с водой и способный растворять экстрагент. Способ осуществления Э.: Анализируемый раствор, экстрагент и диспергирующий растворитель смешивают в центрифужной пробирке, встряхивают и центрифугируют образующуюся эмульсию в течение нескольких минут. Затем органическую фазу отбирают микрошприцем, упаривают, растворяют в подходящем растворителе и анализируют методами ВЭЖХ.
Преимущества DLLME: являются простота эксплуатации, эффективность и низкая стоимость.
Слайд 49 Гомогенная экстракция или экстракция гидрофильными растворителями
Экстрагенты – растворители, которые
полностью (этанол, пропанол, изопропанол и ацетон) или частично (бутанол, изобутанол,
пентанол, изопентанол и метилэтилкетон) смешивающиеся с водой, а также водные растворы полиэтиленгликолей и других водорастворимых полимеров.За счет чего происходит расслаивание системы
(образование самостоятельной органической фазы)?
В водную пробу вводят большие количества нейтральных солей – высаливателей и/или снижают температуру водно-органического раствора.
Как выбирают высаливатели?
Высаливатели должны хорошо растворяться в воде и минимально растворяться в органическом растворителе; они должны обладать высокими гидратными числами.
Высаливатели – нитраты, сульфаты, хлориды, карбонаты калия, натрия или аммония
Слайд 50 Гомогенная экстракция или экстракция гидрофильными растворителями
Преимущества гомогенной Э.
Сокращение времени
достижения экстракционного равновесия;
Увеличение степеней извлечения и коэффициентов концентрирования микрокомпонентов;
Отпадает необходимость в реэкстракции; Можно проводить определение выделенных компонентов непосредственно в экстрактах методом атомно-абсорбционной спектроскопии или электрохимическими методами.
Недостатки гомогенной Э.
В экстракте всегда содержится достаточно большое количество воды и солей, используемых в качестве высаливателей
Слайд 51Мицеллярная экстракция или экстракция на основе точки помутнения (cloud point
extraction)
Экстрагенты – структурно-организованные среды на основе мицелл ПАВ
Способ осуществления Э.:
метод основан на фазовом расслаивании гомогенного раствора ПАВ на две фазы:1. фазу, обогащённую ПАВ
( в этой фазе содержатся проэкстрагированные вещества, преимущественно гидрофобные, которые до фазового разделения были распределёны по всему объёму);
2. водную фазу, содержащую ПАВ до ККМ и остаточные количества непроэкстрагированных веществ.
Слайд 52Мицеллярная экстракция
За счет чего происходит расслаивание системы
(образование самостоятельной органической
фазы)?
Мицеллярные системы на основе неионных ПАВ:
фазы образуются при нагревании
раствора выше критической температуры либо при введении в мицеллярную систему небольшого количества органического растворителя (например, хлороформа)Мицеллярные системы на основе цвиттер-ионных ПАВ: фазы образуются при охлаждении раствора.
Мицеллярные системы на основе катионных ПАВ: экстракцию проводят в присутствии больших количеств электролитов (например, 25 мас.% NaCl) и небольшого количества 1-октанола или анионных ПАВ.
Мицеллярные системы на основе анионных ПАВ:
разделение осуществляют за счет введения больших количеств соляной кислоты, концентрация которой в растворе составляет 6 моль/л.
Слайд 53Преимущества мицеллярной Э.
Высокая степень извлечения веществ различной природы;
Большая
емкость органической фазы;
Простота и экспрессность метода;
Отсутствие органических
растворителей; Удобство совмещения концентрирования с последующим определением выделенных соединений хроматографическими методами.
Слайд 545. Экстракция расплавами
Экстрагенты:
1. Расплав орг. реагента (8 – Ох)
2. Расплав
орг. реагента в легкоплавком растворителе
Преимущества:
> CHR, > R, %
выше t0,
> R%Э + РФА
Слайд 56КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ЭКСТРАКЦИИ
Константа распределения (КD)
2. Коэффициент распределения
CA(o) , CA(в) –
общие концентрации вещества А в орган. и водн. фазах
Слайд 57 3. Степень извлечения
где Q(o) и Q(в) – количество
вещества в органической
и водной фазах;с(о) и с(в) – концентрация
вещества в фазах;V(o) и V(в) – объемы фаз.
Если V(в) = V(o), то
R, % , если V(o) при V(в) = const
Слайд 585
4. Степень извлечения после n-кратной экстракции
Пример: Коэффициент распределения фенола в
системе вода – октиловый спирт равен 31. Объем водной фазы,
из которой экстрагируют фенол, равен 100,0 мл. Рассчитайте и сравните степень извлечения фенола при:а) однократной экстракции 5,0 мл октилового спирта;
б)однократной экстракции 25,0 мл октилового спирта; в) 5-кратной экстракции порциями октилового спирта по 5,0 мл.
Решение:
б) R =
в)
а)
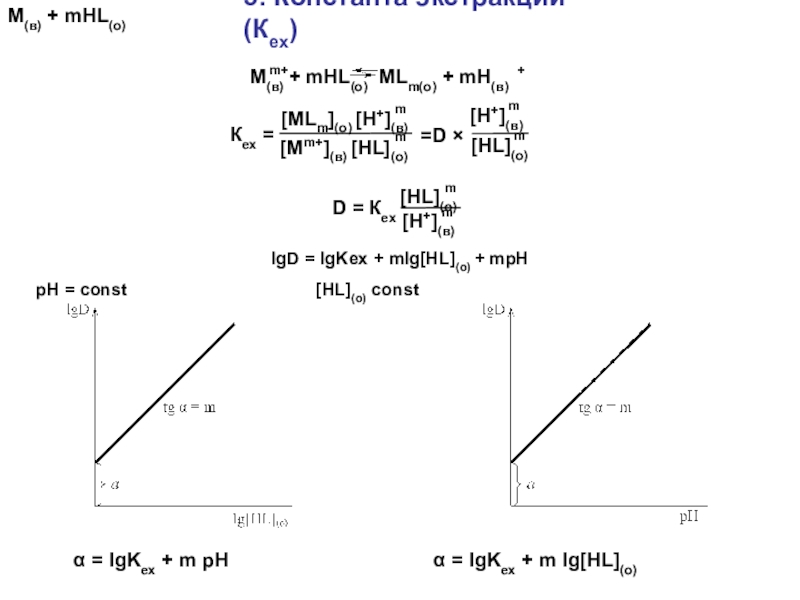
Слайд 595. Константа экстракции (Кex)
М(в) + mHL(о)
α = lgKex +
m pH α = lgKex + m lg[HL](о)
lgD = lgKex
+ mlg[HL](о) + mpHpH = const [HL](о) const
Слайд 61Вопросы
Назовите основные виды концентрирования.
Что такое коэффициент распределения, степень извлечения, коэффициент
разделения?
При каких значениях коэффициентов разделения и коэффициентов распределения достигается количественное
разделение веществ?Дайте определение следующих понятий: экстракция, экстрагент, разбавитель, экстракт.
Дайте определение понятию коэффициент разделения. Укажите условия разделения двух веществ А и В, если объемы фаз равны.
Дайте определение понятию степень извлечения. Каким образом степень извлечения связана с коэффициентом распределения?
Коэффициент распределения 2,6-динитрофенола между водой и октиловым спиртом равен 15. Рассчитайте степень извлечения 2,6-динитрофенола, а также его концентрацию, оставшуюся в водной фазе после экстракции из 100,0 мл 1,0·10-3М раствора 20,0 мл октилового спирта. Как можно повысить степень извлечения?
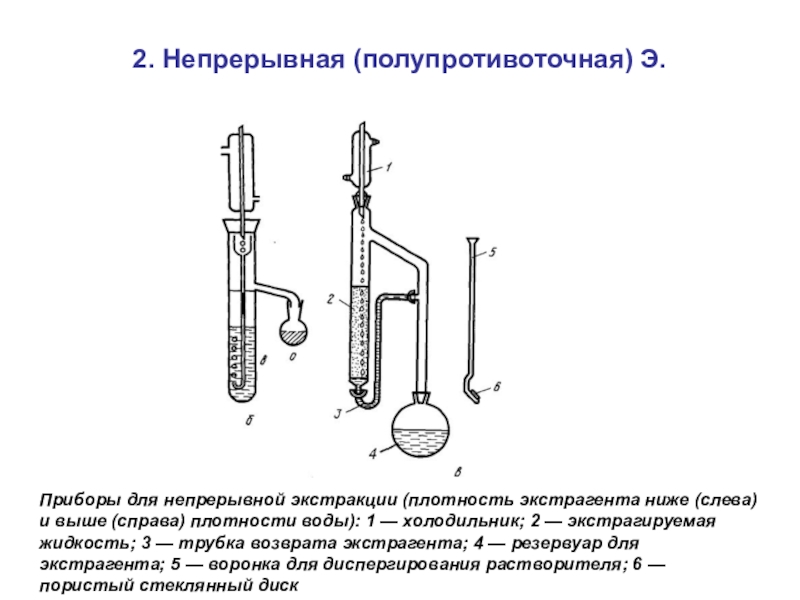
Слайд 622. Непрерывная (полупротивоточная) Э.
Приборы для непрерывной экстракции (плотность экстрагента
ниже (слева) и выше (справа) плотности воды): 1 — холодильник;
2 — экстрагируемая жидкость; 3 — трубка возврата экстрагента; 4 — резервуар для экстрагента; 5 — воронка для диспергирования растворителя; 6 — пористый стеклянный дискСлайд 63Классификация методов разделения и концентрирования по фазовому признаку (наличию и
характеру фазовых переходов)
Можно выделить 4 группы, основанные на:
1.Образовании выделяемым веществом
новой фазы2. Различиях в распределении веществ между фазами
3. Различиях в массопереносе (индуцированный переход вещества из одной фазы в другую, через разделяющую их третью)
4. Механизмах внутрифазового распределения
Слайд 64Классификация методов разделения и концентрирования по фазовому признаку (наличию и
характеру фазовых переходов)
Можно выделить 4 группы, основанные на:
1.Образовании выделяемым веществом
новой фазы2. Различиях в распределении веществ между фазами
3. Различиях в массопереносе (индуцированный переход вещества из одной фазы в другую, через разделяющую их третью)
4. Механизмах внутрифазового распределения