Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Модели атомов Опыт Резерфорда Постулаты Бора
Содержание
- 1. Модели атомов Опыт Резерфорда Постулаты Бора
- 2. Гипотезы о строении веществаГипотеза о том, что
- 3. Развитие представлений о строении атомаКонкретные представления о
- 4. Модель атома ТомсонаОпираясь на открытия сделанные в
- 5. Опыты РезерфордаВ 1911 году Резерфорд экспериментально подвергнул
- 6. Резерфорд показал, что модель Томсона находится в
- 7. Опыты РезерфордаИзвестно, что α-частицы имеют положительный заряд.
- 8. Модель атома РезерфордаРезерфорд показал, что модель Томсона
- 9. Модель атома Резерфорда Поскольку диаметр ядра значительно
- 10. Трудности модели атома Резерфорда
- 11. Постулаты БораДатский физик Нильс Бор (1885--1962).
- 12. I постулат (стационарных состояний) Атомная система
- 13. II постулат (правило частот)Излучение света происходит при
- 14. В чём заключаются противоречия между постулатами Бора
- 15. При каком условии происходит излучение, а при
- 16. Каково значение теории Бора в развитии физической
- 17. Трудности теории Бора
- 18. Трудности теории Бора
- 19. Выберите правильный ответЯдерная модель атома представляет собой:
- 20. 2) С помощью опытов Резерфорд установил, что
- 21. Проверь себя ... Б Б А
- 22. Вопросы (для д/з): Что представляет собой атом,
- 23. Домашнее задание § 93-95 учебник Физика- 11
- 24. Скачать презентанцию
Слайды и текст этой презентации
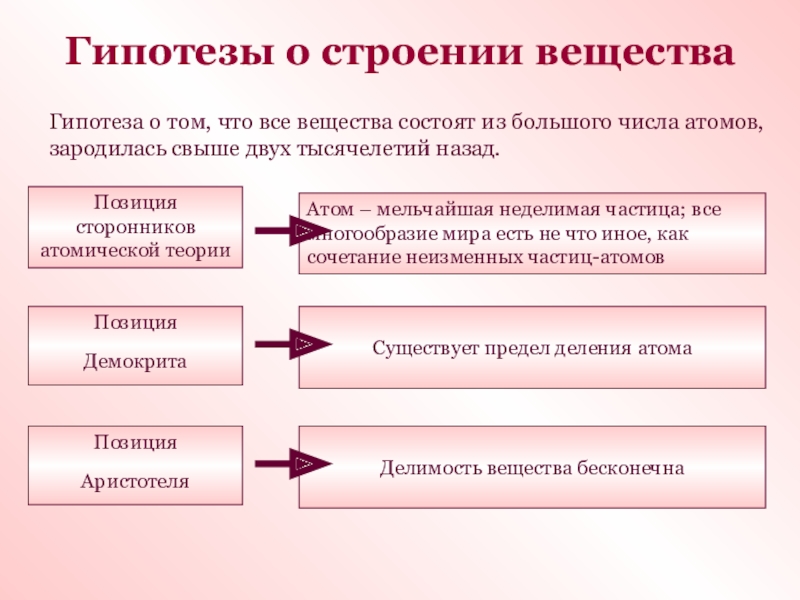
Слайд 2Гипотезы о строении вещества
Гипотеза о том, что все вещества состоят
из большого числа атомов, зародилась свыше двух тысячелетий назад.
Позиция сторонников
атомической теорииАтом – мельчайшая неделимая частица; все многообразие мира есть не что иное, как сочетание неизменных частиц-атомов
Позиция
Демокрита
Существует предел деления атома
Позиция
Аристотеля
Делимость вещества бесконечна
Слайд 3Развитие представлений о строении атома
Конкретные представления о строении атома развивались
по мере накопления физикой фактов о свойствах вещества.
В начале
19 века молекулярно-кинетическая теория установила примерные размеры атомов и небольших молекул: около 10-10 мВ конце 19 века был открыт электрон, а также измерена его масса и заряд
В.Вебер впервые высказывает мысль об электронном строении атома
Х.Лоренц в 1896 году создал электронную теорию: электроны входят в состав атома
в 1896 году А.Беккерель открыл явление радиоактивности
Каково строение атома?
Слайд 4Модель атома Томсона
Опираясь на открытия сделанные в то время, Джозеф
Джон Томсон в 1903 году предложил одну из первых моделей
строения атома в виде положительно заряженного шара радиусом 10-10 м, в котором «плавают» электроны, нейтрализующие положительный заряд, равномерно распределенный по всему объему. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд равен по модулю суммарному отрицательному заряду электронов.Слайд 5Опыты Резерфорда
В 1911 году Резерфорд экспериментально подвергнул проверке модель атома
Томсона.
Пропуская пучок α-частиц (заряд +2е, масса 6,64 · 10-27 кг)
через тонкую золотую фольгу, Эрнест Резерфорд обнаружил, что какая-то часть частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть α-частиц отражается от фольги. Но согласно модели атома Томсона, эти α-частицы при взаимодействии с атомами фольги должны отклоняться на малые углы, порядка 2˚.
Слайд 6Резерфорд показал, что модель Томсона находится в противоречии с его
опытами.
Опыты Резерфорда
Результаты эксперимента настолько удивили Резерфорда, что он воскликнул: «…
неправдоподобно так же, как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, а снаряд отскочил бы обратно и убил бы вас самих».Слайд 7Опыты Резерфорда
Известно, что α-частицы имеют положительный заряд. Если некоторые из
них отталкиваются фольгой назад, значит, положительный заряд есть и в
атомах фольги. Но поскольку большая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь при этом, значит, положительный заряд занимает лишь малую часть каждого атома. Её назвали ядром атома.При столкновениях с отдельными электронами α-частицы испытывают отклонения на очень небольшие углы, так как масса электрона мала. Однако в тех редких случаях, когда она пролетает на близком расстоянии от одного из атомных ядер, под действием сильного электрического поля ядра может произойти отклонение на большой угол.
Слайд 8Модель атома Резерфорда
Резерфорд показал, что модель Томсона находится в противоречии
с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную
(планетарную) модель строения атома:атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (dя ≈ 10-12 – 10-13 см);
в ядре сконцентрирована почти вся масса атома;
отрицательный заряд всех электронов распределён по всему объему атома
Модель атома Резерфорда
Слайд 9Модель атома Резерфорда
Поскольку диаметр ядра значительно меньше диаметра атома,
то быстрые α-частицы могут почти свободно проникать через значительные слои
вещества, содержащие несколько тысяч слоев атомов.Резерфорд ничего не говорит о том, как именно в атоме расположены электроны и движутся ли они. Он и не мог дать ответ на этот вопрос в рамках той физики, которая развивалась до начала ХХ века. Классическая физика просто не допускала существование такого атома. Для этого потребовалось создание новой, квантовой физики. Её основу заложили труды таких выдающихся ученых, как Нильс Бор и Альберт Эйнштейн.
Слайд 12I постулат (стационарных состояний)
Атомная система может находиться только
в особых стационарных или квантовых состояниях, каждому из которых соответствует
определенная энергия En.В стационарных состояниях атом не излучает энергию, при этом электроны в атомах движутся с ускорением.
Слайд 13II постулат (правило частот)
Излучение света происходит при переходе атома из
стационарного состояния с большей энергией Ek в стационарное состояние с
меньшей энергией En.Энергия излучённого фотона равна разности энергий стационарных состояний:
Слайд 14В чём заключаются противоречия между постулатами Бора и законами классической
механики классической электродинамики?
Как следует из постулатов, вопреки классической электродинамике
электроны движутся по замкнутым орбитам и электромагнитные волны при этом не излучают.Слайд 15При каком условии происходит излучение, а при каком условии происходит
поглощение энергии атомом?
При поглощении света, атом переходит из стационарного
состояния с меньшей энергией в стационарное состояние с большей энергией. При излучении атом переходит из стационарного состояния с большей энергией, в стационарное состояние с меньшей энергией.
Слайд 16Каково значение теории Бора в развитии физической науки?
I. Явилась
важным этапом в развитии квантовых представлений о строении атома.
II.
Позволила определить: радиусы орбит
энергию стационарных состояний
частоты излучения
Слайд 19Выберите правильный ответ
Ядерная модель атома представляет собой:
А. Положительно заряженный шар радиусом 10-10 м, в котором «плавают» электроны, нейтрализующие положительный заряд.
Б. Вся масса атома сконцентрирована в ядре, которое имеет положительный заряд. Вокруг ядра подобно планетам вращаются электроны. В. Комбинация центрального положительного атома, равномерно размазанного по сфере, и электронов, которые располагаются по сферическим концентрическим поверхностям.
Слайд 202) С помощью опытов Резерфорд установил, что …
А. Положительный заряд распределен равномерно по всему объему атома. Б. Положительный заряд сосредоточен в центре атома и занимает очень малый объем. В. В состав атома входят электроны. Г. Атом не имеет внутренней структуры.
3) Современная модель структуры атома обоснована опытами:
А. По рассеянию α-частиц Б. По сжимаемости жидкости В. По электризации Г. По тепловому расширению
Слайд 22Вопросы (для д/з):
Что представляет собой атом, согласно модели Томсона?
Как проводился опыт по рассеянию α-частиц?
Какие выводы были сделаны
Резерфордом, когда он обнаружил, что α-частицы отклоняются при взаимодействии с фольгой?Что представляет собой атом, согласно ядерной модели, выдвинутой Резерфордом?
Как проходят α-частицы сквозь атомы вещества согласно ядерной модели?
Почему отрицательно заряженные частицы атома не оказывают заметного влияния на рассеяние α-частиц?
Почему α-частицы не могли бы рассеиваться на большие углы, если бы положительный заряд атома был распределён по всему объёму?