Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Модификация гетероциклических оснований нуклеиновых кислот Реакции по С(6)-С(5)
Содержание
- 1. Модификация гетероциклических оснований нуклеиновых кислот Реакции по С(6)-С(5)
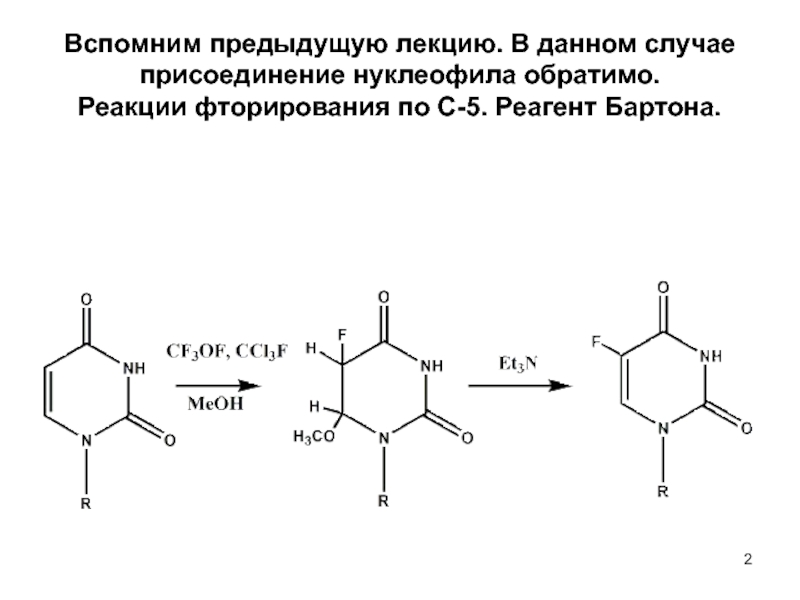
- 2. Вспомним предыдущую лекцию. В данном случае присоединение нуклеофила обратимо. Реакции фторирования по С-5. Реагент Бартона.
- 3. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С НУКЛЕОФИЛЬНЫМИ ГРУППАМИ БЕЛКОВВспомним
- 4. Слайд 4
- 5. Отличительные особенности фторпроизводных уридинаПрисоединение нуклеофильной сульфгидрильной группы
- 6. Слайд 6
- 7. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С ГИДРАЗИНОМ (вспоминаем метод
- 8. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ C ГИДРАЗИНОМ (цитозин)
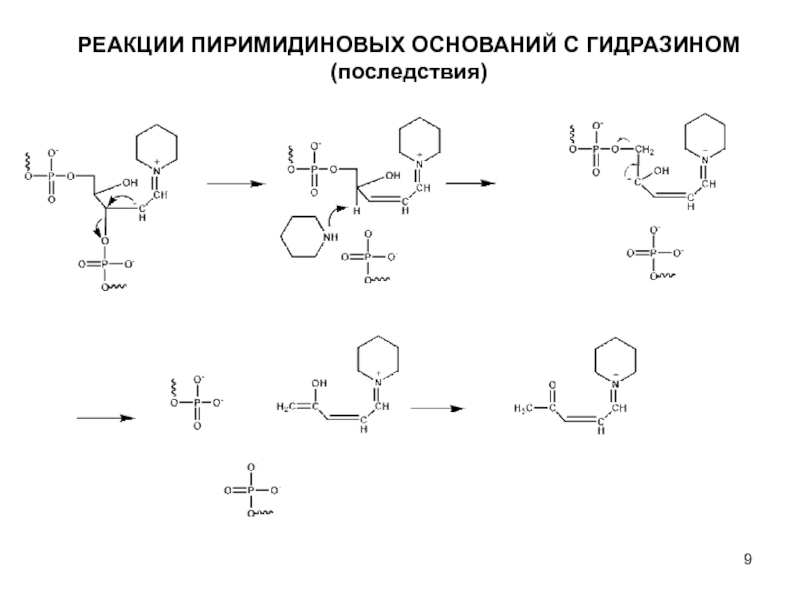
- 9. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ C ГИДРАЗИНОМ (последствия)
- 10. Слайд 10
- 11. Рисунок электрофореграммы, полученной для олигонуклеотида d(AAGAAGGCCTCTGGAAGC)
- 12. ИДЕНТИФИКАЦИЯ МОДИФИЦИРОВАННЫХ (АЛКИЛИРОВАНЫХ) ОСТАТКОВ ЦИТОЗИНАРеакция с OsO4,
- 13. Слайд 13
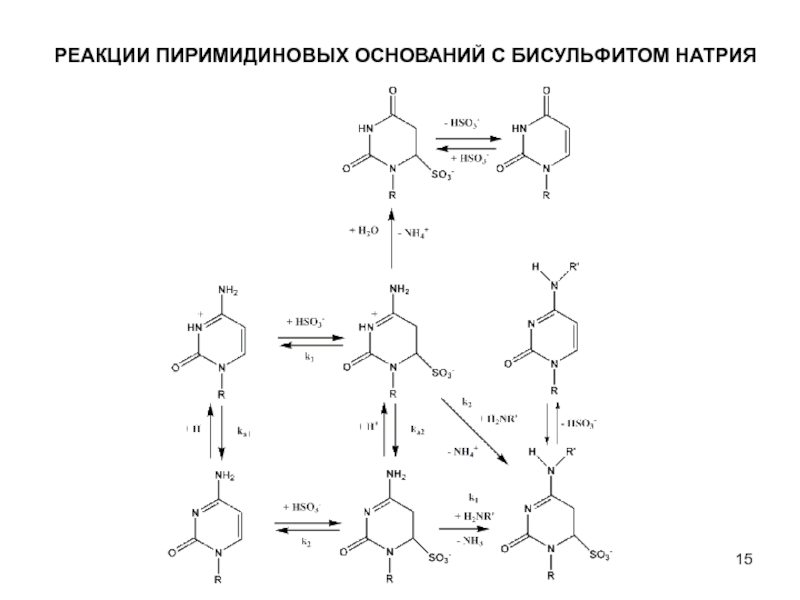
- 14. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯБисульфит-ион способен
- 15. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ
- 16. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯВажным свойством
- 17. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯМодификация нуклеиновых
- 18. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯРеакция бисульфита
- 19. РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ (способ
- 20. Реакции по С-4 положению пиримидинов
- 21. МЕРКУРИРОВАНИЕШироко распространенная в органической химии реакция непредельных
- 22. МЕРКУРИРОВАНИЕ
- 23. Слайд 23
- 24. Возможность введения функциональных групп по разным положениям на уровне оигонуклеотида
- 25. «ПОДВОДНЫЕ КАМНИ» При работе с аллиламином и
- 26. Слайд 26
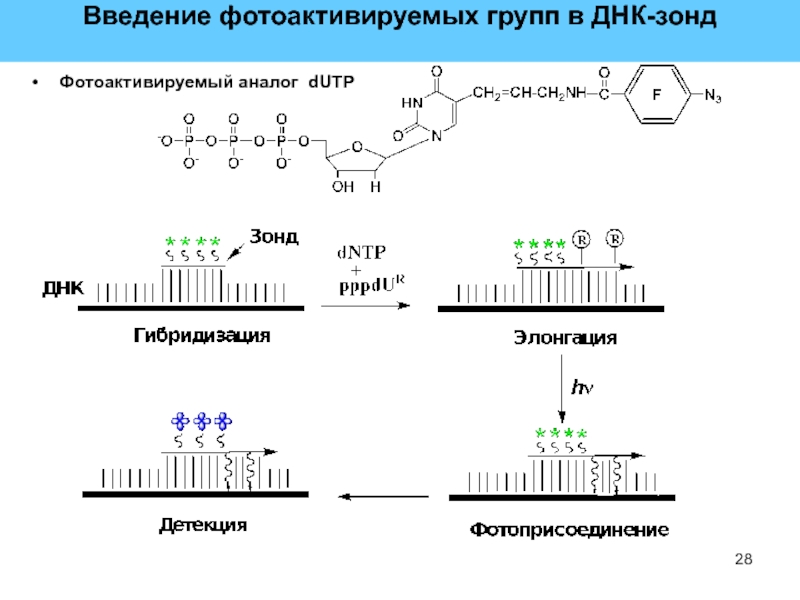
- 27. ПРИМЕРЫ ИСПОЛЬЗОВАНИЯВведение фотоактивируемых и репортерных групп в нуклеиновые кислоты
- 28. Введение фотоактивируемых групп в ДНК-зонд Фотоактивируемый аналог dUTP
- 29. Двухступенчатая гибридизация in situ (д.ф.-мат.н. А.И. Полетаев)
- 30. Мечение нуклеиновых кислот Поиски эффективных нерадиоактивных маркеров, пригодных
- 31. Слайд 31
- 32. Производные нуклеиновых кислот, снабженные дигогсигениновой меткойИспользование в
- 33. Что нужно знать после лекцииРеакции присоединения и
- 34. Скачать презентанцию
Вспомним предыдущую лекцию. В данном случае присоединение нуклеофила обратимо. Реакции фторирования по С-5. Реагент Бартона.
Слайды и текст этой презентации
Слайд 1Модификация гетероциклических оснований нуклеиновых кислот
Реакции по С(6)-С(5) связи
ВЗАИМОДЕЙСТВИЕ С
НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ И НУКЛЕОФИЛЬНЫМИ ГРУППАМИ БЕЛКОВ
Слайд 2Вспомним предыдущую лекцию. В данном случае присоединение нуклеофила обратимо. Реакции фторирования
по С-5. Реагент Бартона.
Слайд 3РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С НУКЛЕОФИЛЬНЫМИ ГРУППАМИ БЕЛКОВ
Вспомним биохимию. Как происходит
превращение уридина в тимидин? Отличие в СН3-группе. Переносчик одноуглеродных фрагментов
– фолиевая кислота. Источник – серин, который после реакции превращается в глицин.На пути превращения сталкиваемся с присоединением нуклеофильной группы белка по 6-положению гетероцикла
Слайд 5Отличительные особенности фторпроизводных уридина
Присоединение нуклеофильной сульфгидрильной группы тимидилатсинтазы также обратимо.
А что будет, если вместо дезоксиуридин-5’-монофосфата в реакционной смеси будет
5-фтордезоксиуридин-5’-монофосфат?Слайд 7РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С ГИДРАЗИНОМ (вспоминаем метод Максама-Гилберта)
Для определения
положения тимидина используется деградация по остаткам пиримидинов, для чего ДНК
последовательно обрабатывается гидразином, а затем пиперидином.Расщепление по цитозину осуществляется при высокой концентрации NaCl с последующей обработкой продуктов модификации пипердином. ПОЧЕМУ?
В щелочных условиях реакции с гидразином приводят к расщеплению гетероциклических колец пиримидинов, практически не затрагивая пуриновых оснований.
Слайд 12ИДЕНТИФИКАЦИЯ МОДИФИЦИРОВАННЫХ (АЛКИЛИРОВАНЫХ) ОСТАТКОВ ЦИТОЗИНА
Реакция с OsO4, широко применяемая в
органической химии для гидроксилирования двойных связей, гладко протекает и в
случае пиримидиновых оснований. Скорость реакции возрастает в ряду ТUC, так, тимидин реагирует почти на два порядка быстрее цитидина и в 10 раз быстрее уридина. Поэтому ее можно рассматривать как специфический метод модификации тимидина. При взаимодействии с OsO4 образуется циклический эфир осмиевой кислоты, который легко гидролизуется до диола. Диольные соединения также образуются и при взаимодействии с MnO4 и H2O2. Однако в этом случае быстро происходит разрушение цикла.Слайд 14РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ
Бисульфит-ион способен обратимо присоединяться к
С5-С6-двойным связям цитозина, урацила и тимина в мягких условиях, образуя
соответствующий аддукт, неустойчивый в случае тимина; практическое значение имеют только реакции с урацилом и цитозином. Продукты присоединения к урацилу и цитозину довольно стабильны в нейтральной кислой средах, но отщепляют бисульфит-ион в щелочной среде.Слайд 16РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ
Важным свойством 5,6-дигидропроизводных цитозина является
повышенная реакционноспособность аминогруппы, которая легко замещается под действием различных нуклеофильных
агентов. Замещение аминогруппы на гидроксигруппу приводит к производному урацила, которое легко превращается в урацил при слабоосновных значениях рН. Таким образом, эта реакция дает возможность специфического преобразования цитозиновых колец в урацильные.Слайд 17РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ
Модификация нуклеиновых кислот бисульфитом часто
используется как способ введения мутационных замен. С этой целью участок
ДНК, выбранный для введения мутаций, превращают в одноцепочечный и затем обрабатывают бисульфитом в условия дезаминирования. Таким образом, например, пары G-C могут быть заменены на пары А-Т (такие замены называются транзициями).Слайд 18РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ
Реакция бисульфита с одноцепочечными нуклеиновыми
кислотами протекает значительно медленнее, чем с мономерами. И практически не
идет с двухцепочечными молекулами.Специфичность к вторичной структуре используется для анализа пространственного строения полинуклеотида. Так, обработка тРНК бисульфитом приводит к модификации только цитозиновых оснований, которые находятся в петлях.
Предварительная модификация цитозиновых гетероциклов бисульфитом обеспечивает возможность введения по С-4 различных группировок, напрмер остатка биотина или флуоресцеина.
Слайд 19РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С БИСУЛЬФИТОМ НАТРИЯ (способ введения различных группировок
по С4-положению цитозина)
Однако надо помнить, что выход производных цитозина уменьшается
с увеличением рКа аминомостика. ПОЧЕМУ? J. Molander et al. Bioconjugate Chem. 1994
Слайд 21МЕРКУРИРОВАНИЕ
Широко распространенная в органической химии реакция непредельных соединений с ацетатом
ртути в случае нуклеиновых кислот проходит в мягких условиях (вода,
рН 6.0-7.0, 40-50 0С). Результатом реакции является образование производных 5-ацетоксимеркуриоурацила и 5-ацетоксимеркуриоцитозина. 5-Меркуриопроизводные вследствие легкого обмена атома ртути на атомы галогена или трития используются для получения специфически меченных пиримидиновых оснований нуклеиновых кислот.Слайд 25«ПОДВОДНЫЕ КАМНИ»
При работе с аллиламином и его производными могут
протекать «незапланированные» реакции по С-4 положению гетероцикла.
Слайд 30Мечение нуклеиновых кислот
Поиски эффективных нерадиоактивных маркеров, пригодных для мечения зондов, привели
к созданию как минимум двух альтернативных меток: биотин-dNTP (bio-dNTP, фирмы
Sigma и Gibco-BRL) и дигоксигенин-dUTP (dig-dUTP, фирма Boehringer Mannheim).Слайд 32Производные нуклеиновых кислот, снабженные дигогсигениновой меткой
Использование в качестве метки дигоксигенина, обеспечивает
большую специфичность и воспроизводимость, а чувствительность метода близка к таковой
для случая радиоактивно меченных зондов. Дигоксигенин присутствует только в растении дигиталис (наперстянка), что уменьшает неспецифичное окрашивание, обусловленное взаимодействием с эндогенными соединениями.Слайд 33Что нужно знать после лекции
Реакции присоединения и замещения по атомам
углерода. Реакция присоединения-отщепления по двойной связи С5-С6 пиримидинов: меркурирование в
водной среде; взаимодействие с бисульфитом натрия. Окисление четырехокисью осмия. Действие гидразина и его производных. Реакции переаминирования как способ введения реакционноспособных групп и меток по С4-положению цитидина.Реакции расщепления и перегруппировки гетероциклических оснований нуклеиновых кислот и их производных. Раскрытие пиримидинового цикла. Расщепление ДНК по остаткам цитозина гидразином при высокой концентрации NaCl. Деградация ДНК по остаткам пиримидинов после обработке гидразином в отсутствие NaCl.
Способы введения фотоактивируемых и репортерных групп по С5-положению пиримидинов.
Взаимопревращения природных нуклеозидов. Получение уридина методом дезаминирования цитидина. Аминирование как способ превращения уридина в цитидин, тимидина в 5-метил-2`-дезоксицитидин.