Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ІНДЗ на тему: Цинк (Zn)
Содержание
- 1. ІНДЗ на тему: Цинк (Zn)
- 2. Цинк (Zn) Зовнішній вигляд простої речовини- в'язкий, блакитно-сірий метал
- 3. Властивості атомаАтомна маса(молярна маса)-65,39 а.о.м. (г/моль)Радіус атома-138 пмЕнергія іонізації (перший електрон)-905,8(9,39) кДж/моль (еВ)Електронна конфігурація-[Ar] 3d10 4s2
- 4. Слайд 4
- 5. Хімічні властивостіКовалентний радіус-125 пмРадіус іона-(+2e) 74 пмЕлектронегативність(за Полінгом)-1,65Електродний потенціалСтупені окиснення-2
- 6. Термодинамічні властивостіГустина -7,133 г/см³Питома теплоємність-0,388 Дж/(K моль)Теплопровідність-116 Вт/(м
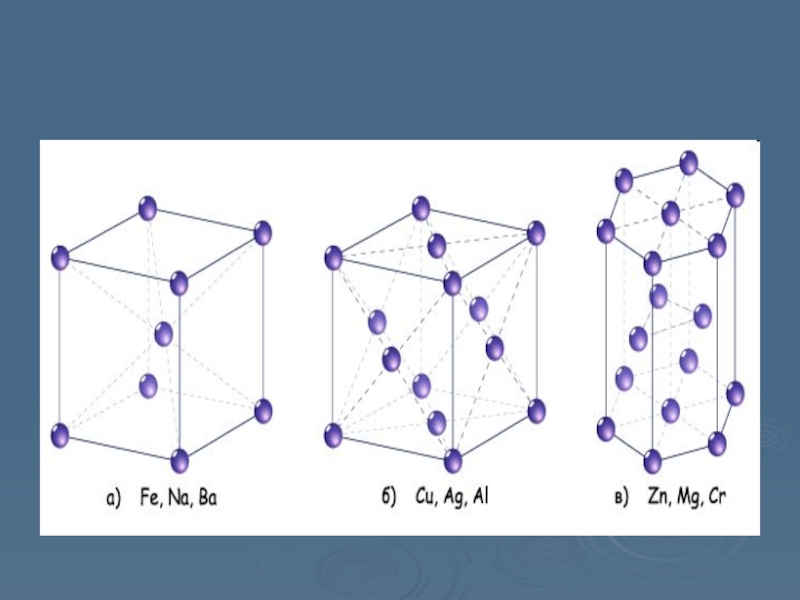
- 7. Кристалічна ґраткаСтруктура ґратки -гексагональнаПеріод ґратки-2,660 ÅВідношення c/a-n/aТемпература Дебая-234 K
- 8. Слайд 8
- 9. Ізотопи Zn В природі зустрічається п'ять ізотопів
- 10. Зареєстровано багато радіоактивних ізотопів. 65Zn з періодом
- 11. Утворення цинку
- 12. Отримання цинкуУ світі щорічно виробляється 10 мільйонів
- 13. Основний спосіб отримання цинку — електролітичний (гідрометалургійний).
- 14. ЗастосуванняЦинк використовують як антикорозійний матеріал, ним покривають
- 15. Слайд 15
- 16. Біологічна рольЦинк впливає на активність тропних гормонів
- 17. Слайд 17
- 18. Негативний впливНадлишок цинку в організмі може призвести до загальної інтоксикації та мутацій ДНК.
- 19. ЛітератураГлосарій термінів з хімії // Й.Опейда, О.Швайка.
- 20. Слайд 20
- 21. Скачать презентанцию
Цинк (Zn) Зовнішній вигляд простої речовини- в'язкий, блакитно-сірий метал
Слайды и текст этой презентации
Слайд 3Властивості атома
Атомна маса(молярна маса)-65,39 а.о.м. (г/моль)
Радіус атома-138 пм
Енергія іонізації (перший
електрон)-905,8(9,39) кДж/моль (еВ)
Слайд 5Хімічні властивості
Ковалентний радіус-125 пм
Радіус іона-(+2e) 74 пм
Електронегативність(за Полінгом)-1,65
Електродний потенціал
Ступені окиснення-2
Слайд 6Термодинамічні властивості
Густина -7,133 г/см³
Питома теплоємність-0,388 Дж/(K моль)
Теплопровідність-116 Вт/(м К)
Температура плавлення-692,73 K
Теплота
плавлення-7,28 кДж/моль
Температура кипіння-1180 K
Теплота випаровування-114,8 кДж/моль
Молярний об'єм-
9,2 см³/моль
Слайд 7Кристалічна ґратка
Структура ґратки -гексагональна
Період ґратки-2,660 Å
Відношення c/a-n/a
Температура Дебая-234 K
Слайд 9Ізотопи Zn В природі зустрічається п'ять ізотопів цинку, серед яких найчастіше
зустрічається 64Zn (48,63 % від загального числа)[1]. Період напіврозпаду 4,3·1018
років цього ізотопу настільки великий, що його радіоактивністю можна знехтувати[2]. Аналогічно, зазвичай не вважається радіоактивним 70Zn (0,6 %) з періодом напіврозпаду 1,3·1016 років. У природі зустрічаються також 66Zn (28 %), 67Zn (4 %) та 68Zn (19 %).Слайд 10Зареєстровано багато радіоактивних ізотопів. 65Zn з періодом напіврозпаду 243,66 днів
живе найдовше з них. За ним йде 72Zn з періодом
напіврозпаду 46,5 годин[1]. Існує 10 ядерних ізомерів цинку. Серед них найбільший період напіврозпаду має 69mZn — 13,76 годин[1]. Верхній індекс m позначає, що цей ізотоп метастабільний. Ядро метастабільного ізотопу перебуває у збудженому стані, з якого повертається в основний стан, випромінюючи фотон, гамма-квант. Ізотоп 61Zn має три збуджених стани, а ізотоп 73Zn — два[3]. Ізотопи 65Zn, 71Zn, 77Zn та 78Zn мають один збуджений стан[1]Зазвичай радіоізотопи цинку з масовим числом, меншим ніж 66 розпадаються із захопленням електрона. Продуктом розпаду в такому випадку є один із ізотопів міді[1]
nZn + e− → nCu
Для ізотопів із масовим числом, більшим ніж 66, звичним каналом розпаду є бета-розпад (β-), при якому утворюються ізотопи галію[1]
nZn → nGa + e− + νe.
Слайд 11Утворення цинку
Цинк надто важкий, щоб утворюватися всередині зірок,
тому основним механізмом його нуклеосинтезу є R-процес, що відбувається при вибуху наднових.Слайд 12Отримання цинку
У світі щорічно виробляється 10 мільйонів тон цинку. Це
четвертий за об'ємом використання метал після заліза, алюмінію та міді.
Здебільшого сировиною служать сірчані руди, в яких сфалерит змішаний із сульфідами інших металів.Цинк у природі як самородний метал не зустрічається. Його добувають з поліметалічних руд, що містять 1-4 % Zn у вигляді сульфіду, а також Cu, Pb, Ag, Au, Cd, Bi. Руди збагачують селективню флотацією, отримуючи цинкові концентрати (50-60 % Zn) і одночасно свинцеві, мідні, а іноді також піритні концентрати. Цинкові концентрати обпалюють в печах в киплячому шарі, переводячи сульфід цинку в оксид ZnO; при цьому утворюється сірчистий газ SO2, що витрачається на виробництво сірчаної кислоти. Від ZnO до Zn йдуть двома шляхами. За пірометалургійним (дистиляційним) способом, який існує здавна, обпалений концентрат піддають спіканню для збільшення зернистості і газопроникності, а потім відновлюють вугіллям або коксом при 1200–1300 °С: ZnO + С = Zn + CO. Утворену при цьому пару металу конденсують і розливають у форми. Спочатку відновлення проводили тільки в ретортах з обпаленої глини, що обслуговуються вручну, пізніше стали застосовувати вертикальні механізовані реторти з карборунду, потім — шахтні і дугові електропечі; з свинцево-цинкових концентратів цинк одержують в шахтних печах з дуттям. Продуктивність поступово підвищувалася, але цинк містив до 3 % домішок, в тому числі і цінний кадмій. Дистилляційно цинк очищають ліквацією (тобто відстоюванням рідкого металу від заліза і частини свинцю при 500 °C), досягаючи чистоти 98,7 %. Застосовують іноді більш складне і дороге очищення — ректифікацію, вона дає метал чистотою 99,995 % і дозволяє витягати з цинку кадмій.
Слайд 13Основний спосіб отримання цинку — електролітичний (гідрометалургійний). Обпалені концентрати обробляють
сірчаною кислотою; отриманий сульфатний розчин очищають від домішок осадженням їх
цинковим пилом і піддають електролізу у ваннах, щільно викладених всередині свинцем або вініпластом. Цинк осідає на алюмінієвих катодах, з яких його щодоби видаляють (здирають) і плавлять в індукційних печах. Зазвичай чистота електролітного цинку 99,95 %, повнота вилучення його з концентрату (з урахуванням переробки відходів) 93-94 %. З відходів виробництва отримують цинковий купорос, Pb, Cu. Cd, Au, Ag, іноді також In, Ga, Ge, TСлайд 14Застосування
Цинк використовують як антикорозійний матеріал, ним покривають вироби зі сталі
та заліза (цинкування), а також як конструкціонний матеріал для цинкографії
анодів, використаних в електролізерах і в гальванічних елементах.Використовується також в латуні як сплав цинку з міддю.
Слайд 16Біологічна роль
Цинк впливає на активність тропних гормонів гіпофізу, бере участь
в реалізації біологічних функцій інсуліну, нормалізуючи жировий обмін. Цинк бере
участь у кровотворенні, а також необхідний для нормального функціонування гіпофіза, підшлункової залози, сім'яних міхурів. Сполуки цинку використовують в медицині в якості лікарських засобів.Слайд 18Негативний вплив
Надлишок цинку в організмі може призвести до загальної інтоксикації
та мутацій ДНК.
Слайд 19Література
Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії
та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний
університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0Гірничий енциклопедичний словник: в 3 т. / За ред. В. С. Білецького. — Донецьк: Східний видавничий дім, 2001—2004. ISBN 966-7804-19-4


![ІНДЗ на тему: Цинк (Zn) Властивості атомаАтомна маса(молярна маса)-65,39 а.о.м. (г/моль)Радіус атома-138 пмЕнергія іонізації (перший електрон)-905,8(9,39) кДж/моль (еВ)Електронна конфігурація-[Ar] 3d10 4s2 Властивості атомаАтомна маса(молярна маса)-65,39 а.о.м. (г/моль)Радіус атома-138 пмЕнергія іонізації (перший електрон)-905,8(9,39) кДж/моль (еВ)Електронна конфігурація-[Ar] 3d10 4s2](/img/thumbs/6b40dc88bf7a1b6fa232b90fc071d122-800x.jpg)