CuCl2
2Cu + S = Cu2S.
Cu + 2H2SO4 (конц.) = CuSO4
+ SO2 + 2H2OCu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
2Cu + O2 + CO2 + H2O = (CuOH)2CO3.


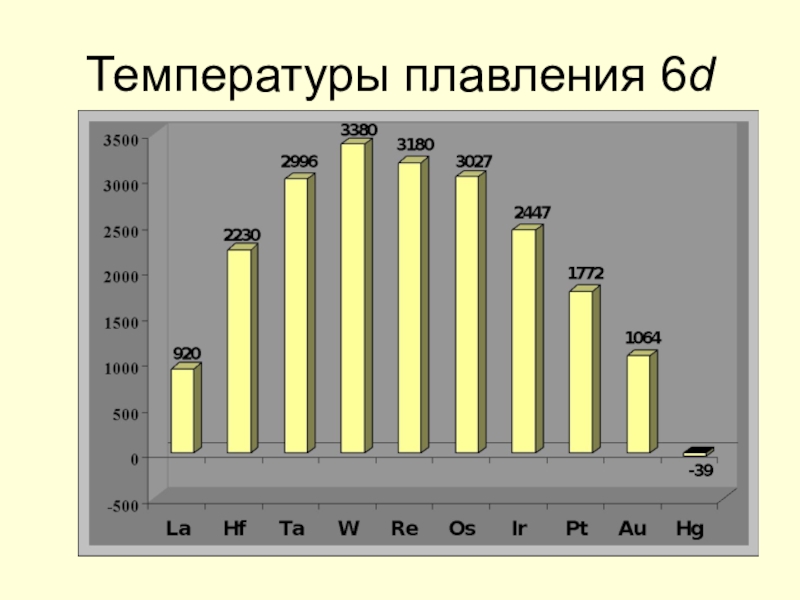
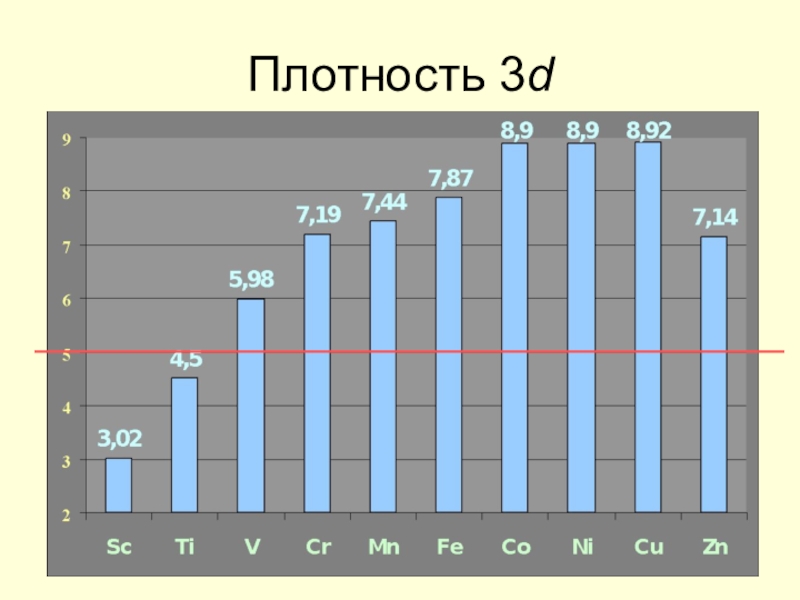
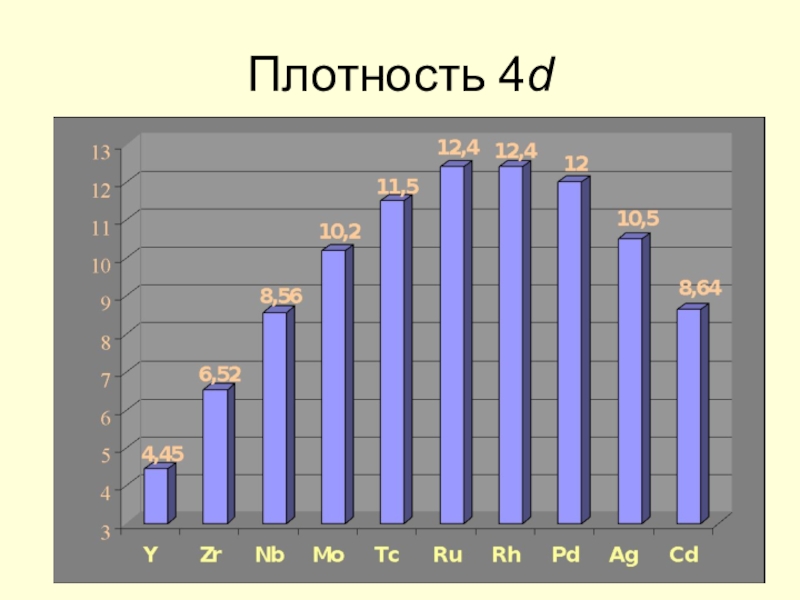
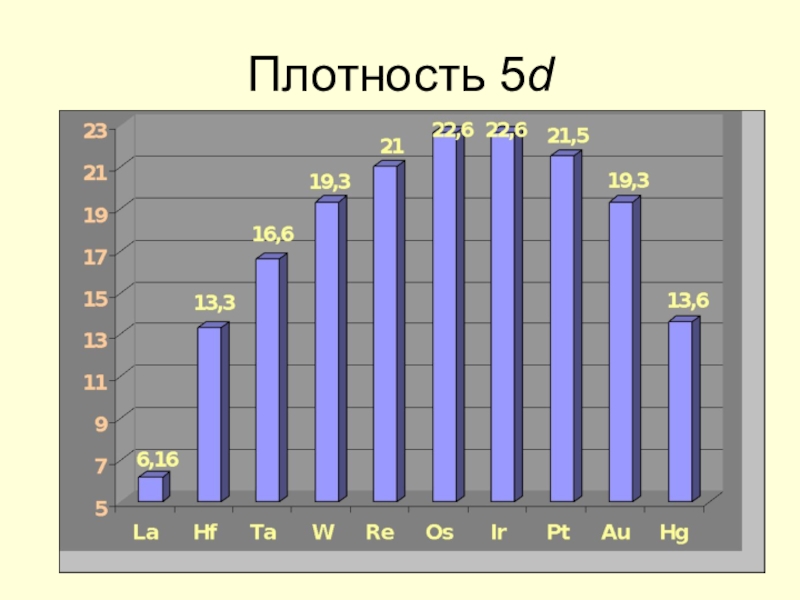






![Некоторые d -элементы Соединения медиCu(OH)2 + 2H+ = Cu2+ + 2H2O Cu(OH)2 + 2OH– Соединения медиCu(OH)2 + 2H+ = Cu2+ + 2H2O Cu(OH)2 + 2OH– = [Cu(OH)4]2– Сульфат меди(II) пятиводный CuSO4](/img/tmb/7/602982/8acc08b2a4a874333139fcc8c1982701-800x.jpg)

























