Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
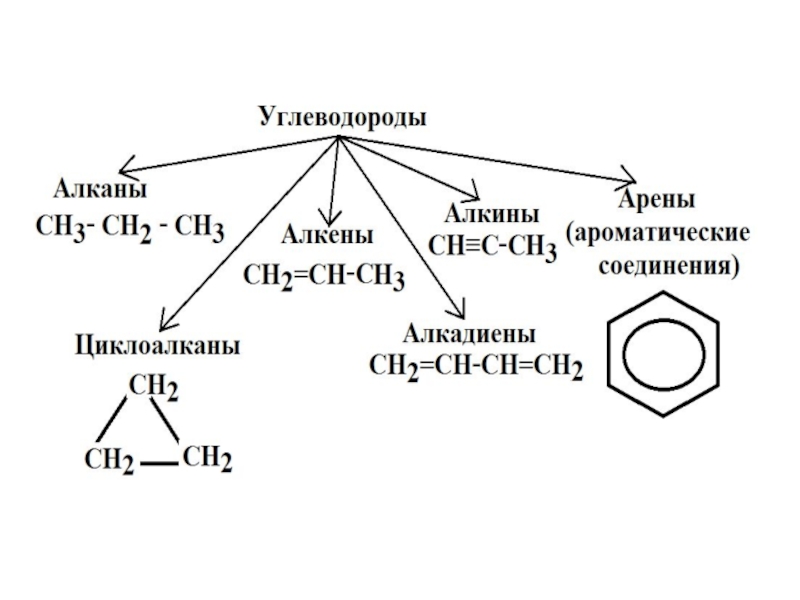
НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ, АЛКАДИЕНЫ, АЛКИНЫ)
Содержание
- 1. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ, АЛКАДИЕНЫ, АЛКИНЫ)
- 2. Ненасыщенные (непредельные) углеводороды (алкены) Ненасыщенными, или непредельными,
- 3. Согласно теории химического строения в ненасыщенных углеводородах
- 4. Все другие органические соединения, в молекулах которых
- 5. Ненасыщенные углеводороды ряда этилена (олефины, алкены) Углеводородами
- 6. Гомология, изомерия и номенклатураЭтиленовые углеводороды образуют гомологический
- 7. Оба углерода и все водородные атомы в
- 8. Замещая в этилене каждый из водородных атомов
- 9. Однако этиленовые углеводороды имеют больше изомеров, чем
- 10. усложнение изомерии непредельных углеводородов обусловлено тем, что
- 11. Цис –транс изомерия В ряду этиленовых углеводородов
- 12. В молекулах с двойной связью между вторым
- 13. Слайд 13
- 14. Слайд 14
- 15. Двойная связь препятствует вращению соединенных ею атомов
- 16. Изомерия, которая основана на различном пространственном расположении
- 17. Номенклатура Названия отдельных гомологов этиленовых углеводородов производят
- 18. Физические свойстваУглеводороды ряда этилен – бесцветные тела.
- 19. Химические свойства В отличие от насыщенных углеводородов
- 20. Электроны второй пары находятся в особом состоянии
- 21. Присоединение водорода (реакция гидрирования) При действии на
- 22. В результате гидрирования образуются предельные углеводороды. Гидрирование
- 23. Присоединение галогенов (галогенирование) При действии на этиленовые
- 24. Присоединение галогеноводородов (гидрогалогенирование)При действии на этиленовые углеводороды
- 25. Присоединение воды (реакция гидратации) В обычных условиях
- 26. Способы получения алкенов В природе этиленовые углеводороды
- 27. Диеновые углеводороды (алкадиены) Диеновыми углеводородами или алкадиенами,
- 28. Химические свойства диенов с кумулированными и с
- 29. Слайд 29
- 30. Скачать презентанцию
Ненасыщенные (непредельные) углеводороды (алкены) Ненасыщенными, или непредельными, углеводородами называют такие углеводороды, элементарный состав которых характеризуется меньшим содержанием водорода по сравнению с соответствующими по числу углеродных атомов предельными углеводородами.
Слайды и текст этой презентации
Слайд 2Ненасыщенные (непредельные) углеводороды (алкены)
Ненасыщенными, или непредельными, углеводородами называют такие
Слайд 3Согласно теории химического строения в ненасыщенных углеводородах углерод также имеет
валентность равную четырем, но строение этих соединений отличается тем, что
в их молекулах имеются пары углеродных атомов, соединенные так называемыми кратными – двойными или тройными – связями. Благодаря наличию кратных связей атомы углерода в непредельных углеводородах не до предела насыщены водородом; отсюда и возникло название - непредельные или ненасыщенные.Слайд 4Все другие органические соединения, в молекулах которых имеются кратные связи
между углеродными атомами, являются производными ненасыщенных углеводородов; их также называют
непредельными органическими веществами.В противоположность насыщенным, ненасыщенные углеводороды проявляют высокую активность в химических реакциях и особенно склонны к реакциям присоединения.
Слайд 5Ненасыщенные углеводороды ряда этилена (олефины, алкены)
Углеводородами ряда этилена, или
этиленовыми углеводородами (олефинами) называют ненасыщенные углеводороды, строение которых отличается наличием
в их молекулах одной двойной связи между углеродными атомами, т.е. – группировки >C=C<.Слайд 6Гомология, изомерия и номенклатура
Этиленовые углеводороды образуют гомологический ряд, состав каждого
члена которого выражается общей эмпирической формулой CnH2n. Родоначальником этого ряда
является углеводород этилен состава С2Н4,Слайд 7Оба углерода и все водородные атомы в этилене равноценны. Поэтому
этилену соответствует один одновалентный радикал СН2=СН—, называемый винилом.
Слайд 8Замещая в этилене каждый из водородных атомов на радикал метил,
мы можем вывести следующий гомолог этого ряда – пропилен состава
С3Н6, имеющий строение СН2=СН—СН3. (Его радикал СН2=СН—СН2— , называют аллил). Точно также, в результате замещения на метил водородных атомов пропилена можно вывести формулу следующего непредельного углеводорода С4Н8. Как и в предыдущем ряду, у непредельных углеводородов, начиная с гомологов, содержащих четыре углеродных атома, проявляется изомерия.Слайд 9Однако этиленовые углеводороды имеют больше изомеров, чем предельные с тем
же числом углеродных атомов. Так, мы видели, что существует только
два изомерных предельных углеводорода состава С4Н10. Непредельных же углеводородов состава С4Н8 существует три. Строение их может быть выведено исходя их пропилена путем последовательной замены в его молекуле атомов водорода при различных углеродных атомах на метил.Слайд 10усложнение изомерии непредельных углеводородов обусловлено тем, что наряду с изомерией
углеродной цепи для них характерна изомерия положения двойной связи. Для
высших гомологов этиленовых углеводородов различие в числе изомеров по сравнению с предельными углеводородами с тем же числом углеродных атомов еще больше.Слайд 11Цис –транс изомерия
В ряду этиленовых углеводородов встречается еще один вид
изомерии, который связан с различием в пространственном строении некоторых молекул,
имеющих двойную связь.Слайд 12В молекулах с двойной связью между вторым и третьим углеродными
атомами обе метильные группы могут располагаться в пространстве двояким способом:
по одну сторону плоскости двойной связи и по обе стороны от нее.Слайд 15Двойная связь препятствует вращению соединенных ею атомов вокруг линии связи.
Поэтому строение молекул изомеров в пространстве зафиксировано
расстояние между метильными группами
в каждой из них различно, и, следовательно, размеры этих молекул неодинаковы. Такое различие в пространственном строении приводит к различию в свойствах
Слайд 16Изомерия, которая основана на различном пространственном расположении атомов или групп
атомов, соединенных двойной связью, называется цис–транс изомерией, а соответствующие изомеры
- цис–транс изомерами.Те из них, в которых различные группы атомов расположены по одну сторону плоскости двойной связи, называются цис-изомерами, а те, в которых группы атомов направлены в разные стороны, - транс-изомерами.
Слайд 17Номенклатура
Названия отдельных гомологов этиленовых углеводородов производят от названий предельных углеводородов
с тем же числом углеродных атомов путем замены родового окончания
– ан на окончание – илен. Например, этан – этилен, пропан – пропилен, изобутан – изобутилен, и т.д. Только углеводороды С5Н10, как исключение, называют амиленами.Слайд 18Физические свойства
Углеводороды ряда этилен – бесцветные тела. Температуры кипения и
температуры плавления гомологов этилена нормального строения возрастают по мере увеличения
в их составе числа углеродных атомов. Первые три члена ряда (С2-С4)- газы, начиная с амиленов и кончая углеводородами С16Н32 – жидкости, высшие этиленовые углеводороды – твердые тела.Слайд 19Химические свойства
В отличие от насыщенных углеводородов для углеводородов ряда
этилена характерны разнообразные реакции присоединения по месту двойной связи; при
этом они значительно легче вступают во взаимодействие с различными реагентами.Все специфические особенности этиленовых углеводородов определяются характером двойной связи. Казалось бы, что двойная связь должна быть прочнее простой; на самом же деле она легко разрывается и превращается в простую (чем и обусловлены реакции присоединения). При определенных условиях молекулы непредельных соединений распадаются с разрывом углеродной цепи именно по месту двойной связи.
Слайд 20Электроны второй пары находятся в особом состоянии (-связь). Эта пара
электронов весьма лабильна и осуществляемая ею связь в значительно большей
мере, чем простая связь, подвергается поляризации.Поэтому именно атомы, соединенные двойной связью, наиболее реакционноспособны и проявляют ненасыщенность, т.е. присоединяют к себе атомы или атомные группы реагента.