Слайд 1Обессоливание воды
Ионный обмен
Слайд 2Жесткость воды
Наличие в воде растворенных солей кальция и магния придает
ей свойство, называемое жесткостью воды. Растворенные соли распадаются на ионы.
Суммарная концентрация катионов кальция (Ca2+) и магния(Mg2+) определяет общую жесткость воды.
Общая жесткость подразделяется на карбонатную (временную) и некарбонатную (постоянную). Причем карбонатная жесткость составляет до 70–80% от общей жесткости. Обычно преобладает жесткость, обусловленная ионами кальция (до 70%), однако в отдельных случаях магниевая жесткость может достигать 50–60%.
Слайд 3Карбонатная (временная) жесткость. Образуется при растворении в воде бикарбонатов кальция
и магния – Са(HCO3)2 и Mg(HCO3)2.При нагреве такой воды неустойчивые
бикарбонаты снова переходят в нерастворимую форму – карбонаты CaCO3↓ и MgCO3↓, образуется накипь (котельный камень). Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью.
Некарбонатная (постоянная) жесткость. Если вода растворила по пути другие минералы, содержащие кальций и магний, но не в виде карбонатов, а в виде хлоридов или сульфатов CaCl2, CaSO4, MgCl2, MgSO4. При нагревании они остаются в неизменном виде.
Слайд 4Жесткость воды может быть уменьшена с помощью обработки гашеной известью
Са(OH)2 и кальцинированной содой Na2CO3. Известь осаждает карбонаты, сода осаждает
другие соли кальция и магния. Затем образовавшиеся осадки удаляются фильтрацией. Этот способ применяется на городских водозаборах в тех случаях, когда жесткость превышает допустимые нормы. Требует довольно громоздкого оборудования и больших финансовых затрат.
Предварительная очистка воды недостаточна при подготовке воды, потребляемой в качестве добавочной для котлов и подпиточной для тепловых сетей.
Слайд 5 Заключительная стадия подготовки воды, связанная
с изменением ее ионного состава, вплоть до полного удаления растворенных
примесей, реализуется с помощью ионообменной технологии, а также мембранными или термическими методами.
Сущность ионного обмена заключается в способности специальных материалов (ионитов) изменять в желаемом направлении ионный состав обрабатываемой воды. Иониты представляют собой нерастворимые высокомолекулярные вещества, которые благодаря наличию в них специальных функциональных групп способны к реакциям ионного обмена.
Слайд 6Ионный обмен
Катионный обмен
Анионный обмен
Na +
H + Cl - OH-
Регенерация
NaCl НCl NaCl NaОН
Способность ионитов к обмену ионами с раствором определяется их строением. Иониты состоят из нерастворимой твердой основы (матрицы), получаемой чаще всего путем сополимеризации исходных продуктов: стирола (Ar - CH = CH2) и дивинилбензола (CH2 - CH = CH -CH2). Полученная в форме зерен пространственная сетка углеводородных цепей - матрица при помещении ее в воду способна увеличивать свой объем в 1.1 - 2.0 раза за счет взаимодействия с полярными молекулами H2O
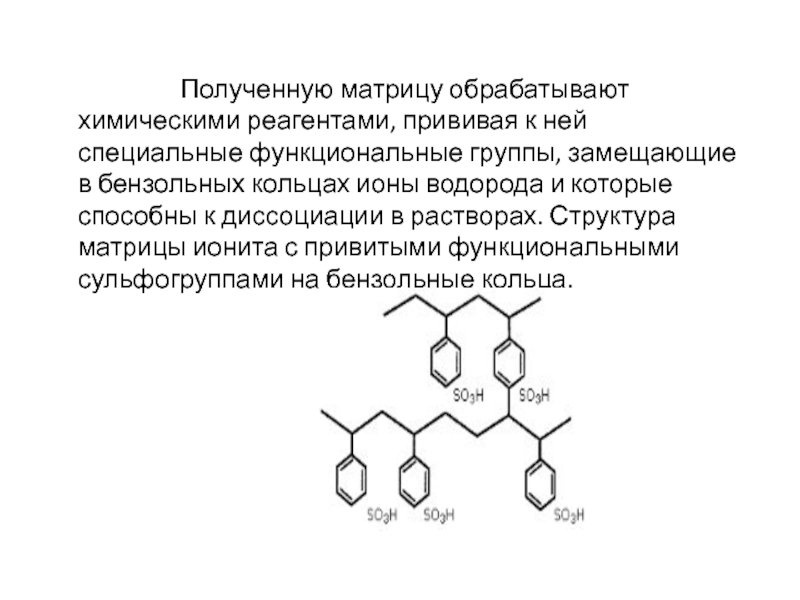
Полученную матрицу обрабатывают химическими реагентами, прививая к ней специальные
функциональные группы, замещающие в бензольных кольцах ионы водорода и которые способны к диссоциации в растворах. Структура матрицы ионита с привитыми функциональными сульфогруппами на бензольные кольца.
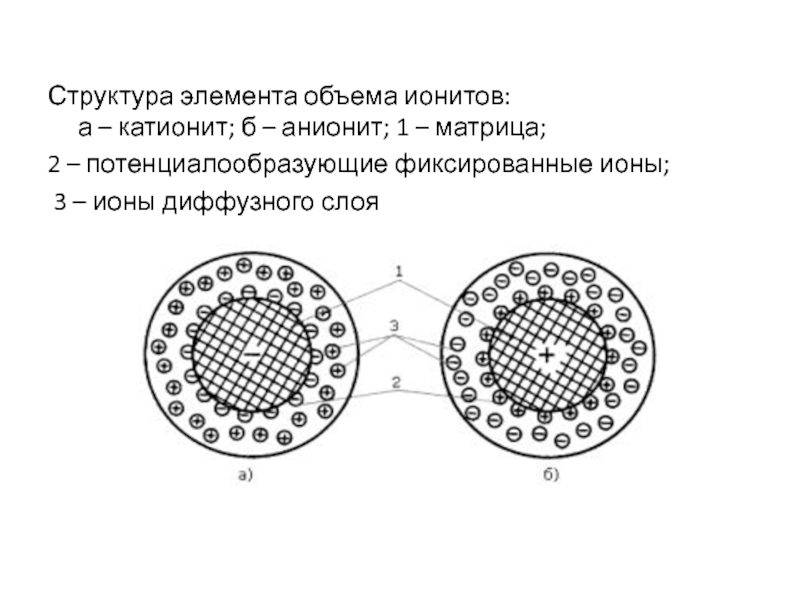
Слайд 8Структура элемента объема ионитов:
а – катионит; б – анионит; 1
– матрица;
2 – потенциалообразующие фиксированные ионы;
3 – ионы
диффузного слоя
Слайд 9Типичная реакция катионного обмена записывается как:
2КNa + Са 2+ + 2Cl- = R2Ca + 2Na+
+ 2Cl-.
Реакция осуществляется, например, при умягчении воды с помощью катионита в исходной натриевой форме. Катионит поглощает из раствора ионы-накипеобразователи кальция в обмен на ионы Na+.
Аналогично можно записать реакцию обмена анионами на анионите, например:
ROH + Na+ + Cl- = RCl + Na+ + OH-.
Слайд 10Обратимость процессов обмена ионов позволяет многократно использовать дорогостоящие иониты в
технологии обработки вод.
После замены катионов Na+ в катионите ионами Ca2+
(прямая реакция) обычно осуществляют обратный процесс - регенерацию, приводящую к восстановлению способности катионита извлекать из обрабатываемой воды ионы Ca 2+.
В ионообменной технологии большую роль играет способность к преимущественной адсорбции одних ионов по сравнению с другими, получившая название селективности (избирательности) и скорость установления ионообменного равновесия (кинетика ионного обмена).
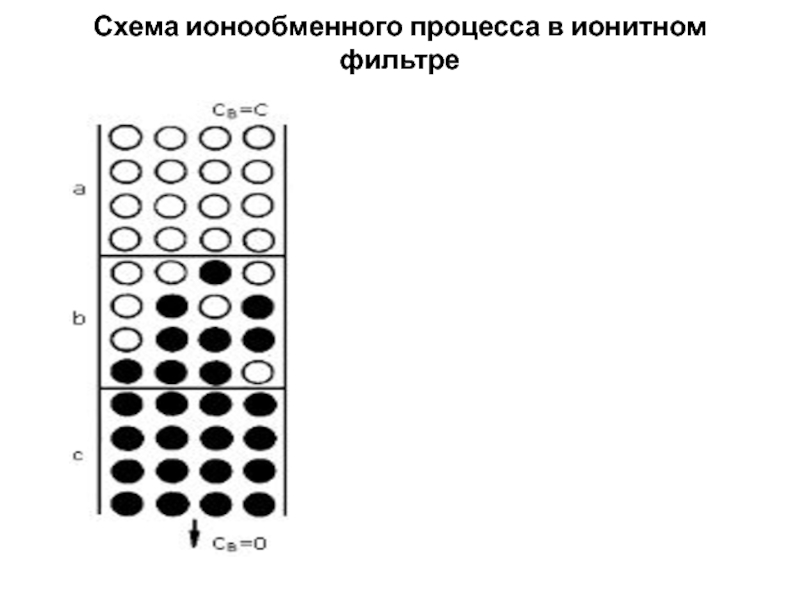
Слайд 11Схема ионообменного процесса в ионитном фильтре
Слайд 12При пропуске раствора, содержащего ионы B, через ионит, первоначально насыщенный
ионами A, протекая, раствор будет постоянно контактировать с новыми слоями
свежего (неиспользованного) ионита. Со временем, верхние слои ионита отдадут все ионы A и потеряют свою ионообменную способность, они как бы истощатся (зона a). Вследствие этого переходная зона, в которой происходит ионный обмен (зона b), будет все дальше и дальше перемещаться вниз по слою. При определенных условиях эта зона достигает стационарной ширины. Распределение концентраций обменивающихся ионов в этой зоне носит название фронта фильтрования. В нижних слоях (зона c) ионит еще полностью насыщен ионами A. Когда нижняя граница переходной зоны достигнет конца слоя ионита, наступит проскок иона B в фильтрат, что служит обычно сигналом для отключения фильтра на регенерацию.
Слайд 13Технологические характеристики ионитов
К физическим свойствам ионитов относятся: грануметрический состав (размер
зерен), насыпная масса, механическая прочность, структура ионита и степень набухания
в водных растворах.
К химическим свойствам относятся: химическая стойкость, сила кислотности (для катионитов) или основности (для анионитов), обменная емкость, удельный расход реагентов и отмывочной воды при заданной глубине удаления из воды поглощаемых ионов, термическая стойкость.
Слайд 14Крупность зерен промышленных ионитов находится в пределах от 0.3 до
1.5 мм, при этом по данным ситового анализа до 80%
объема ионитов представлено зернами диаметром от 0.5 до 1.0 мм.
Насыпная масса ионита характеризуется массой единицы его объема (т/м3, кг/дм3). Различают значения насыпной массы ионита в воздушно-сухом (gC) состоянии, а также во влажном (gB) состоянии
Степень (коэффициент) набухания kн определяется отношением значений gC и gB:
kн = gC/gB
kн и gB не являются постоянными величинами для конкретного ионита, т.к. зависят от его ионной формы, pH и состава примесей воды и других факторов, принимая значения от 1.1 до 1.6 - 1.9.
Слайд 15Механическая прочность и осмотическая стабильность зерен ионита влияет на потери
материала в течение его эксплуатации. Годовой износ отечественных ионитов, используемых
в различных установках для очистки природных вод и конденсатов, колеблется от 10 до 35%.
Химическая стойкость матрицы ионитов обеспечивается степенью межмолекулярных связей, достаточной для обеспечения ее нерастворимости. При нормальных условиях срок службы ионитов может достигать 10 и более лет.
Обменная емкость ионитов является их важнейшей технологической характеристикой. Способность к ионному обмену определена наличием в ионитах функциональных групп, которые у катионитов носят кислотный характер -SO3H (сульфогруппа), -COOH (карбоксильная группа), у анионитов - основной.
Слайд 16При работе ионитных фильтров фильтрование прекращается обычно в момент, когда
концентрация поглощаемого иона в обработанном растворе достигнет заданного, весьма малого
значения, надежно определяемого аналитически. В этом случае обменная емкость ионита определяется как рабочая. Если фильтрование заканчивается в момент проскока поглощаемого иона при его концентрации, немного отличающейся от средней за фильтроцикл, то такая обменная емкость ионита будет называться емкостью "до проскока". Значение рабочей и "до проскока" обменных емкостей ионитов достаточно близки и их можно принимать равными друг другу.
Слайд 17Регенерация
8 – 10% р-ром NaCl ( max
=26%)
KCa + NaCl = KNa
+ CaCl 2
Регенерация делится на 4 этапа:
1.Обратная промывка 10 мин
2. Медленная промывка р-ром NaCl 50 мин.
3. Прямая промывка 10 мин.
4. Заполнение
Для регенерации 1 л натриевого катионита надо 160г сухой соли NaCl .