Слайд 1Общая геохимия
Лекция 6
Изотопная геохимия. Общие вопросы
(изотопы, радиоактивный распад)
Слайд 2Зачем нужна изотопная геохимия?
Слайд 12Периодика
geology.spbu.ru/oldsite «лекции on-line»
http://ansatte.uit.no/kku000/webgeology/
Слайд 13Задачи изотопной геохронологии
Определение времени и длительности геологических событий
Основные задачи изотопной
геохимии
Оценка отношения материнского элемента к дочернему в источнике вещества по
изотопному составу и возрасту его производных;
Оценка химического состава источника исследуемого вещества;
Проверка генетической связи исследуемого вещества с известным источником (задачи геохимии, экологии);
Оценка пропорций смешения различных источников;
Оценка температур равновесия минералов и др.
Слайд 14
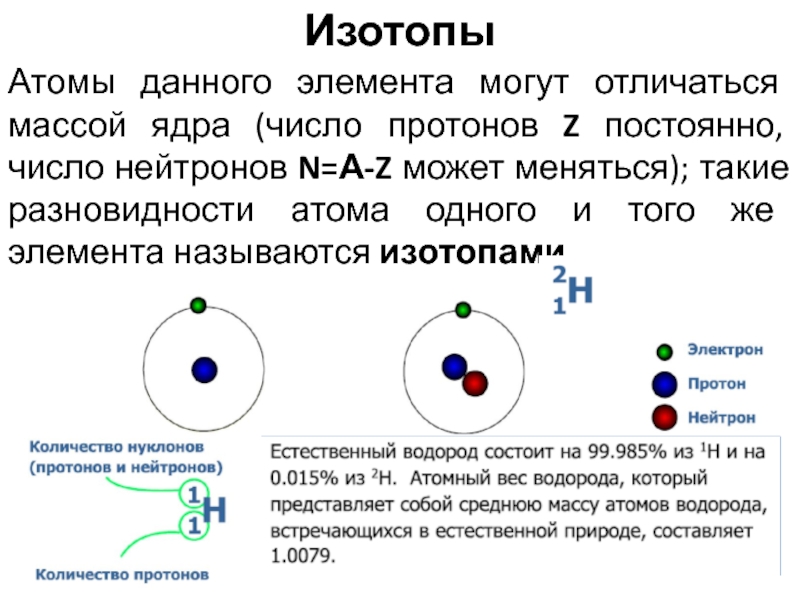
Атомы данного элемента могут отличаться массой ядра (число протонов Z
постоянно, число нейтронов N=А-Z может меняться); такие разновидности атома одного
и того же элемента называются изотопами.
Изотопы
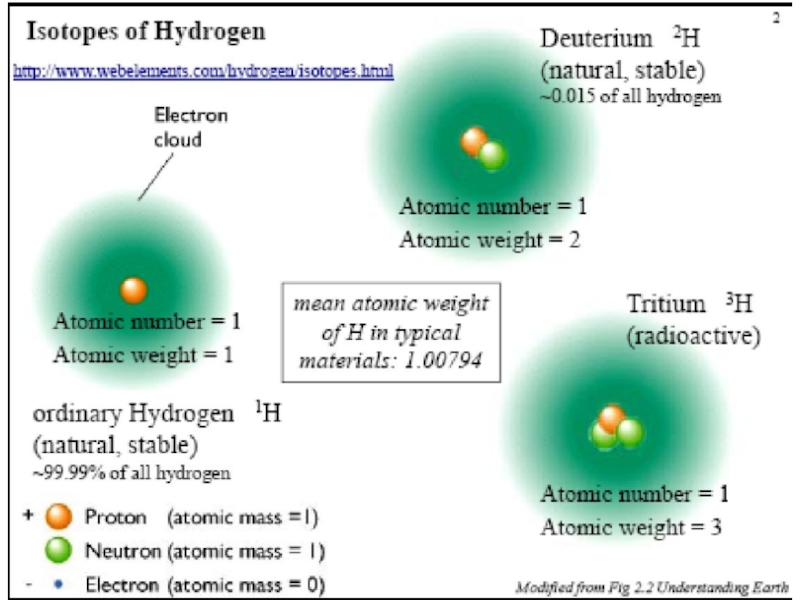
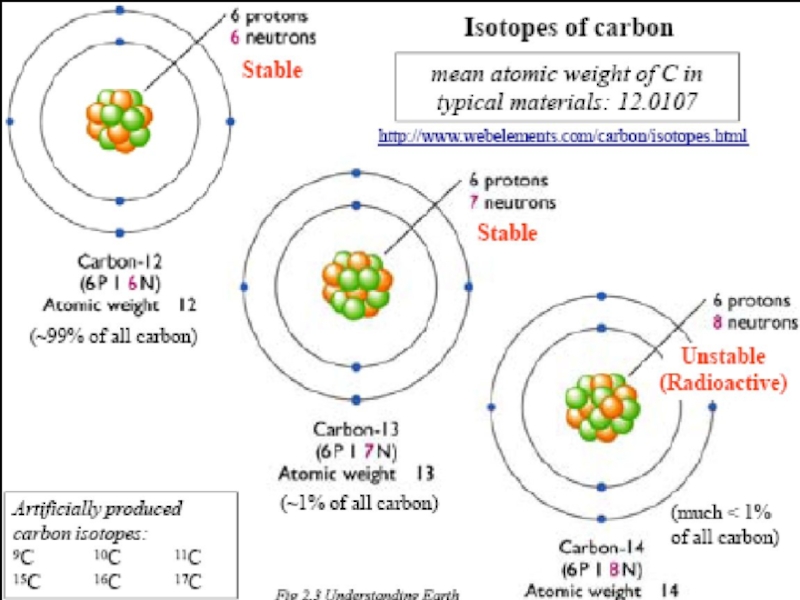
Слайд 15Изотопы – атомы одного элемента, имеющие в ядрах одинаковое число
протонов, но различное число нейтронов.
Изотопы занимают одну и ту же
клетку в Периодической таблице. Следовательно, атомная масса элемента, имеющего несколько изотопов, не является целочисленной. Атомы имеют одинаковое строение электронных оболочек и одинаковое число электронов.
Поэтому химические и ряд физических свойств у различных изотопов практически тождественны, т.е. в химических реакциях они ведут себя одинаково.
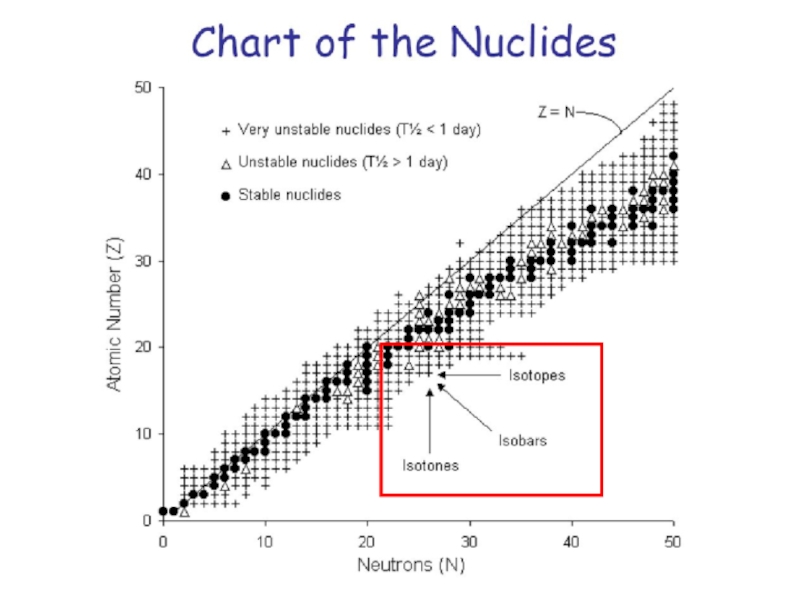
Слайд 18Изобары – атомы различных элементов, ядра которых содержат одинаковое число
нуклонов (протонов и нейтронов в сумме), и, следовательно, имеющие одинаковые
массовые числа.
19K40 (Z=19, N=21) и 20Са40 (Z=20, N=20).
Изотоны – атомы различных элементов, имеющие одинаковое число нейтронов, но разные массы A и числа протонов Z.
Изомеры – атомы одного элемента, имеющие одинаковое число как протонов, так и нейтронов, но различную энергию ядер (и период полураспада).
Обозначаются: m-метастабильное ядро.
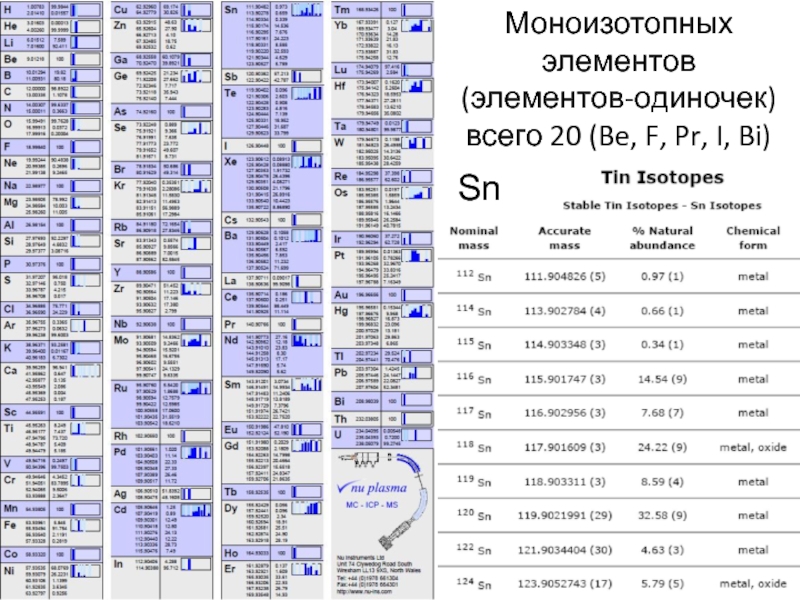
Слайд 20Моноизотопных элементов
(элементов-одиночек)
всего 20 (Be, F, Pr, I, Bi)
Sn
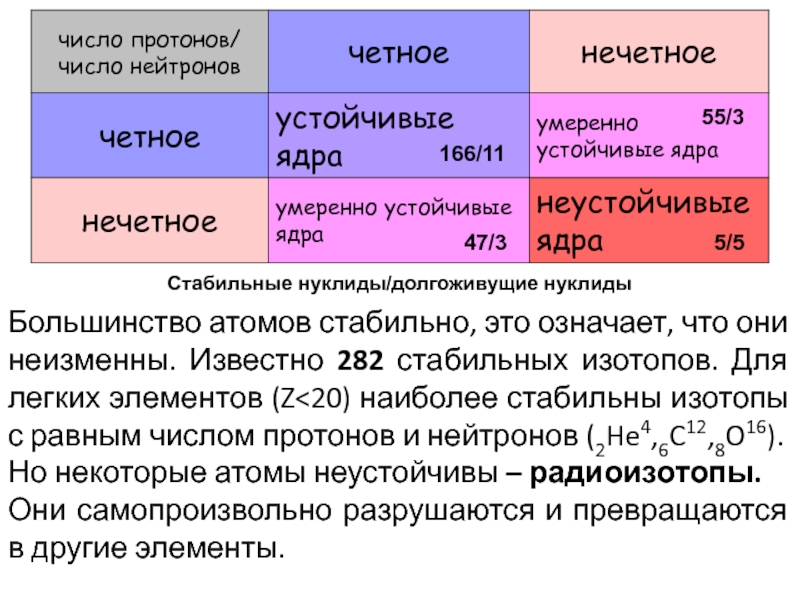
Слайд 21Все известные изотопы могут быть распределены на четыре типа по
зависимости от четного или нечетного числа протонов и нейтронов в
их составе: четно-четный 8O16, четно-нечетный 4Be9, нечетно-четный 3Li7, нечетно-нечетный 5B10. Количественные соотношения ядер различного вида представлены в таблице:
Изотопы с четным Z и четным N резко преобладают над изотопами с нечетными соотношениями.
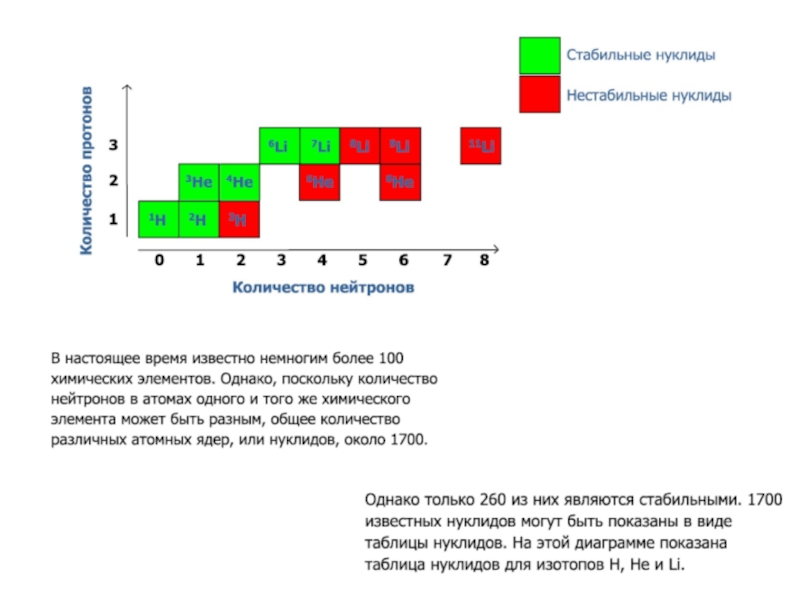
Слайд 22Большинство атомов стабильно, это означает, что они неизменны. Известно 282
стабильных изотопов. Для легких элементов (Z
равным числом протонов и нейтронов (2He4,6C12,8O16).
Но некоторые атомы неустойчивы – радиоизотопы.
Они самопроизвольно разрушаются и превращаются в другие элементы.
166/11
47/3
55/3
5/5
Стабильные нуклиды/долгоживущие нуклиды
Слайд 23Радиоактивность (от лат. radio-излучаю, radius-луч и activus-действенный), самопроизвольное (спонтанное) превращение
неустойчивого изотопа химического элемента в другой изотоп (обычно в изотоп
другого элемента). Все тяжелые изотопы с Z > 82 радиоактивны.
209Bi (Z=83, N=126) – наиболее тяжелый стабильный нуклид.
Радиоактивность (Э. Резерфорд 1903г., Ф. Содди)
Эффект открыл А. Беккерель в 1896г., установивший способность солей урана засвечивать фотопластинки, не подвергавшиеся предварительному освещению. Открытие было сделано после открытия В.К. Рентгеном Х-лучей в 1885г.
Слайд 24Хронометр Э. Резерфорда
Настуран или U руда,
богатая UO2 (Африка)
U ~ 1.5x10-10
U 8
1 gram of UO2
Возраст настурана оказался ~500 Ma
Проблемы:
• Чувствительность и погрешность манометрических измерений
• Реакция не полностью описана. U весит ~238 g/mol; 8 He ядер
только 32 g/mol. Где «остаток» вещества?
• Гелий плохо удерживается кристаллами
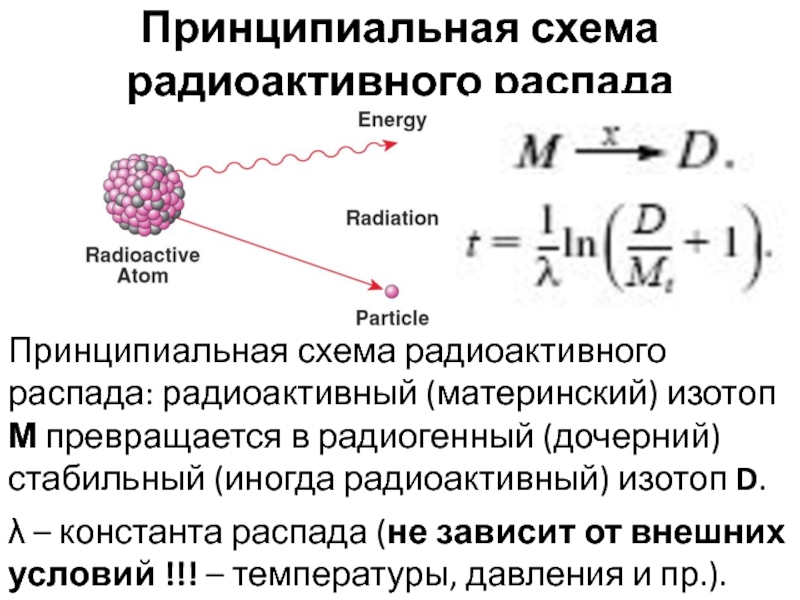
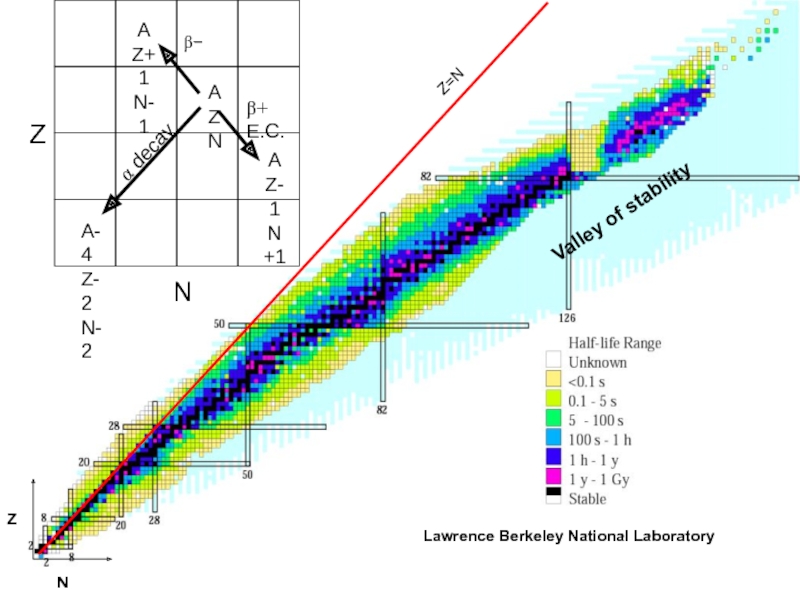
Слайд 25Принципиальная схема радиоактивного распада
λ – константа распада (не зависит от
внешних условий !!! – температуры, давления и пр.).
Принципиальная схема радиоактивного
распада: радиоактивный (материнский) изотоп М превращается в радиогенный (дочерний) стабильный (иногда радиоактивный) изотоп D.
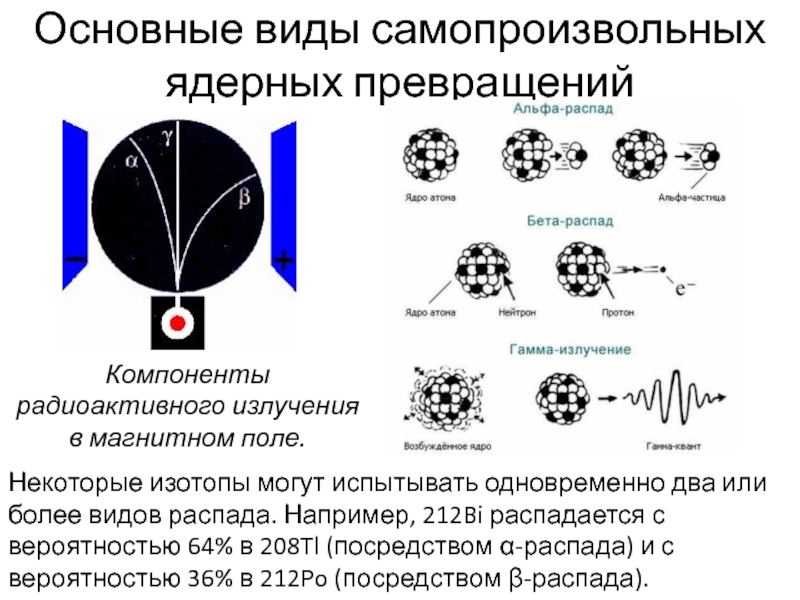
Слайд 27Компоненты радиоактивного излучения в магнитном поле.
Основные виды самопроизвольных ядерных превращений
Некоторые изотопы могут испытывать одновременно два или более видов распада.
Например, 212Bi распадается с вероятностью 64% в 208Tl (посредством α-распада) и с вероятностью 36% в 212Po (посредством β-распада).
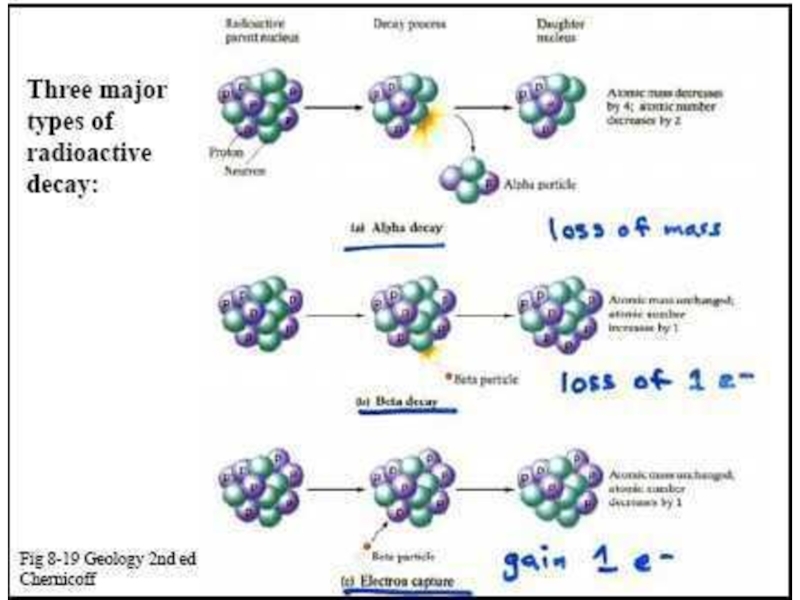
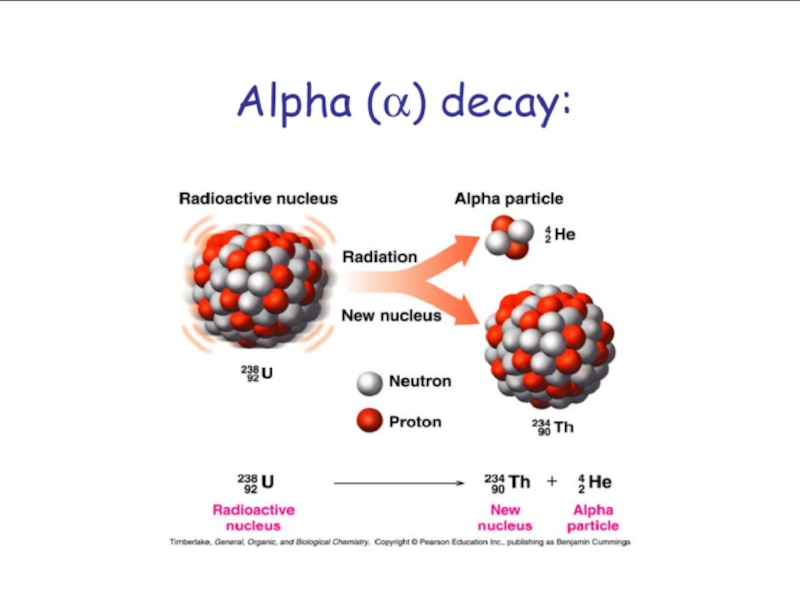
Слайд 29α-распад
Ядро испускает α-частицу, которая представляет собой ядро атома гелия
(4He) и состоит из двух протонов и двух нейтронов.
При α-распаде
массовое число изотопа уменьшится на 4, а заряд ядра - на 2.
Радий испускает α-частицу и переходит в радон.
22688Ra→22286Rn + 42He
Скорость α-частиц ~16 000 км/с.
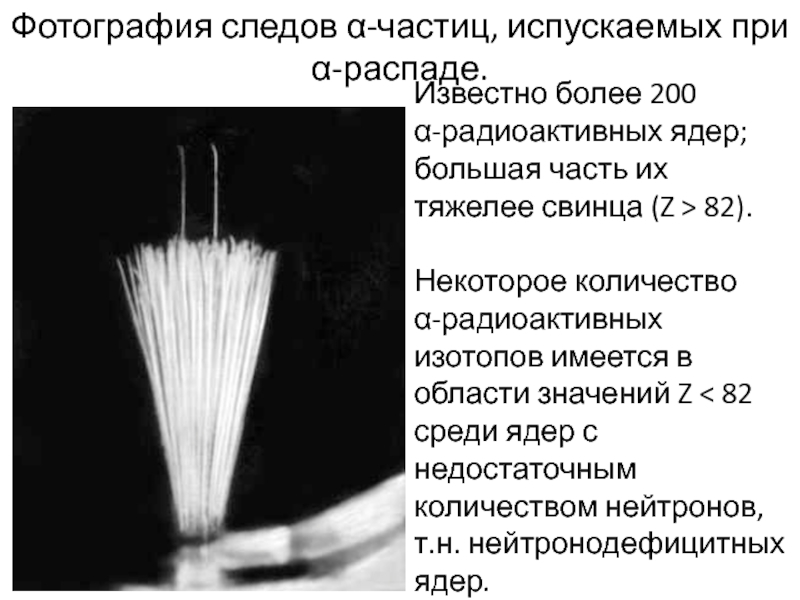
Слайд 31Фотография следов α-частиц, испускаемых при
α-распаде.
Известно более 200
α-радиоактивных ядер;
большая часть их тяжелее свинца (Z > 82).
Некоторое количество
α-радиоактивных изотопов имеется в области значений Z < 82 среди ядер с недостаточным количеством нейтронов, т.н. нейтронодефицитных ядер.
Слайд 32Три типа β-распада:
1. β- электронный распад
В неустойчивом
ядре нейтрон превращается в протон, при этом ядро испускает «электрон»
(β-частицу - негатрон).
При β-распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1.
β-активность атомных ядер можно рассматривать как распад одного ядерного нейтрона на протон и электрон
(+ антинейтрино) ZMA Z+1MA +
Правило сдвига: образующийся при распаде атом занимает следующую клетку вправо от изначального (масса его практически не меняется, так как масса электрона в ~2000 раз меньше массы нейтрона). Скорость электрона 150-300 000 км/с.
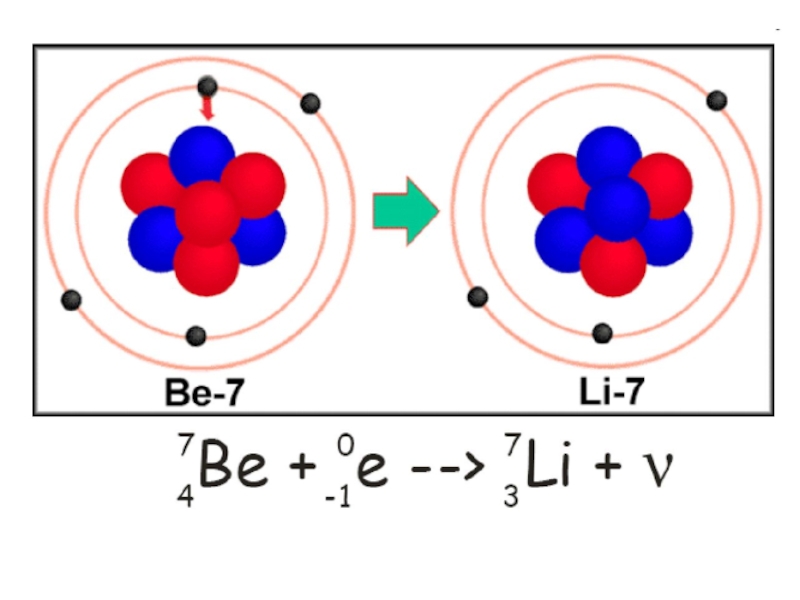
Слайд 34Явление электронного захвата противоположно
β-распаду: электрон с нижнего К-уровня поглощается
ядром, то есть протон в ядре реагирует с электроном, образуя
нейтрон (и испускается нейтрино).
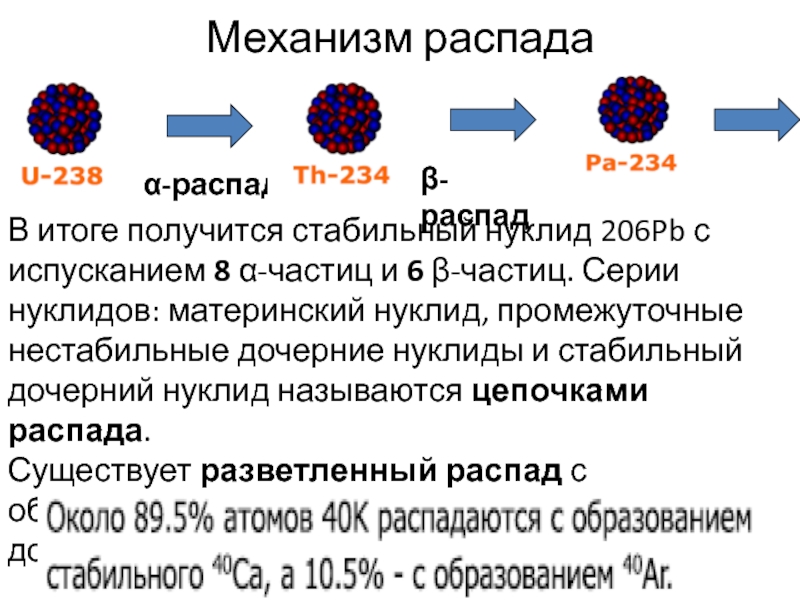
При этом атомный номер элемента уменьшается на 1, то есть перемещается в таблице Менделеева на одну клетку влево. Среди естественных радиоизотопов существуют такие, которые одновременно испытывают К-захват и β-распад (40К).
Схема электронного захвата: ZMA + е- Z-1MA
2. Е-захват – электронный захват
(K-захват, редко L-захват)
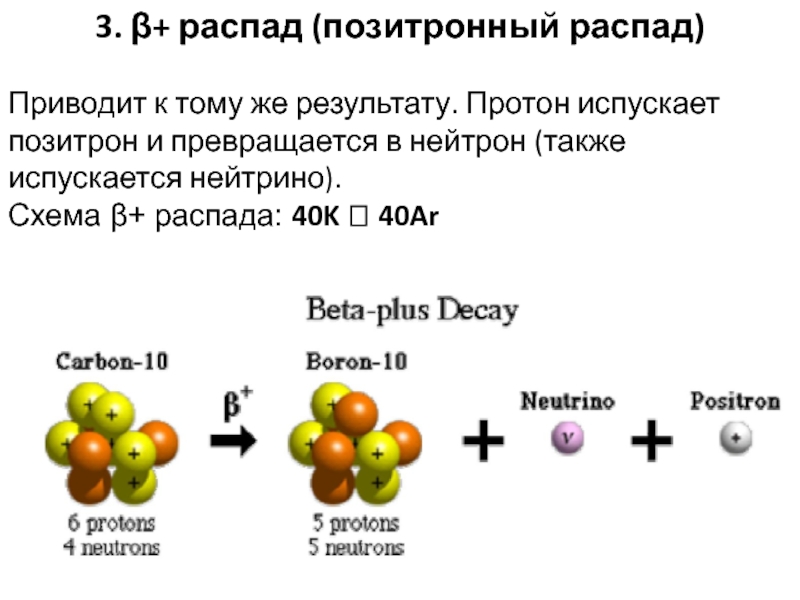
Слайд 363. β+ распад (позитронный распад)
Приводит к тому же результату.
Протон испускает позитрон и превращается в нейтрон (также испускается нейтрино).
Схема β+ распада: 40K 40Ar
Слайд 37Спонтанное деление
(кластерная радиоактивность)
Наблюдается только у ядер тяжелых элементов с
Z≥90. При этом типе радиоактивности образуются два новых ядра с
массами с соотношением приблизительно 2:3. Часто сопровождается испусканием 2-3 нейтронов. Обозначается как f.
238U 144Ba + 92Kr + 2n
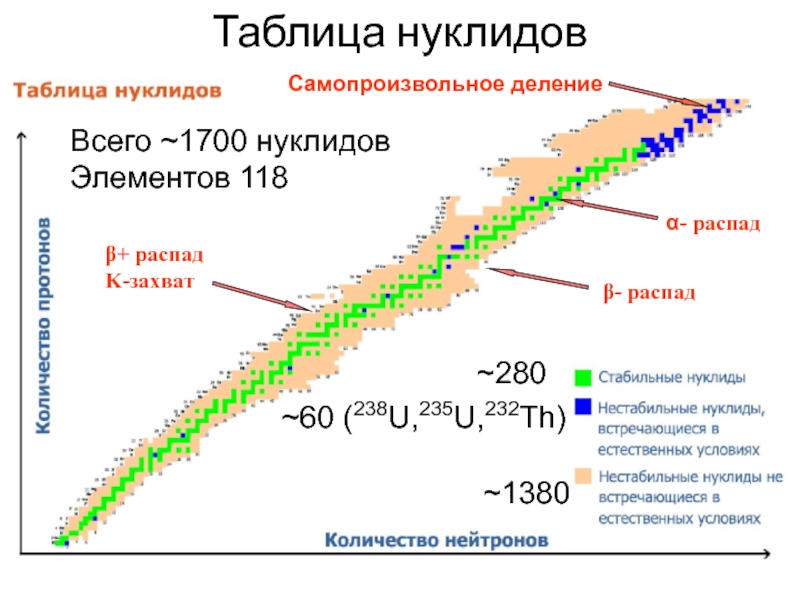
Слайд 39Таблица нуклидов
~280
~60 (238U,235U,232Th)
~1380
Всего ~1700 нуклидов
Элементов 118
Самопроизвольное деление
β- распад
β+ распад
K-захват
α- распад
Слайд 41Механизм распада
α-распад
β- распад
В итоге получится стабильный нуклид 206Pb с испусканием
8 α-частиц и 6 β-частиц. Серии нуклидов: материнский нуклид, промежуточные
нестабильные дочерние нуклиды и стабильный дочерний нуклид называются цепочками распада.
Существует разветленный распад с образованием двух различных стабильных дочерних нуклидов:
Слайд 43Закон радиоактивного распада
-dN/dt ~ N,
dN/dt – скорость изменения
числа атомов
родительского нуклида
“-” скорость распада уменьшается во времени
-dN/dt=λN, λ – константа
скорости распада
(доля от общего числа атомов, распадающаяся в единицу времени или вероятность того, что атом распадется за определенный промежуток времени)
λN – активность изотопа (число распадов в единицу времени). Чем больше константа, тем быстрее распадается изотоп
….. Интегрируем, вводим N0 при t=0…
Слайд 44Example of exponential decay….
Duration of race:
N riders
D crashes
λ = probability
of a crash
t = ln (D / N + 1)
/ λ
N
(# riders)
D
(# crashers)
Слайд 45
N – число радиоактивных родительских атомов, которое осталось к моменту
времени t от N0 - первоначального числа атомов, которое было
вначале при t = 0,
λ – константа распада
e – основание натурального логарифма (=2,718)
Основное уравнение, описывающее все виды радиоактивного распада
Слайд 46D*=N0-N => D*=N0-N0e –λt => D*= N0(1-e-λt),
где D* -
количество радиогенного изотопа.
Обычно удобнее сравнивать D* с количеством оставшихся
родительских изотопов, то есть
D*=N(eλt-1),
В общем случае число атомов дочернего продукта D, присутствующих в системе определяется как D = D0+D*, где D0 – первоначальное число атомов дочернего нуклида, уже имевшееся в системе при t=0, D* - число радиогенных атомов (образовавшихся в системе за счет распада родительского элемента), то есть
D=D0+N(eλt-1)
это основное уравнение, используемое для определения возраста пород и минералов.
D и N мы измеряем, D0 – выбираем либо из общих соображений, либо по сингенетичным минералам.
Слайд 48Это справедливо при соблюдении следующих условий:
Система должна быть закрытой, то
есть минерал или порода не должны терять ни родительский, ни
дочерний нуклиды.
D0 должны быть приписаны реальные значения
Константа распада должна быть точно известна
D и N должны быть измерены с достаточной точностью, а полученные значения представительными по отношению к породе или минералу
Мы всегда получаем датировку при решении уравнения, но возрастом она становится только при соблюдении этих условий и когда это имеет геологический смысл
Слайд 49Как вычислить возраст минерала (породы)?
Вычисленный возраст является истинным, только если
минерал (порода) представлял собой все это время закрытую химическую систему
(обмена атомами (естественная миграция элементов) материнского и дочернего нуклидов между кристаллом и окружающей средой после его образования не было) и не содержал атомов дочернего нуклида на время образования.
N – материнский радиоактивный нуклид
D – стабильный дочерний радиогенный нуклид
t – время с момента образования минерала
λ - константа распада
T ½ - период полураспада
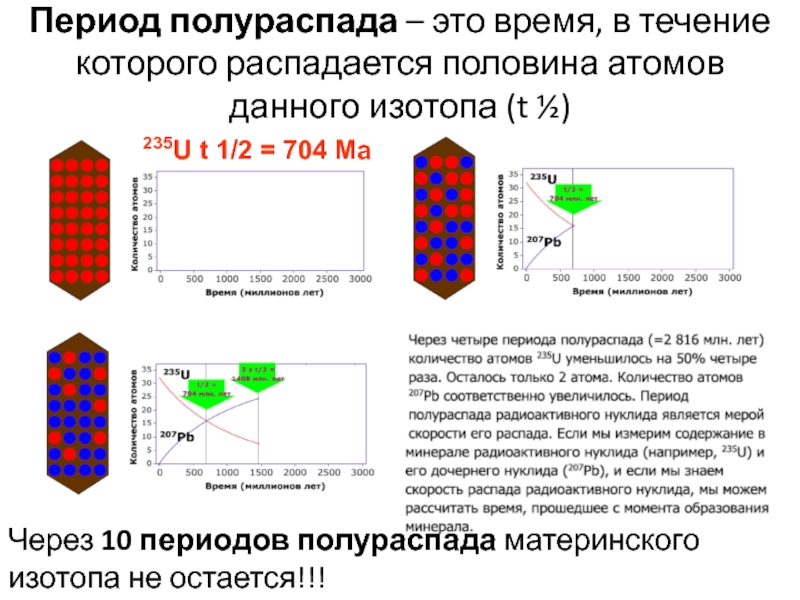
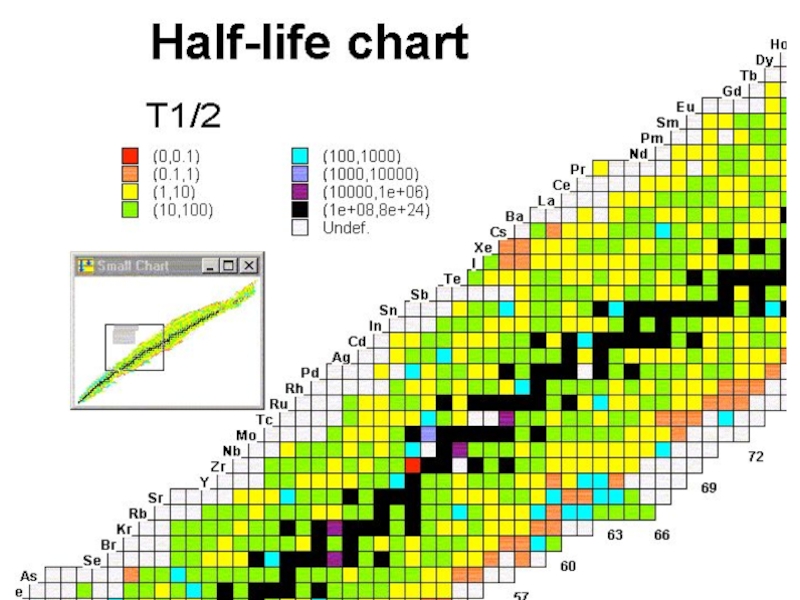
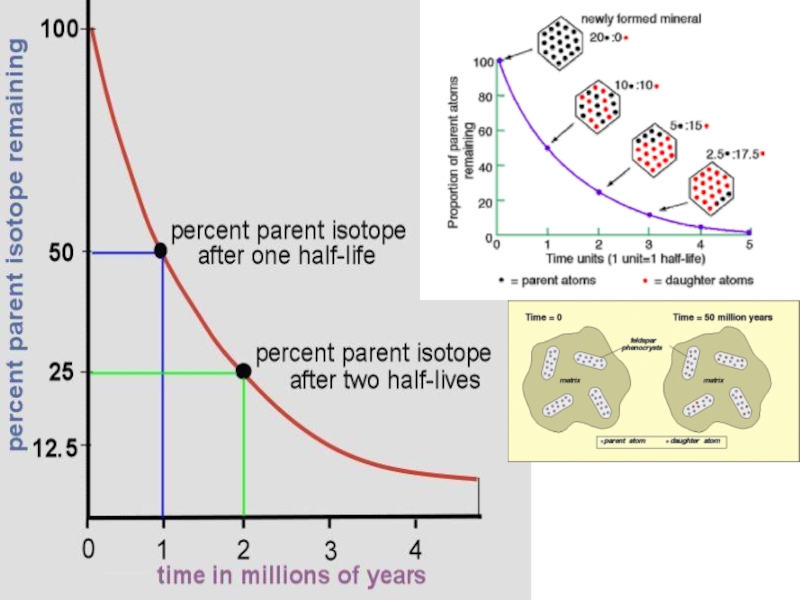
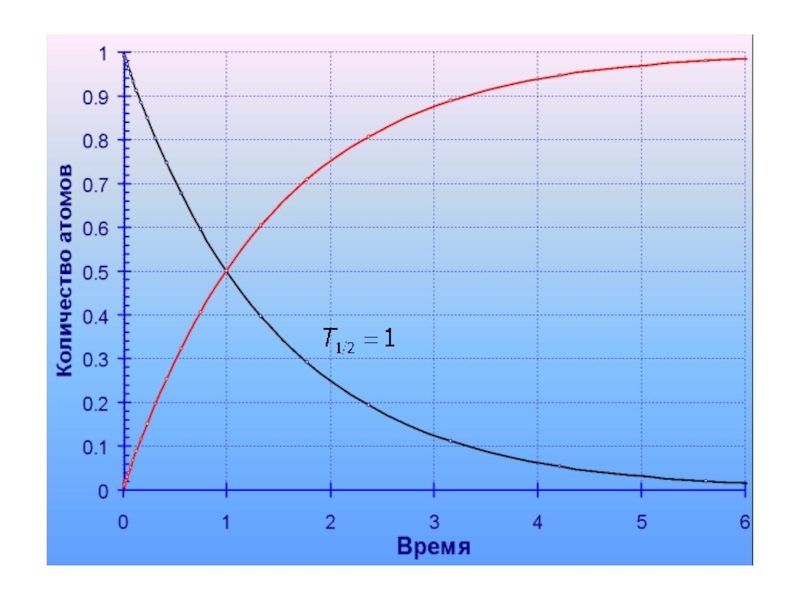
Слайд 50Период полураспада – это время, в течение которого распадается половина
атомов данного изотопа (t ½)
235U t 1/2 = 704 Ma
Через
10 периодов полураспада материнского изотопа не остается!!!
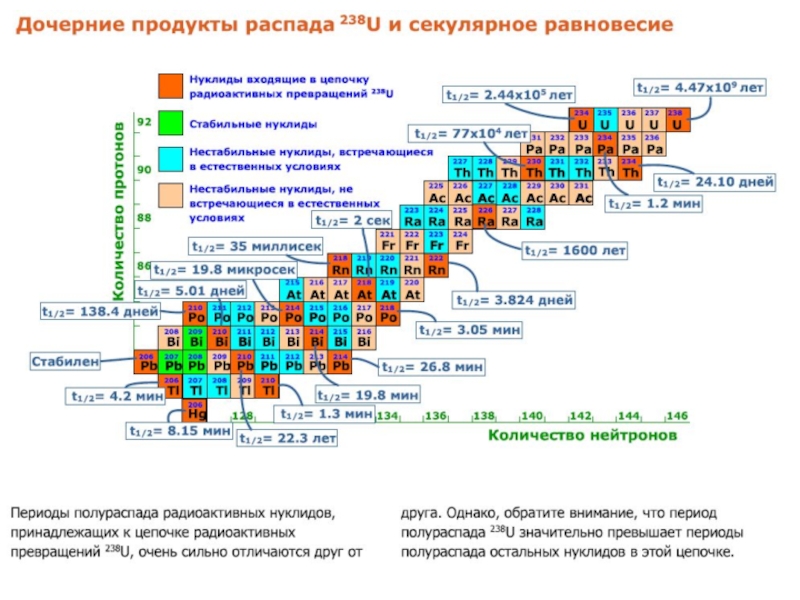
Слайд 54Цепочки радиоактивных превращений
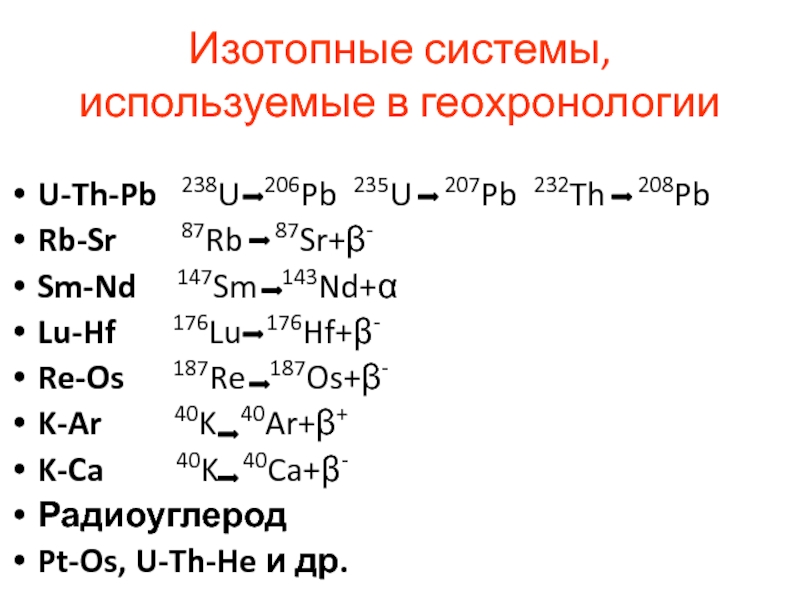
Слайд 56Изотопные системы, используемые в геохронологии
U-Th-Pb 238U 206Pb 235U
207Pb 232Th 208Pb
Rb-Sr 87Rb
87Sr+β-
Sm-Nd 147Sm 143Nd+α
Lu-Hf 176Lu 176Hf+β-
Re-Os 187Re 187Os+β-
K-Ar 40K 40Ar+β+
K-Ca 40K 40Ca+β-
Радиоуглерод
Pt-Os, U-Th-He и др.