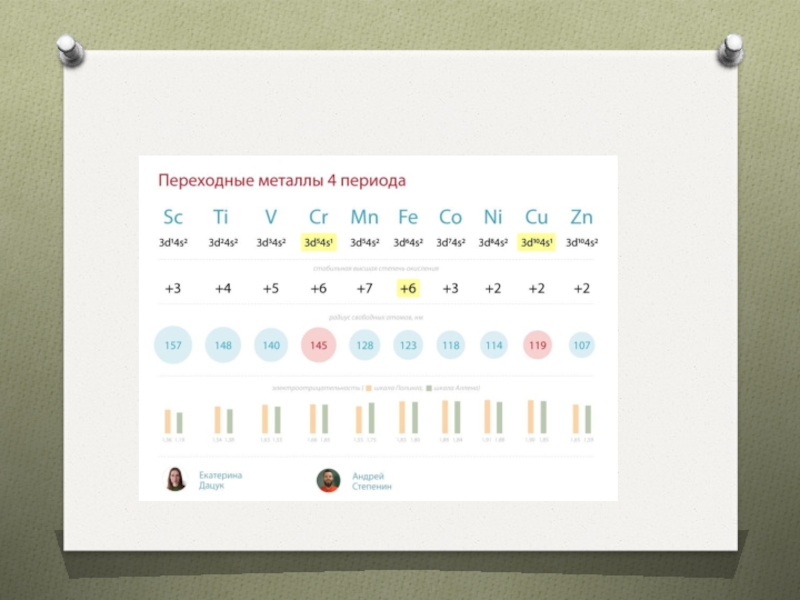
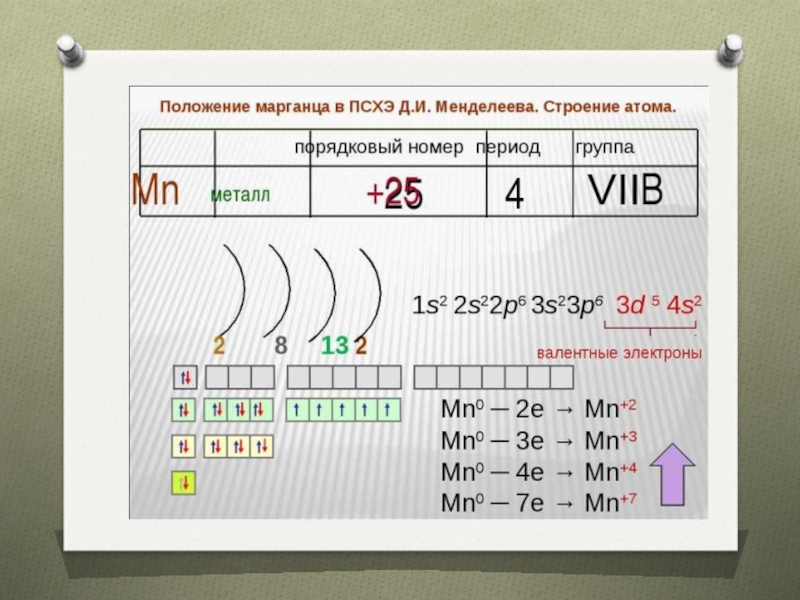
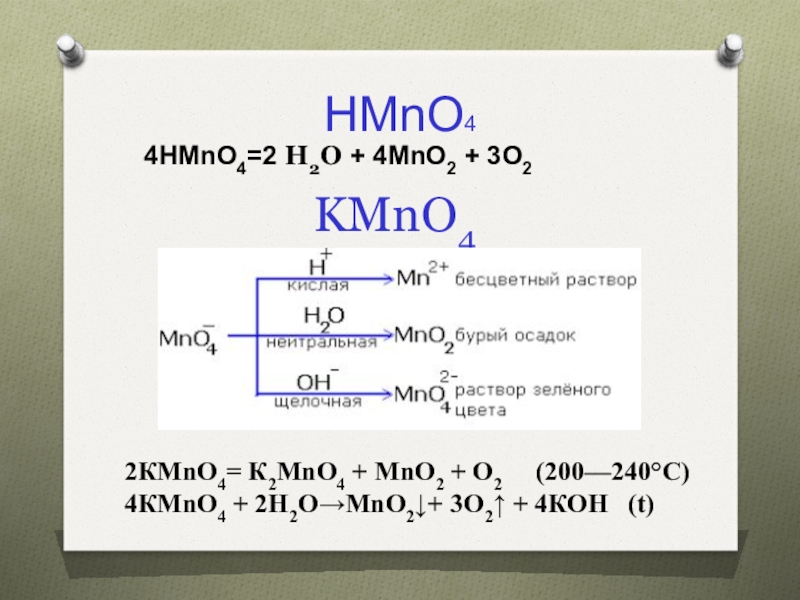
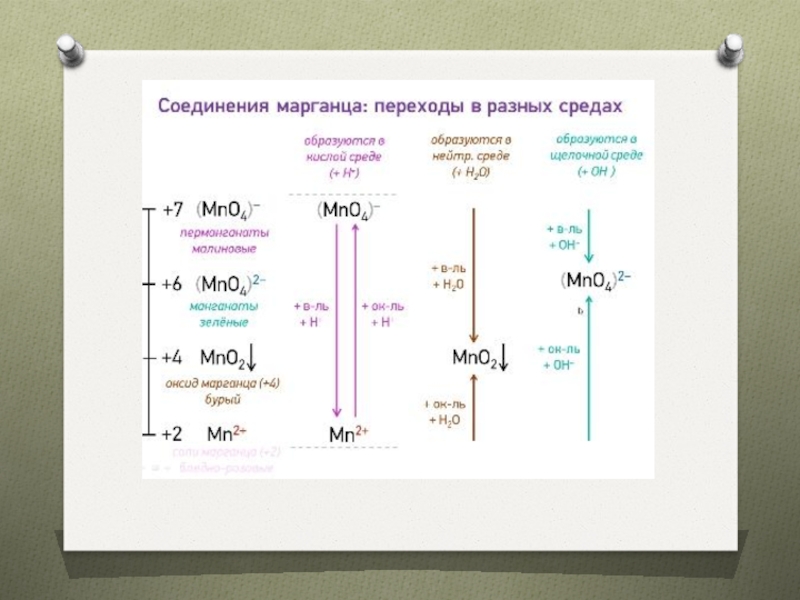
предвнешнего уровня
В периодах свойства атомов изменяются медленнеев подгруппах радиус атома
неравномерноОбразуют комплексные соединения
Их соединения часто окрашены
Проявляют каталитическую активность
В живых организмах выполняют роль микроэлементов