Слайд 1Общая характеристика элементов IVA-группы. Углерод и кремний
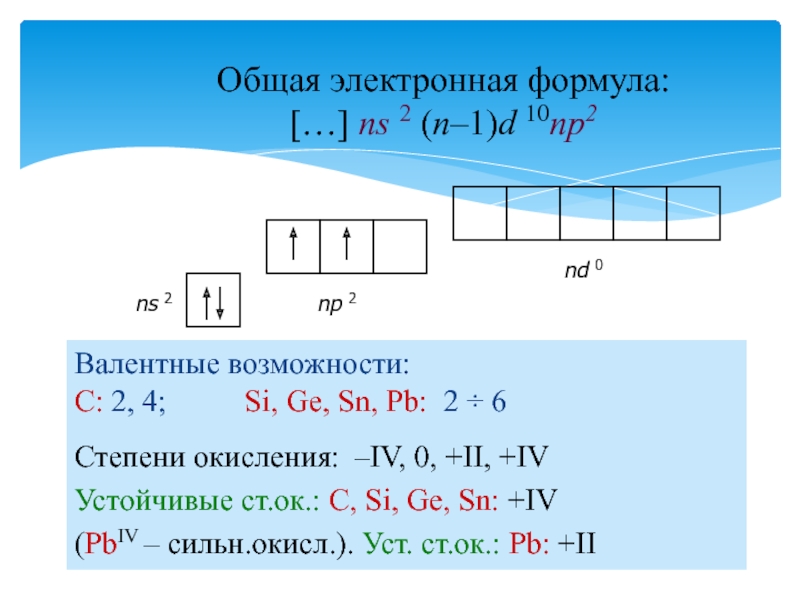
Слайд 2Валентные возможности:
С: 2, 4; Si, Ge,
Sn, Pb: 2 6
Общая электронная формула:
[…] ns 2 (n–1)d
10np2
Степени окисления: –IV, 0, +II, +IV
Устойчивые ст.ок.: С, Si, Ge, Sn: +IV
(PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
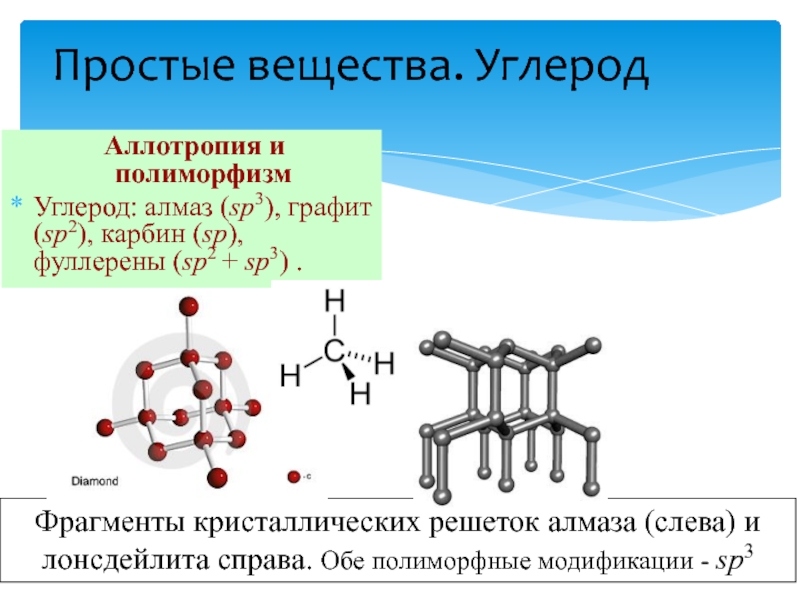
Слайд 3Простые вещества. Углерод
Аллотропия и полиморфизм
Углерод: алмаз (sp3), графит (sp2),
карбин (sp), фуллерены (sp2 + sp3) .
Фрагменты кристаллических решеток алмаза
(слева) и лонсдейлита справа. Обе полиморфные модификации - sp3
Слайд 4Алмаз
Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515
г/см3.
Крист. решетка атомная (sp3-гибридизация).
Выше 1200 С переходит в графит.
При прокаливании на воздухе сгорает.
Кимберлитовые трубки
Слайд 5Простые вещества. Углерод
Аллотропия и полиморфизм
Углерод: алмаз (sp3), графит (sp2),
карбин (sp), фуллерен.
Структура графита (справа), и одна из реакций окисления
графита (слева)
С + H2O + O
Слайд 6Графит
Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27
г/см3, электропроводен, устойчив.
Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой,
металлами).
Кристаллическая решетка слоистая (sp2-гибридизация).
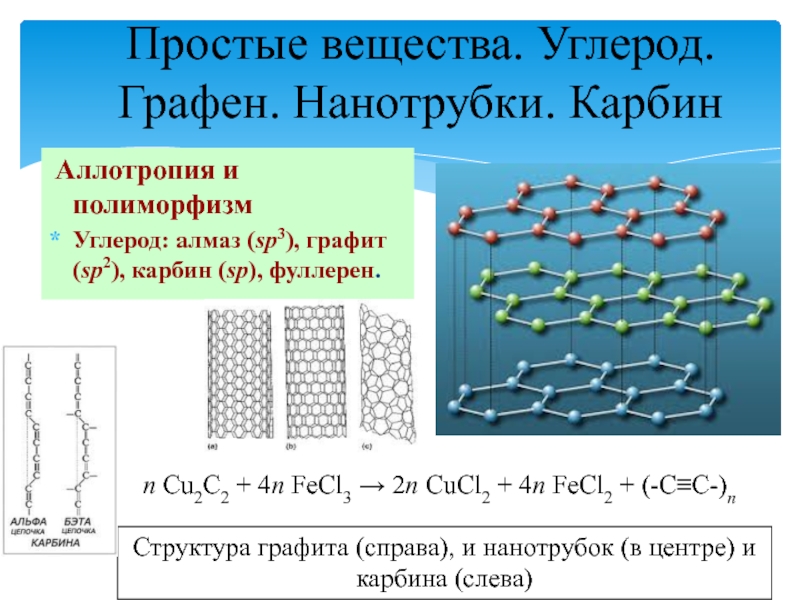
Слайд 7Простые вещества. Углерод.
Графен. Нанотрубки. Карбин
Аллотропия и полиморфизм
Углерод: алмаз (sp3),
графит (sp2), карбин (sp), фуллерен.
Структура графита (справа), и нанотрубок (в
центре) и карбина (слева)
n Cu2C2 + 4n FeCl3 2n CuCl2 + 4n FeCl2 + (-CC-)n
Слайд 8Простые вещества. Углерод.
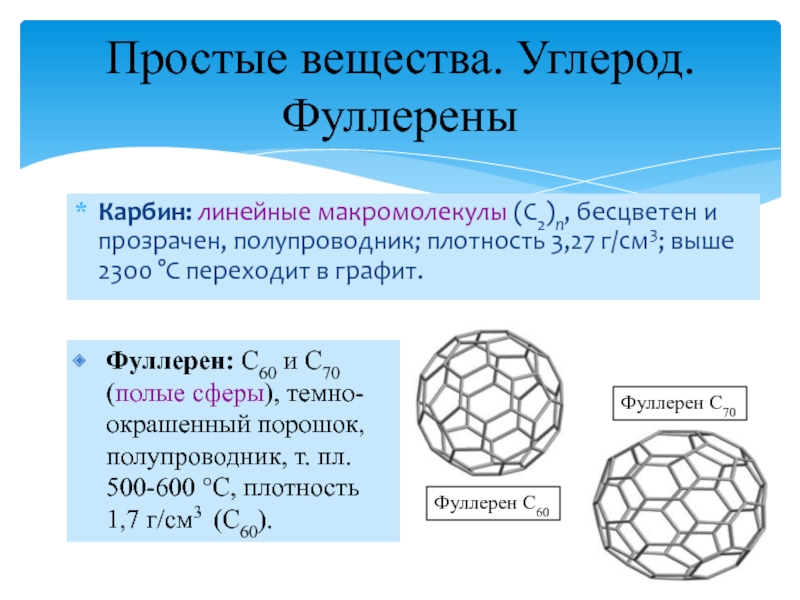
Фуллерены
Аллотропия и полиморфизм
Углерод: алмаз (sp3), графит (sp2),
карбин (sp), фуллерен.
Структура фуллеренов: слева направо:
C60, C60@U, C70
C60@U –
пример соединений включения в фуллерены
Слайд 9Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27
г/см3; выше 2300 С переходит в графит.
Простые вещества. Углерод.
Фуллерены
Фуллерен: С60 и С70 (полые сферы), темно-окрашенный порошок, полупроводник, т. пл. 500-600 C, плотность 1,7 г/см3 (С60).
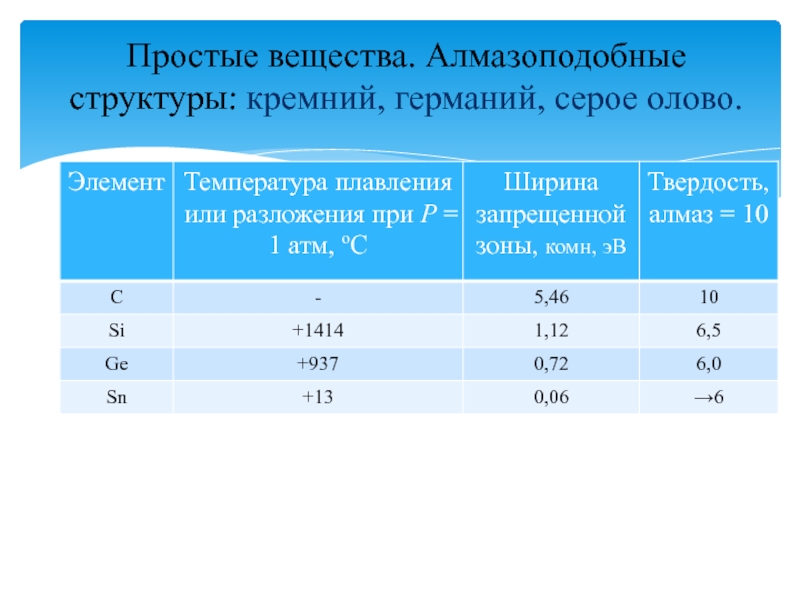
Слайд 10Простые вещества. Алмазоподобные структуры: кремний, германий, серое олово.
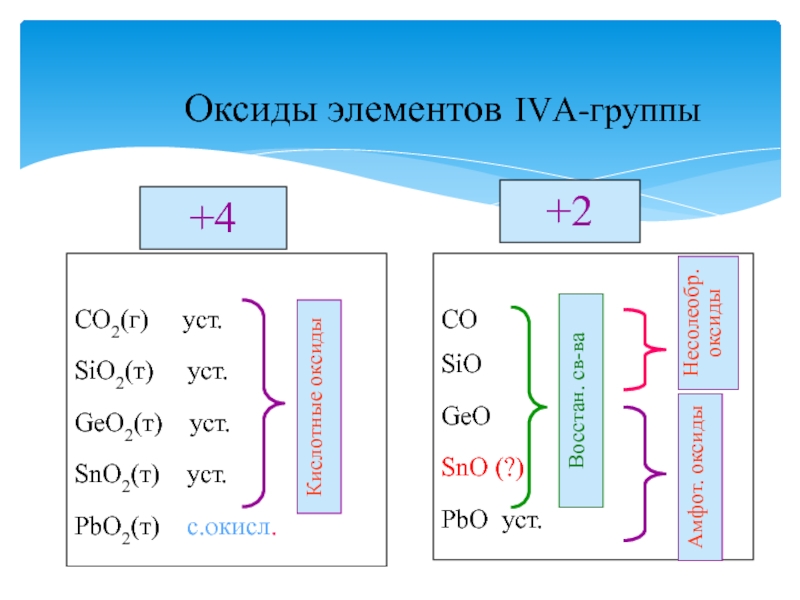
Слайд 11Оксиды элементов IVА-группы
+4
CO2(г) уст.
SiO2(т) уст.
GeO2(т)
уст.
SnO2(т) уст.
PbO2(т) с.окисл.
+2
CO
SiO
GeO
SnO (?)
PbO уст.
Слайд 12Высшие кислородные соединения.
Диоксид углерода CO2 (кислотный оксид)
Бесцветный газ, без запаха,
тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в
1 л воды – около 1,7 л CO2).
В тв. сост. («сухой лёд») – молекулярная крист. решетка; т. возгонки –78 С, т.пл. –57 С (р = 5 атм).
sp-гибридизация
Слайд 13Монооксид углерода CO – несолеобразующий оксид
Бесцветный газ, без запаха,
легче воздуха, малорастворим в воде, т.кип. –191,5 С, ядовит («угарный
газ»).
Восстановительные свойства (t):
4CO + Fe3O4 = 3Fe + 4CO2
(пирометаллургия)
Слайд 14Донорные свойства:
CO образует прочные комплексы, например [Fe(CO)5].
Монооксид углерода
CO
: C ::: O
Обнаружение:
PdCl2 + CO + H2O =
Pd + CO2 + 2HCl
I2O5 + 5CO = I2 + 5CO2
Слайд 15Некоторое отступление.
Несколько слов о кристаллах…
Трансляционная симметрия кристалла
Свойства симметрии идеальных кристаллов
проявляются в следующем. В идеальном кристалле можно ввести три вектора
трансляций a, b и c так, что физические свойства кристалла в некоторой произвольно выбранной точке r точно воспроизводятся в любой другой точке r′ удовлетворяющей условию
r = r′ + T = r′ + n1a + n2b + n3c, (*)
где n1, n2, n3 − произвольные целые числа. Совокупность точек r, определяемая выражением (*), при различных n1, n2, n3 дает кристаллическую решетку, которая является геометрическим образом регулярного периодического расположения атомов в пространстве.
Слайд 16Некоторое отступление.
Несколько слов о кристаллах…
Трансляционная симметрия кристалла
Параллелепипед, имеющий в
качестве ребер векторы a, b и c, называется элементарной ячейкой
кристалла. Перемещение в пространстве ячейки как целого, описываемое вектором
T = n1a + n2b + n3c,
называется трансляцией. Вектор трансляции связывает любые две соответственные точки кристаллической решетки. Посредством операций трансляции элементарной ячейкой можно заполнить все пространство кристаллической структуры. Такое свойство кристалла называется трансляционной симметрией.
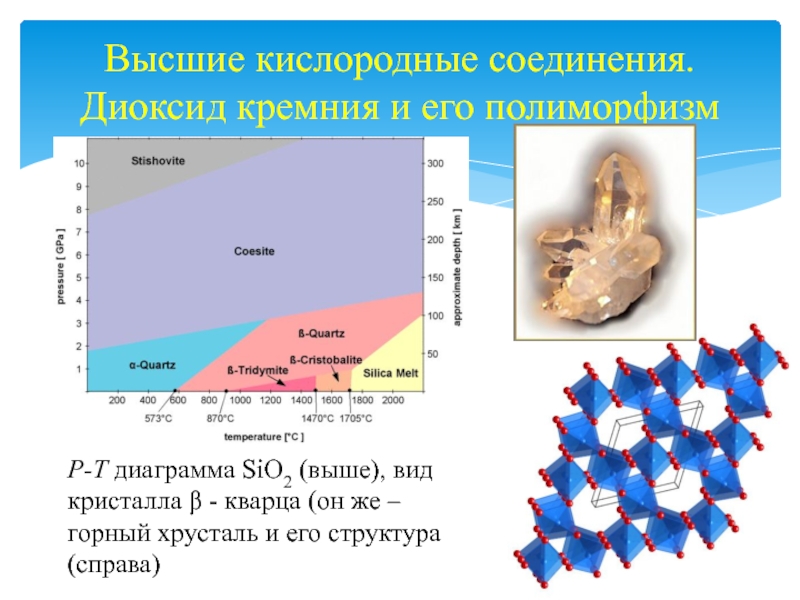
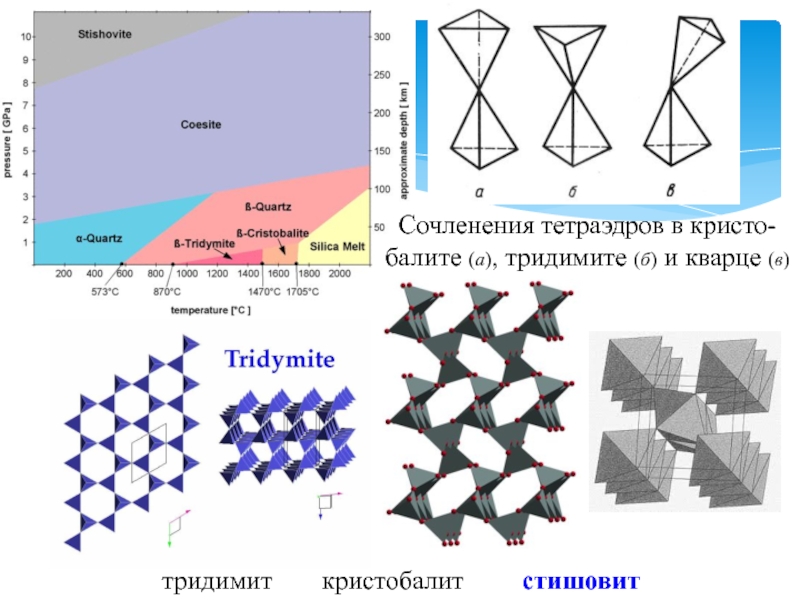
Слайд 17Высшие кислородные соединения. Диоксид кремния и его полиморфизм
P-T диаграмма SiO2
(выше), вид кристалла b - кварца (он же – горный
хрусталь и его структура (справа)
Слайд 18тридимит кристобалит стишовит
Сочленения тетраэдров в кристо-балите (а), тридимите (б) и кварце (в)
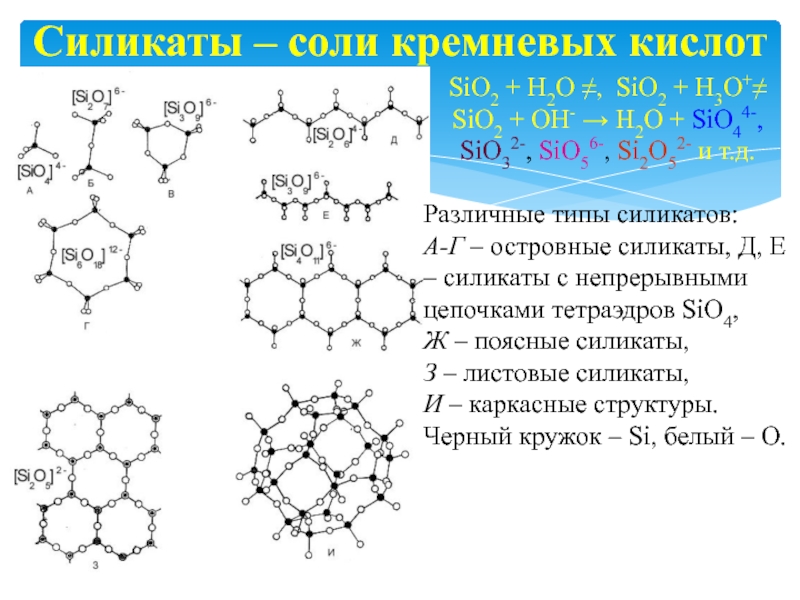
Слайд 19Силикаты – соли кремневых кислот
SiO2 + H2O , SiO2 +
H3O+
SiO2 + OH- H2O + SiO44-, SiO32-, SiO56-, Si2O52-
и т.д.
Различные типы силикатов:
А-Г – островные силикаты, Д, Е – силикаты с непрерывными цепочками тетраэдров SiO4,
Ж – поясные силикаты,
З – листовые силикаты,
И – каркасные структуры.
Черный кружок – Si, белый – О.
Слайд 20Камни (минералы) бывают разные... Но чаще встречаются одни и те
же – силикаты…
Самые древние минералы – оливины.
(Mg1-xFex)2SiO4 – оливин
(хризолит) MII2SiO4
Mg2SiO4 – форстерит, Fe2SiO4 – фаялит
Рингвудит – фаза (Mg1-xFex)2SiO4 высокого давления
Образец оливина и его кристаллическая
структура (островной силикат).
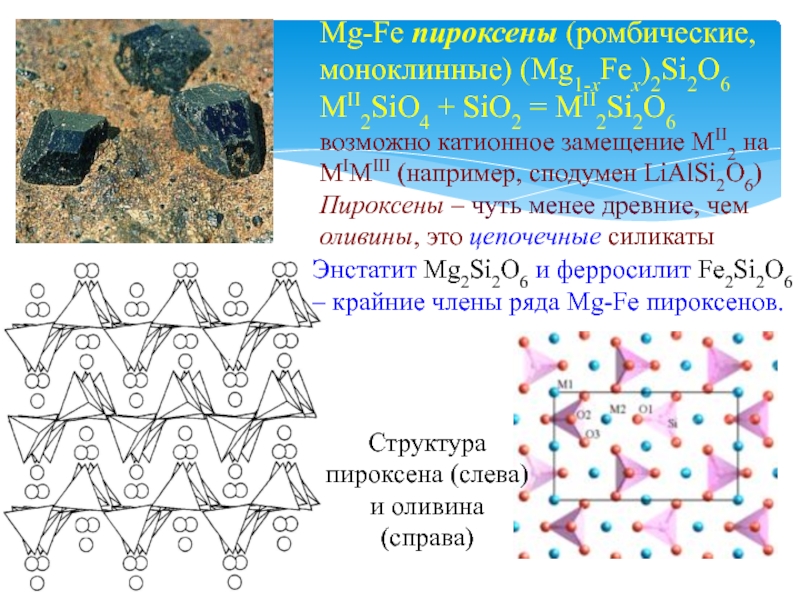
Слайд 21Mg-Fe пироксены (ромбические,
моноклинные) (Mg1-xFex)2Si2O6
MII2SiO4 + SiO2 = MII2Si2O6
возможно
катионное замещение MII2 на
MIMIII (например, сподумен LiAlSi2O6)
Пироксены – чуть менее
древние, чем оливины, это цепочечные силикаты
Энстатит Mg2Si2O6 и ферросилит Fe2Si2O6 – крайние члены ряда Mg-Fe пироксенов.
Структура пироксена (слева) и оливина (справа)
Слайд 22M2Si2O6
M2SiO4
Оливин
Пироксен
Амфибол
Полевой шпат KAlSi3O8
Мусковит (слюда) KAl2(AlSi3O10)(OH)2
Кварц (SiO2)
Структура плагиоклаза
|
Биотит M2Si4O10, M =
Fe, Mg
Ca-плагиоклаз: СaAl2Si2O8
M7[Si4O12]2
Na-плагиоклаз: NaAlSi3O8
Слайд 23Структура монтмориллонита
Гидролиз силикатов на примере оливина:
оливин пироксен
серпентин монтмориллонит
2MII2SiO4 + HOH MII2Si2O6 + 2MII(OH)2
MII2Si2O6 + MII(OH)2
+ HOH M3Si2O5(OH)4
Серпентин (Змеевик)
Конечный продукт гидролиза оливинов,
Пироксенов и серпентинов –
монтмориллонит
(MII, I)0,33(MII, III)2(Si4O10)(OH)2·nH2O
Образец серпентина
Слайд 24Промежуточный итог: у минералов (твердых фаз) своя эволюция. В частности,
для силикатов:
Самые древние силикаты – наиболее “основные”; “Кислотная составляющая” возрастала
с течением времени;
Самые древние силикаты – наиболее восстановленные; окислительная природа также возрастала с течением времени;
Вода (и возможность гидролиза) появились не сразу; продукты гидролиза в древних силикатах всегда вторичны
Наиболее сложные структуры (амфиболы, биотиты) – всегда новые. И именно эти структуры наиболее подходят для укрытий (а по ряду теорий – и для зарождения жизни).
Слайд 25Топаз Al2(SiO4)(F2x(OH)2-2x)
Агат SiO2xH2O
Халцедон SiO2
Структура кварца (в центре) и кварцевого стекла
(слева и справа)
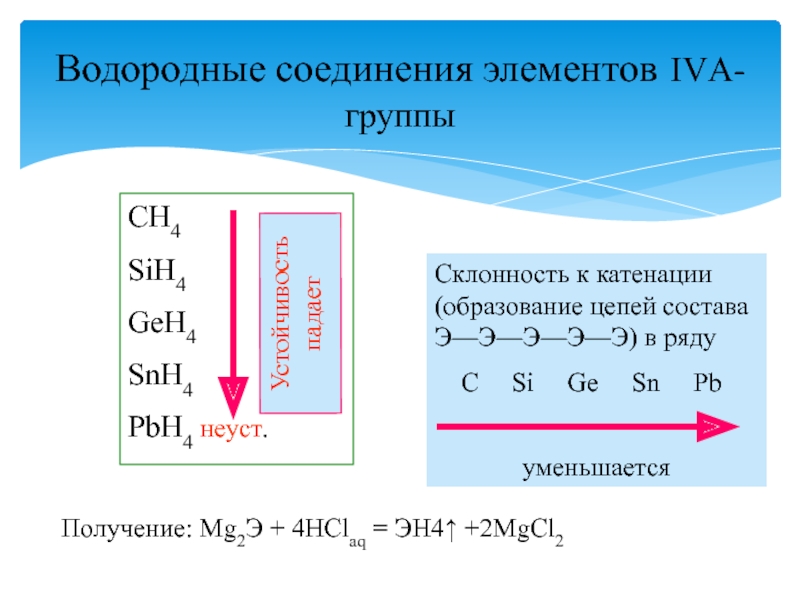
Слайд 26Водородные соединения элементов IVА-группы
СH4
SiH4
GeH4
SnH4
PbH4 неуст.
Склонность к катенации (образование цепей состава
Э—Э—Э—Э—Э) в ряду
C Si
Ge Sn Pb
Получение: Mg2Э + 4HClaq = ЭH4 +2MgCl2
Слайд 27Химические свойства
При комн. темп.
С, Si, Ge + H2O
С, Si,
Ge + H3O+
Sn, Pb + H2O
Sn + H3O+
Sn2+ + H2
Pb + H3O+ Pb2+ + H2
Слайд 28С(т) + KOH
Si + 4NaOH = Na4SiO4 + 2H2
Si
+ 8OH– –4e – = SiO44– + 4H2O
2H2O + 2e
– = H2 + 2OH–
Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Ge + 6OH– –4e – = [Ge(OH)6]2–
H2O2 + 2e – = 2OH–
Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2
Sn + 3OH– –2e – = [Sn(OH)3]–
2H2O + 2e – = H2 + 2OH–
Химические свойства
Слайд 29Простые вещества
ЭIVA
ЭГ2, ЭГ4 (Sn, Pb)
ЭO, ЭO2 (Sn, Pb)
ЭS, ЭS2
SiO44–
[Э(OH)3]– +
H2 (Sn, Pb)
Э2+ + H2 (Sn, Pb)
CO2, Pb2+, SnO2 ·
nH2O
Sn2+, Pb2+
Слайд 31Химическое растворение
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO
+ 8H2O
Si + 4NaOH = Na4SiO4 + 2H2
Получение кремния
SiO2 + 2Mg = 2MgO + Si
SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)
Кремний
Слайд 32Моносилан SiH4:
SiH4 + 2O2 = SiO2 + 2H2O
Получение силанов:
SiO2 + 4Mg(изб) = Mg2Si + 2MgO
(силицид магния)
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Mg2Si + 4H3O+ = 2Mg2+ + 4H2O + SiH4
Водородные соединения SinH2n+2 (силаны)
Видео: магниетермия и получение силана
Слайд 33Травление стекла
SiO2 + 4HF = SiF4 + 2H2O
SiO2 +
6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)
Слайд 34При подкислении водных растворов силикатов и германатов
SiO2 . nH2O (
n 300)
дикремниевая к-та H6Si2O7 трикремниевая к-та H6Si3O10, тетраметакремниевая
к-та (H2SiO3)4, полиметакремниевая к-та (H2SiO3)n
GeO2 . nH2O
H4SiO4 Kк 10–10
H2GeO3 Kк 10–9
Na4SiO4(р) + 2CO2 + 2H2O = H4SiO4 + 2Na2CO3
Na2CO3 + SiO2(т) = Na2SiO3(т) + CO2 (сплавление)
Слайд 35Особенности химии олова и свинца – см. записи устной лекционной
части
(без иллюстративного материала)







![Общая характеристика элементов IVA- группы. Углерод и кремний Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5].Монооксид углерода CO: C Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5].Монооксид углерода CO: C ::: O Обнаружение:PdCl2 + CO](/img/thumbs/1dfeb110f96b8dabb422d09753a466ba-800x.jpg)



![Общая характеристика элементов IVA- группы. Углерод и кремний M2Si2O6M2SiO4ОливинПироксенАмфиболПолевой шпат KAlSi3O8Мусковит (слюда) KAl2(AlSi3O10)(OH)2Кварц (SiO2)Структура плагиоклаза|Биотит M2Si4O10, M = Fe, MgCa-плагиоклаз: СaAl2Si2O8M7[Si4O12]2 Na-плагиоклаз: NaAlSi3O8 M2Si2O6M2SiO4ОливинПироксенАмфиболПолевой шпат KAlSi3O8Мусковит (слюда) KAl2(AlSi3O10)(OH)2Кварц (SiO2)Структура плагиоклаза|Биотит M2Si4O10, M = Fe, MgCa-плагиоклаз: СaAl2Si2O8M7[Si4O12]2 Na-плагиоклаз: NaAlSi3O8](/img/thumbs/9395692e9122fa1887fc959f479348d4-800x.jpg)





![Общая характеристика элементов IVA- группы. Углерод и кремний Простые веществаЭIVAЭГ2, ЭГ4 (Sn, Pb)ЭO, ЭO2 (Sn, Pb)ЭS, ЭS2SiO44–[Э(OH)3]– + H2 Простые веществаЭIVAЭГ2, ЭГ4 (Sn, Pb)ЭO, ЭO2 (Sn, Pb)ЭS, ЭS2SiO44–[Э(OH)3]– + H2 (Sn, Pb)Э2+ + H2 (Sn, Pb)CO2,](/img/thumbs/4e8c4bb3b5cd981895c1eb75e64fcdb5-800x.jpg)
![Общая характеристика элементов IVA- группы. Углерод и кремний Химическое растворение3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + Химическое растворение3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2OSi + 4NaOH = Na4SiO4 +](/img/thumbs/8df88be20d8dd6adc5c9ba1ef118d75c-800x.jpg)

![Общая характеристика элементов IVA- группы. Углерод и кремний Травление стекла SiO2 + 4HF = SiF4 + 2H2OSiO2 + 6HF Травление стекла SiO2 + 4HF = SiF4 + 2H2OSiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат](/img/thumbs/8d485e9e99945bb9e45c80833859b747-800x.jpg)