соединения, состоящие из катиона d-металла и лигандов, связанных электростатическим взаимодействием
(лиганды – ионы или диполи).2. Лиганды рассматриваются только как точечные заряды, являющиеся источником электростатического поля. Может учитываться радиус, но не структура.
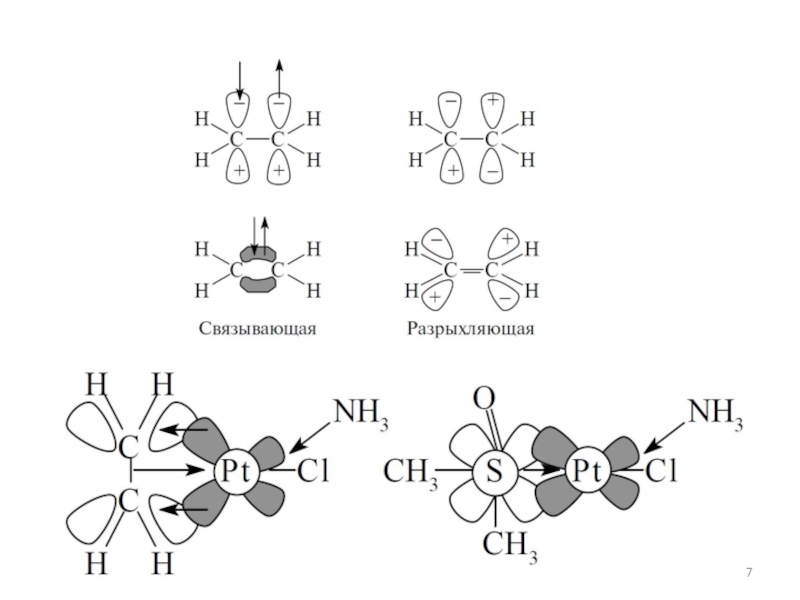
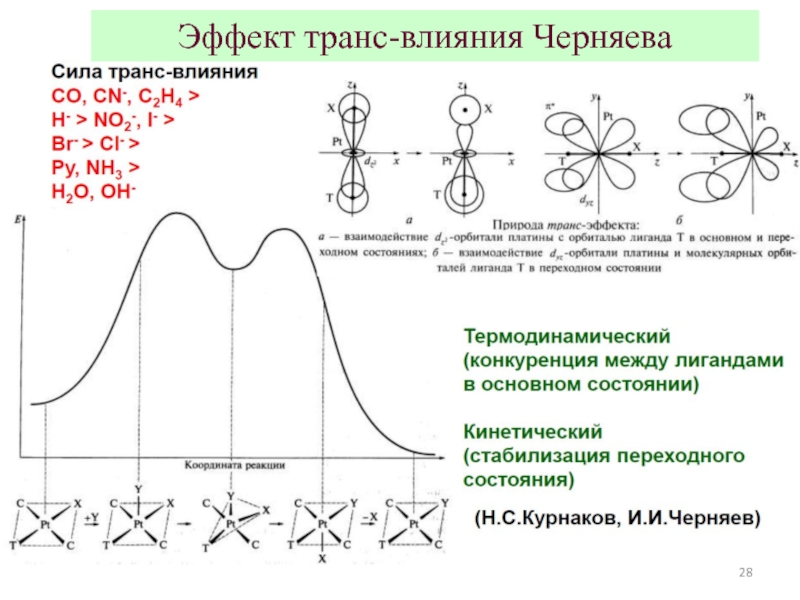
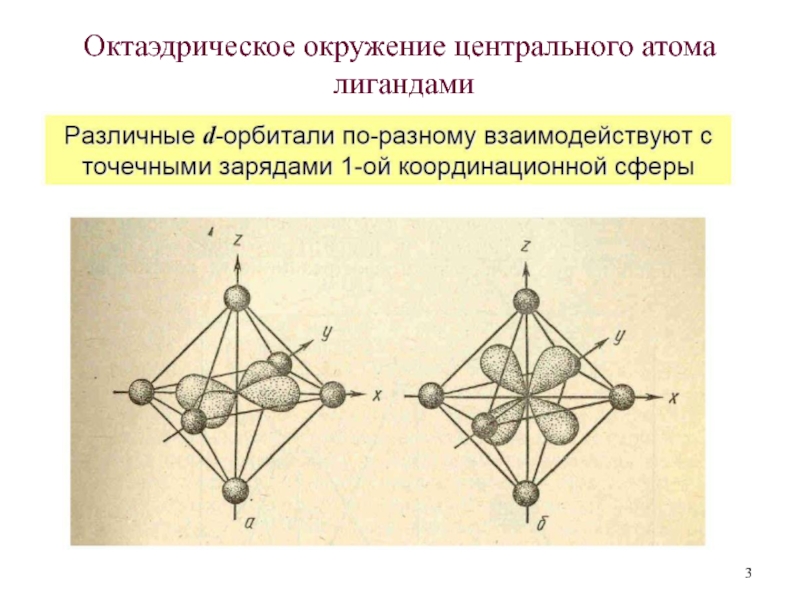
3.Взаимодействие центрального атома с лигандами рассматривается, напротив, подробно: с учетом всех особенностей d- (и f-) орбиталей центрального атома и распределения электронов на них.


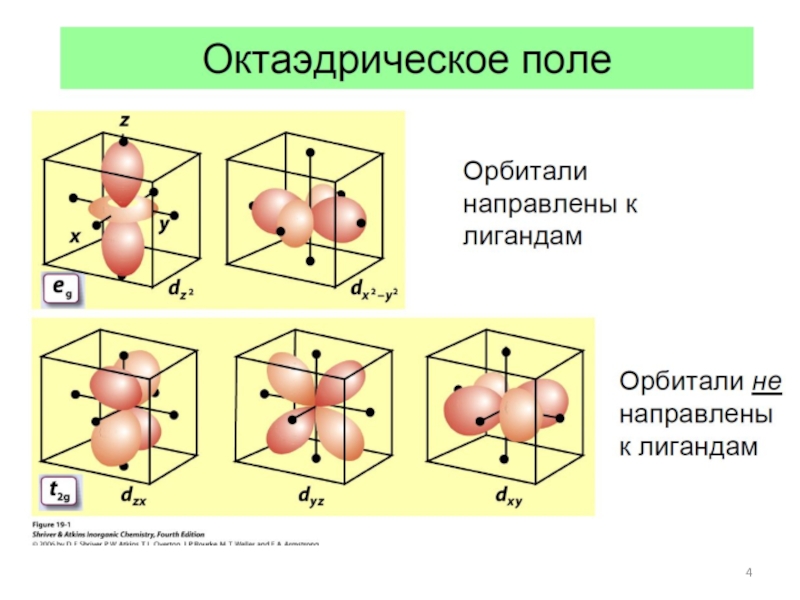
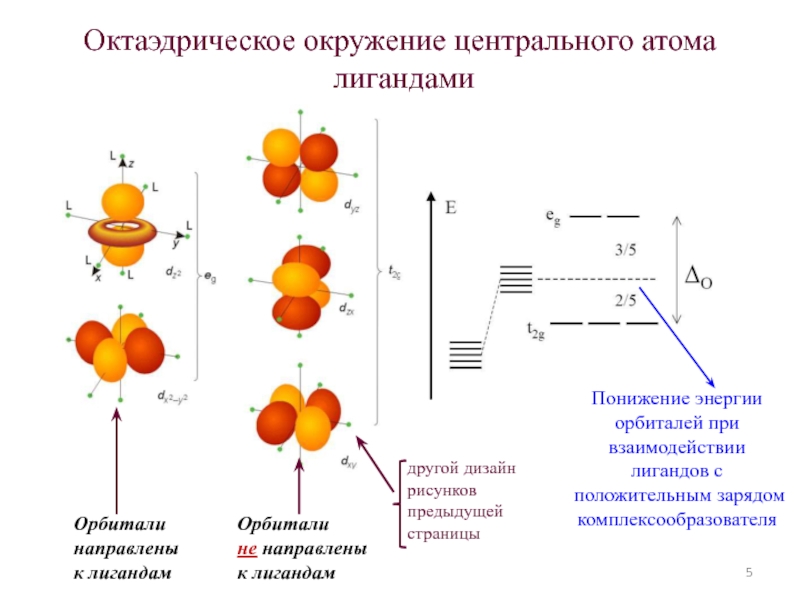
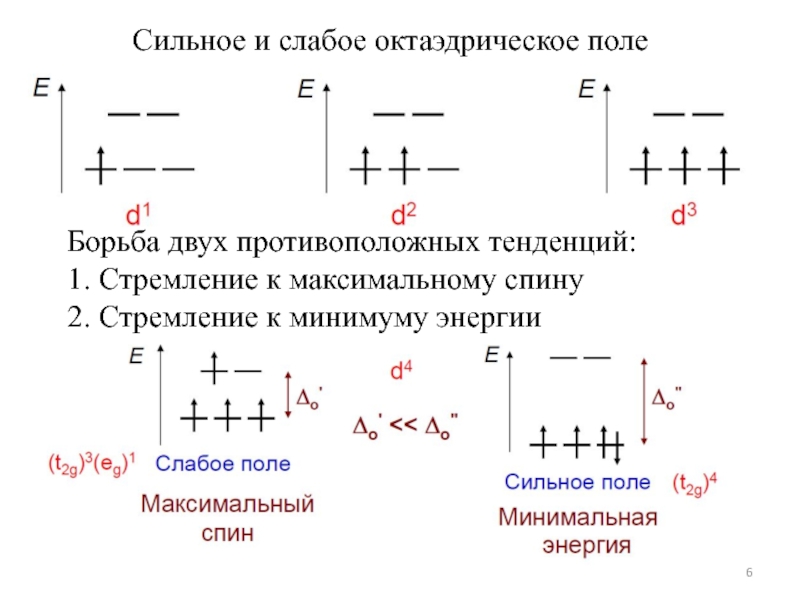
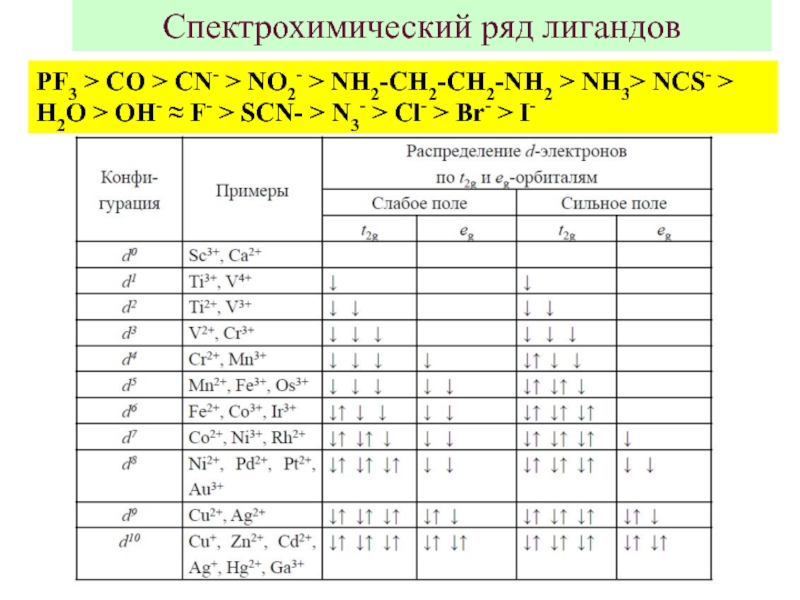
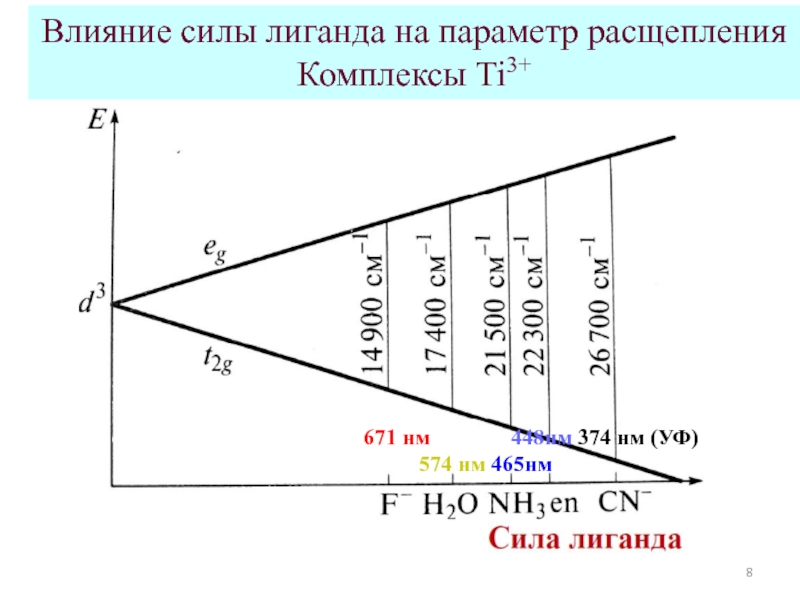

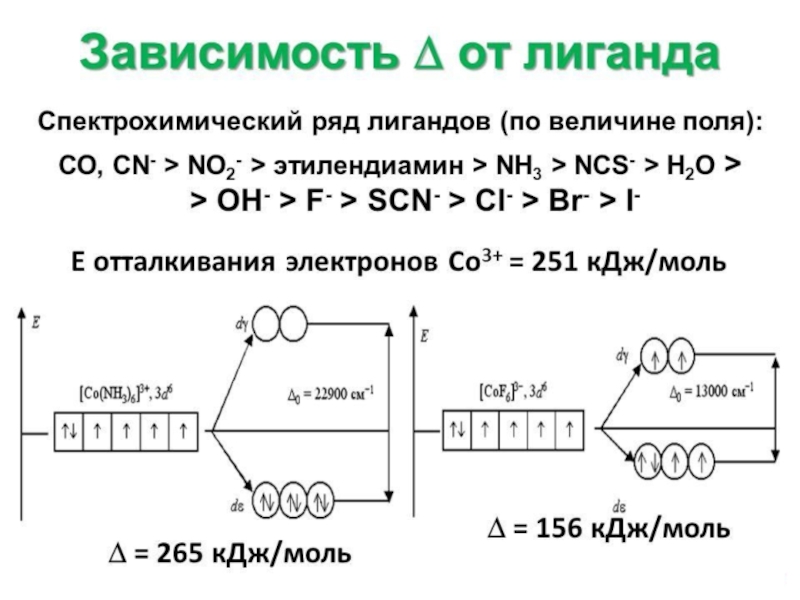
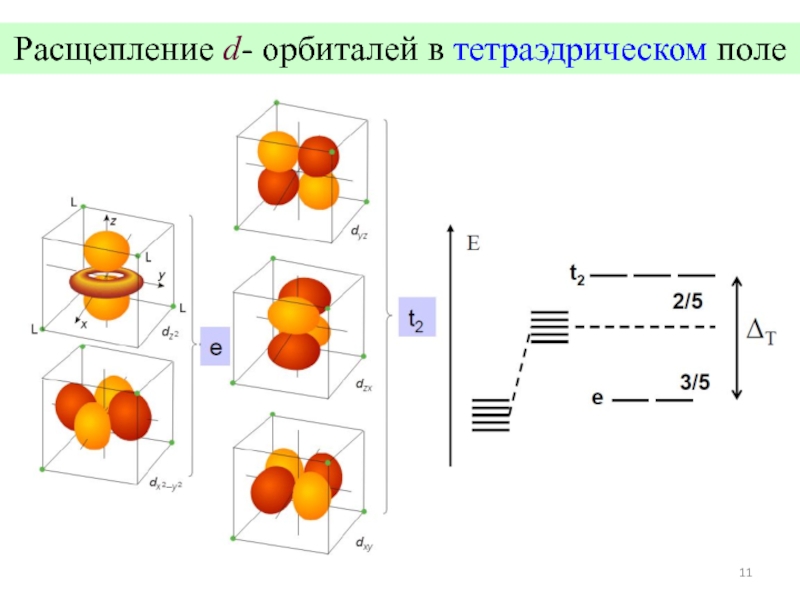
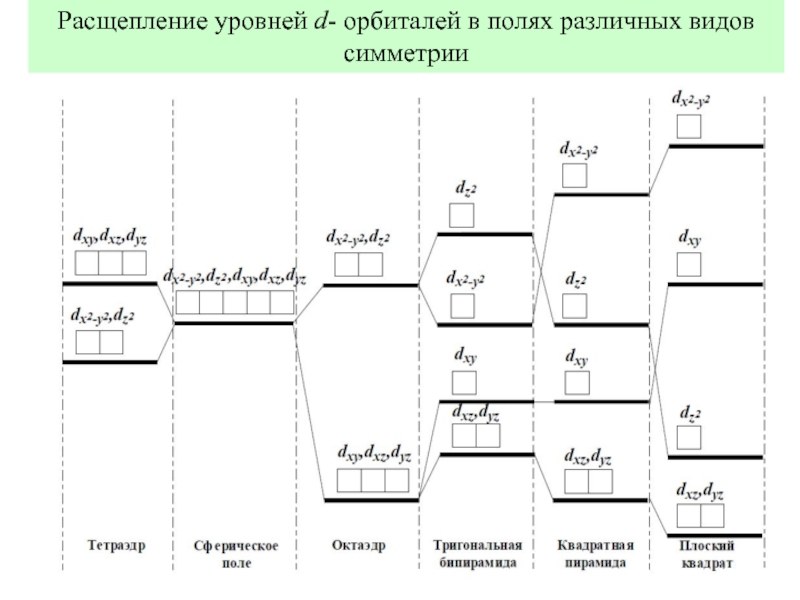
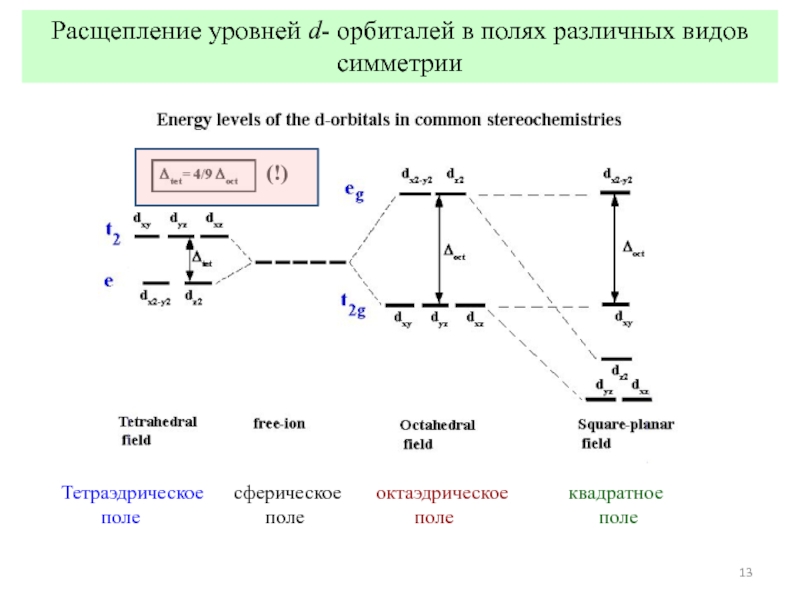
![Общие положения ТКП
ТКП – теория кристаллического поля (Бете, 1929)
1 ЭСКП в октаэдре: ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO – nспар.PΔO ЭСКП в октаэдре: ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO – nспар.PΔO – энергия расщепления октаэдрическим полемP –](/img/thumbs/337d384b648e63e8d11c04203fa65448-800x.jpg)

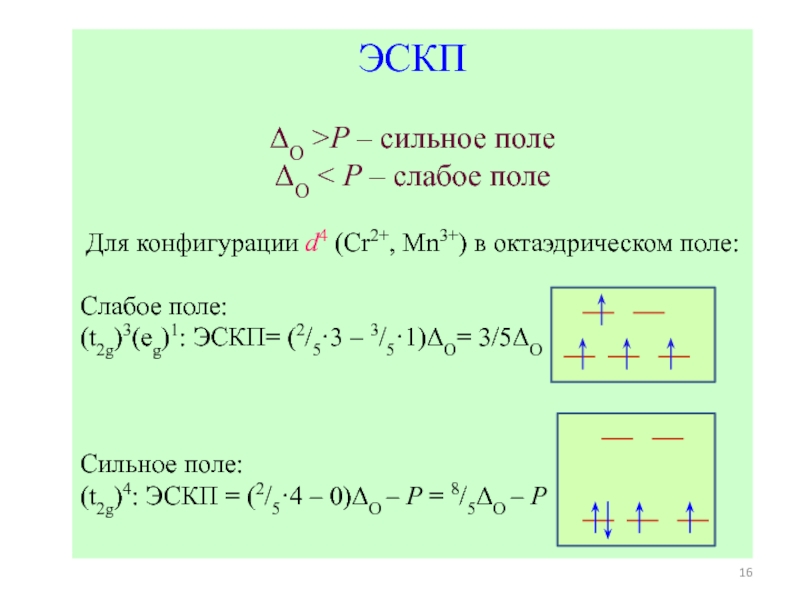


![Общие положения ТКП
ТКП – теория кристаллического поля (Бете, 1929)
1 Расщепление f- орбиталей в октаэдрическом поле (комплексы типа K3[Ln3+Cl6]; Ln = Расщепление f- орбиталей в октаэдрическом поле (комплексы типа K3[Ln3+Cl6]; Ln = Ce, Pr, …, Lu)Zbiri et al. , Chem. Phys.](/img/thumbs/712f62a3e23f71fba59315506c2449e0-800x.jpg)

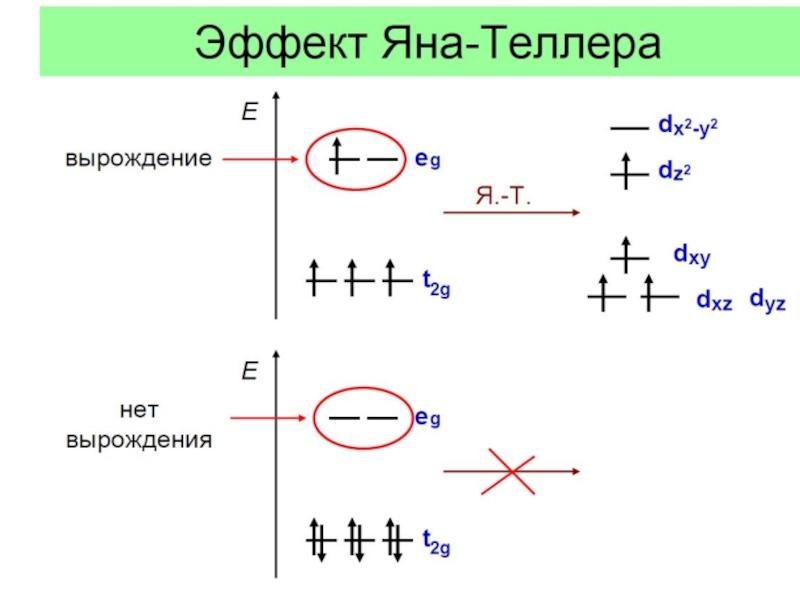
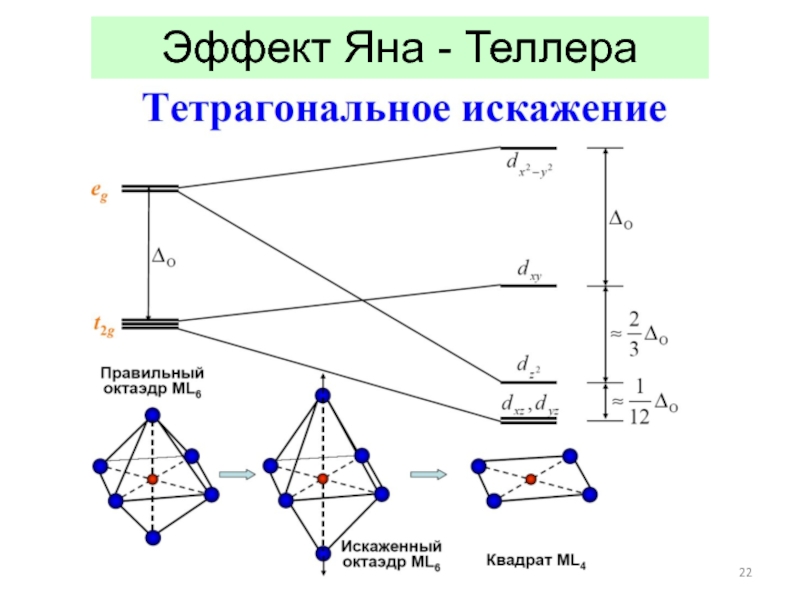
![Общие положения ТКП
ТКП – теория кристаллического поля (Бете, 1929)
1 Эффект Яна - ТеллераПример: соединения «1-2-3»типа NdBa2Cu3O6+d: правильнееBa2NdCu[O3Cu-CuO3+d] Эффект Яна - ТеллераПример: соединения «1-2-3»типа NdBa2Cu3O6+d: правильнееBa2NdCu[O3Cu-CuO3+d]](/img/thumbs/0a387b951b5f2e3abbc1828d05842c2b-800x.jpg)