Слайд 1Металлов много есть, но дело не в количестве:
В команде
работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не
пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком И каждым современным человеком.
Общие свойства металлов
Слайд 3Георг Агрикола (ученый XVI века) писал: Человек не может обойтись
без металлов….если бы не металлы человек влачил бы самую омерзительную
и жалкую жизнь среди диких зверей.
Ломоносов также посвятил металлам вдохновенные строки: металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы служат нам в уловлении земных и морских животных для пропитания нашего… и кратко сказать ни едино художество, ни едино ремесло простое употребление металлов миновать не может.
Слайд 4Общие физические свойства металлов
Металлический блеск
Слайд 5Общие физические свойства металлов
Электропроводность и теплопроводность
Слайд 6Общие физические свойства металлов
Пластичность
Слайд 7Общие физические свойства металлов
Твердость
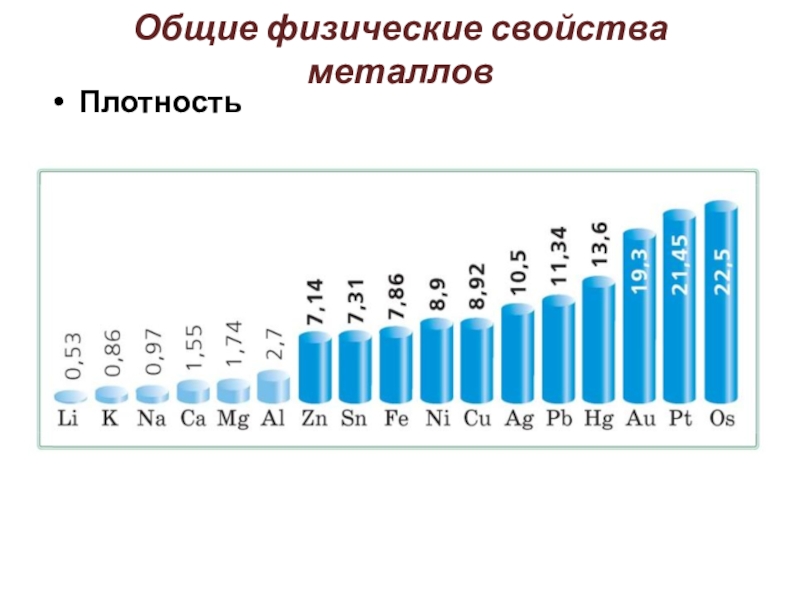
Слайд 8Общие физические свойства металлов
Плотность
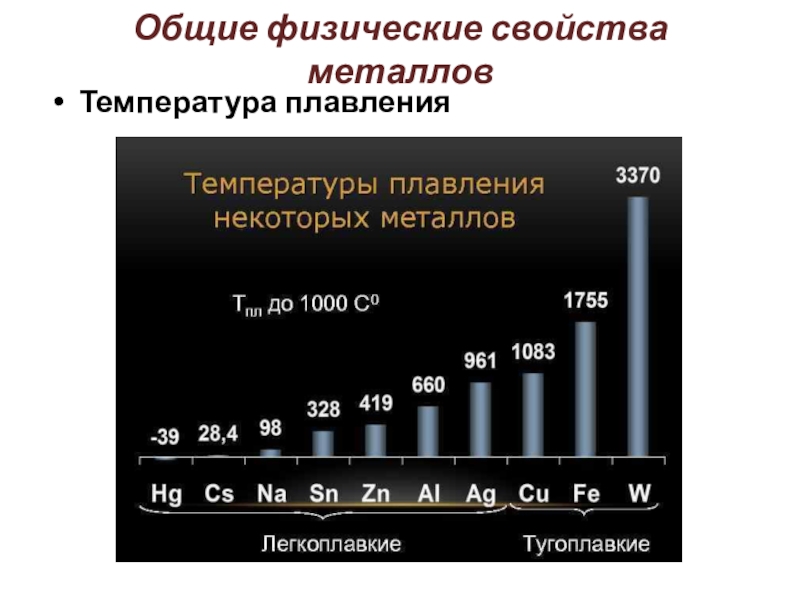
Слайд 9Общие физические свойства металлов
Температура плавления
Слайд 10Общие физические свойства металлов
Цвет
Слайд 11Строение металлов
В электронной оболочке атомов металлов на внешнем энергетическом уровне,
как правило, содержится от 1 до 3 электронов. Исключение составляют только металлы IVА, VА и VIА группы, у которых
на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
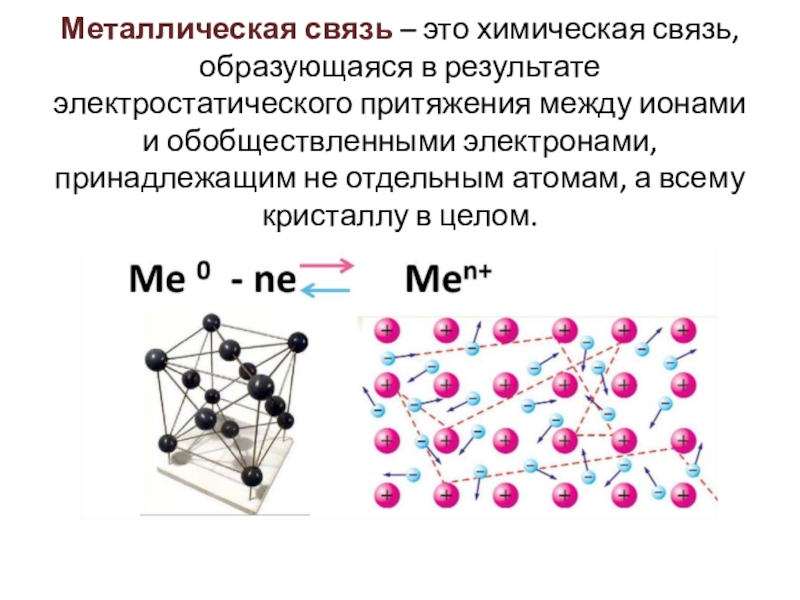
Слайд 12Металлическая связь – это химическая связь, образующаяся в результате электростатического
притяжения между ионами и обобществленными электронами, принадлежащим не отдельным атомам,
а всему кристаллу в целом.
Слайд 13Общие химические свойства металлов
Металл является более сильным восстановителем, чем он
стоит левее в периоде и ниже в главной подгруппе.
Восстановительная активность
металлов, в реакциях, протекающих в растворах веществ, зависит от места металла в электрохимическом ряду напряжений.
Слайд 14Общие химические свойства металлов
Химические реакции металлов с неметаллами (простыми веществами):
с водородом
металлы образуют гидриды:
2Na + H2 → 2NaH - гидрид натрия
с галогенами металлы образуют галогениды (соли):
Mg
+ Br2 → MgBr2 - бромид магния
с кислородом металлы образуют оксиды:
4Al + 3O2 → 2Ala2O3 - оксид алюминия
с серой металлы образуют сульфиды (соли):
Fe + S → FeS - сульфид железа
с углеродом металлы образуют карбиды:
Ca + 2C → CaC2 - карбид кальция
Слайд 15Общие химические свойства металлов
Химические реакции металлов с сложными веществами:
металлы от
лития до натрия (см. ряд напряжений) вытесняют водород при н.у.
с образованием щелочей:
2Na + 2H2O → 2NaOH + H2↑
металлы, стоящие левее водорода, реагируют с разбавленными кислотами с образованием солей и выделением водорода:
2Al + 6HCl → 2AlCl3 + 3H2↑
металлы реагируют с растворами солей менее активных металлов, восстанавливая при этом менее активный металл, с образованием соли более активного металла:
Fe + CuSO4 → FeSO4 + Cu
Слайд 16Металлы в природе
В свободном виде в природе присутствуют наименее активные
металлы, встречаются они в виде так называемых самородков (кто не мечтает найти
самородок золота). Так уж сложилось, что количество таких металлов на земле не так уж и много, поэтому, их еще называют драгоценными металлами - это золото, серебро, платина.
Слайд 17Металлы в природе
Остальные металлы, не имеющие "благородного" происхождения, т.к. являются
достаточно активными, чтобы вступать во взаимодействие с другими веществами, в
природе присутствуют в разнообразных соединениях - сульфидах, сульфатах, оксидах, хлоридах, нитратах, фосфатах и проч.
Слайд 18Получение металлов
Любой современный металлургический процесс заключается в восстановлении ионов металла, с
получением на выходе металла в свободном виде.
Разновидности металлургических процессов:
Пирометаллургия - получение
металлов из их руд при помощи различных восстановителей при высоких температурах:
FeO + C → Fe + CO
Cr2O3 + 2Al → Al2O3 + 2Cr
Слайд 19Получение металлов
Гидрометаллургия - получение металлов из раствора соли металла путем вытеснения
более активным металлом:
на первом этапе оксид металла растворяют в кислоте
с целью получения раствора соли металла:
CuO + H2SO4 → CuSO4+H2O
на втором этапе из полученного раствора более активным металлом вытесняют "нужный" металл:
CuSO4 + Fe → FeSO4 + Cu
Слайд 20Получение металлов
Электрометаллургия - получение металлов электролизом растворов (расплавов) их соединений (роль
восстановителя выполняет электрический ток).
Слайд 213. С какими из перечисленных веществ: О2, S, Cl2, Н2,
Н2O, NaOH, H2SO4, CuSO4, КСl — реагирует кальций? Запишите уравнения
химических реакций. Укажите окислитель и восстановитель.
Ca0 + S0 → Ca+2 S-2
в. о.
Ca0 + Cl20 → Сa+2Cl2-1
в. о.
Ca0 + H2+1SO4 → Ca+2SO4 + H20
в. о.
Слайд 224. Напишите уравнения химических реакций, с помощью которых можно осуществить
следующие превращения:
+О2 +H2O
+CO2 +CO2 t
Са → X → Са(ОН)2 → Y → Са(НСO3)2 → СаСО3
Укажите условия протекания этих реакций.
Х – СаО
Y – СаСО3
Слайд 235. Допишите сокращённые ионные уравнения химических реакций.
2Al + 6H+ →
2Al
+ 6H+ → 2Al3+ + 3H2
2Al + 6HCl → 2AlCl3
+ 3H2
Слайд 2410. Вычислите массу углерода, необходимую для полного восстановления 200 кг
железной руды — оксида железа (III), с массовой долей не
содержащих железо примесей, равной 10%.
2Fe2O3 + 3C = 4Fe + 3CO2
Определить массу чистого оксида
m = 200 ∙ 0,9
2. Определить количество вещества оксида
n = m : M
3. Определить количество вещества и массу углерода