Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие закономерности реакционной способности органических соединений как
Содержание
- 1. Общие закономерности реакционной способности органических соединений как
- 2. Радикальное замещение у насыщенного атома углерода, SR у C sp3 .
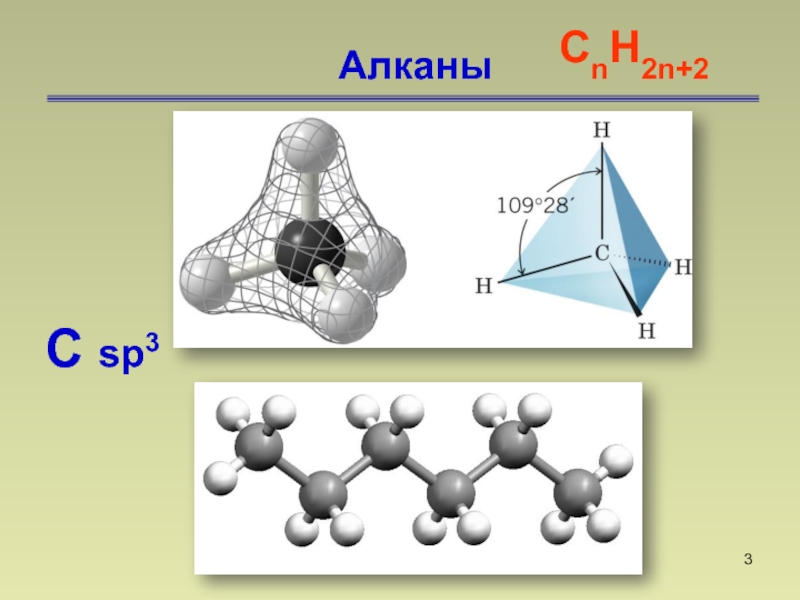
- 3. АлканыСnН2n+2 C sp3
- 4. Алканы. Е связи С-С
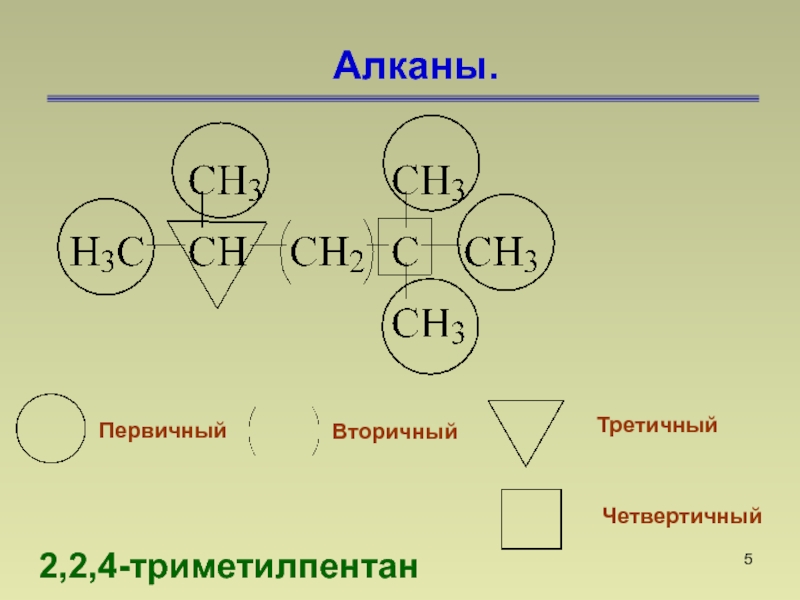
- 5. Алканы. 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
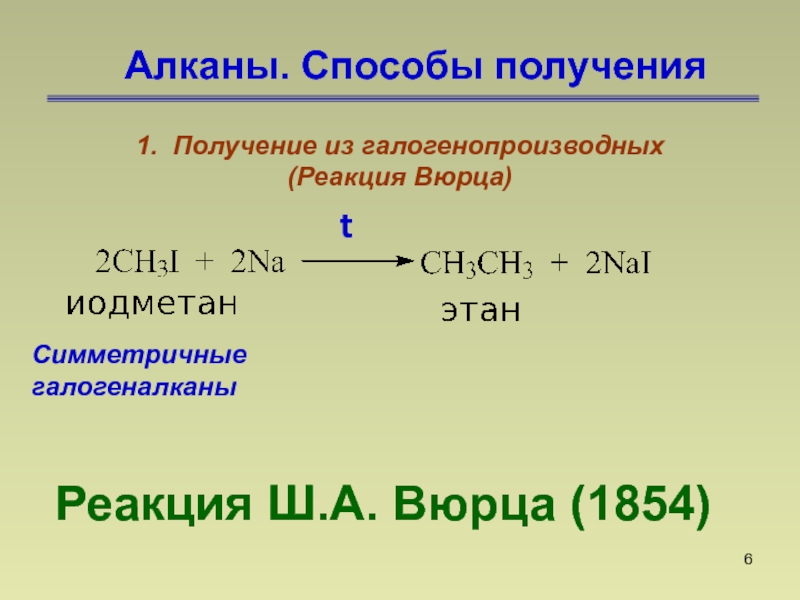
- 6. Алканы. Способы полученияРеакция Ш.А. Вюрца (1854) t1. Получение из галогенопроизводных (Реакция Вюрца) Симметричные галогеналканы
- 7. ВЮРЦ (Wurtz), Шарль Адольф 1817 г. –1884 г. Французский химик-органик и педагог
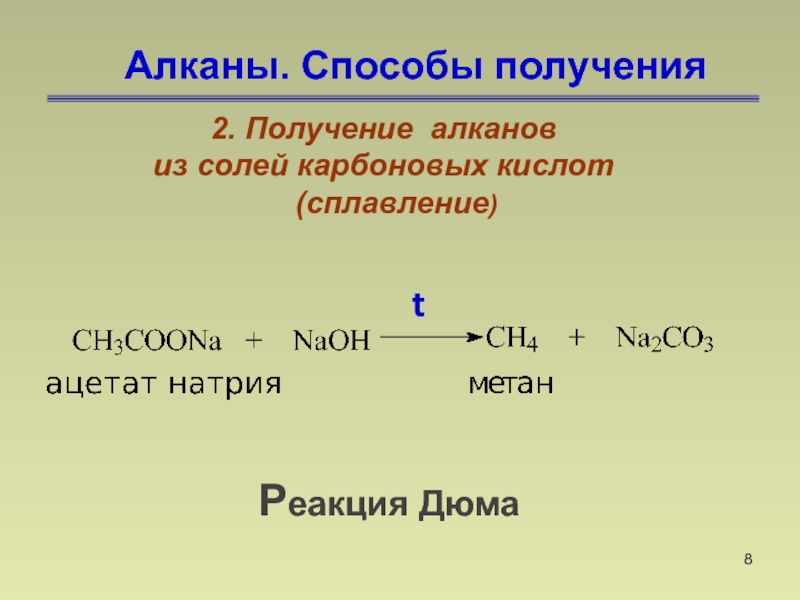
- 8. Алканы. Способы получения2. Получение алканов из солей карбоновых кислот (сплавление)Реакция Дюмаt
- 9. 3. Электролиз солей щелочных металлов и карбоновых кислот (реакция Кольбе) 1849 г.
- 10. Адольф Вильгельм Герман Кольбе
- 11. Гомолитическое замещение, SR.
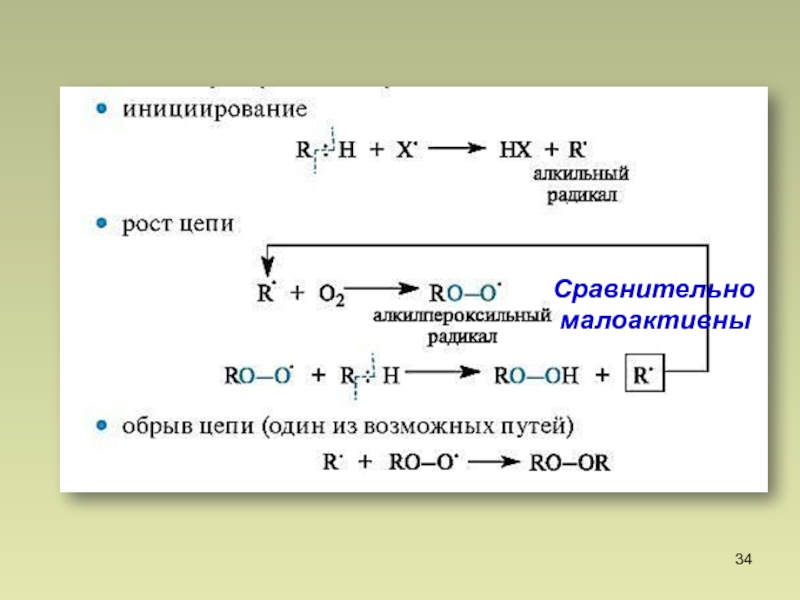
- 12. Алканы. Химические свойства 1. Галогенирование I. Инициирование гомолизМеханизм реакции
- 13. Инициирование радикальных реакций :термолиз (> 300
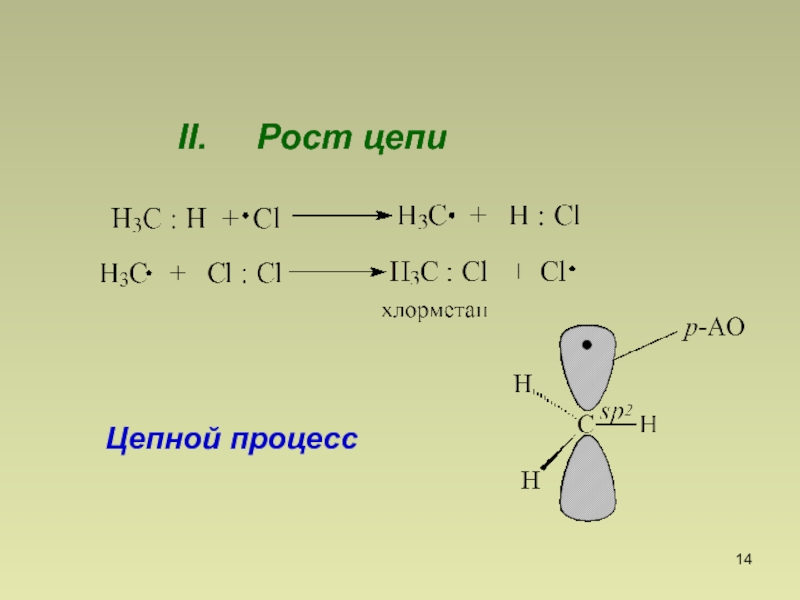
- 14. II. Рост цепи Цепной процесс
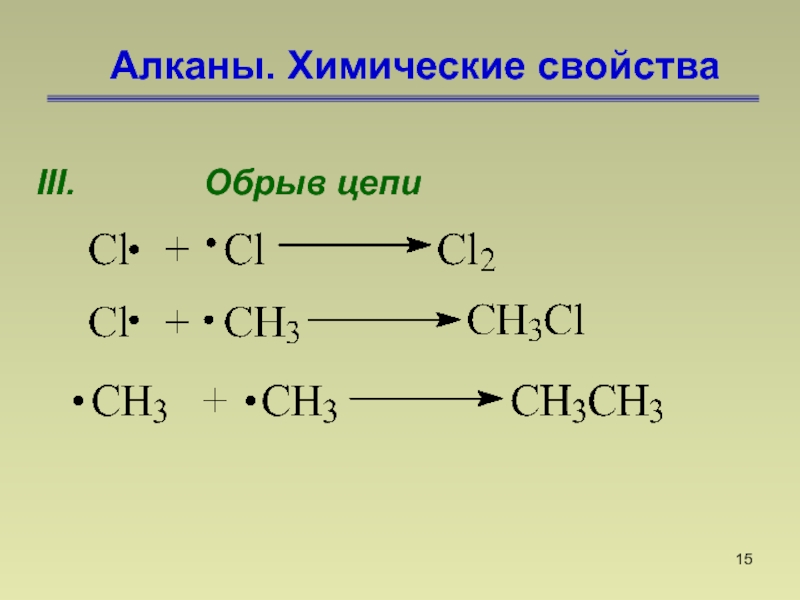
- 15. Алканы. Химические свойстваIII. Обрыв цепи
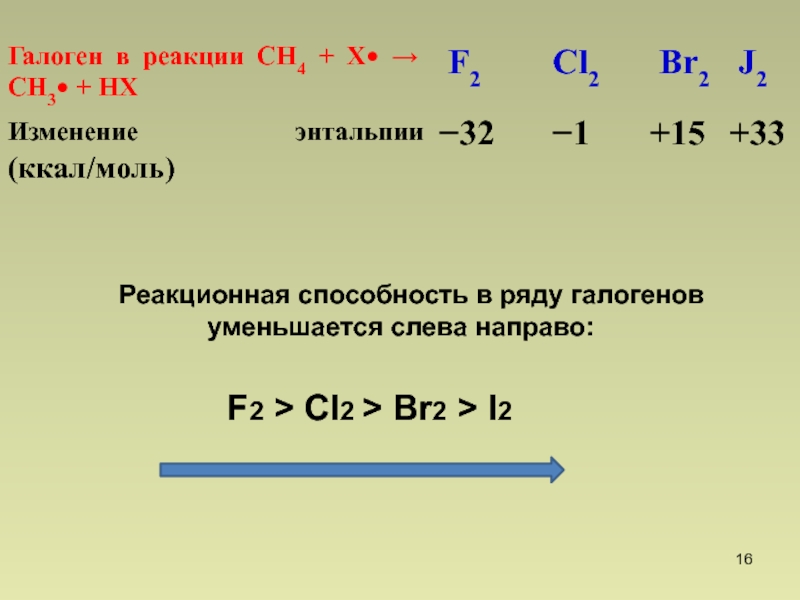
- 16. Реакционная способность в
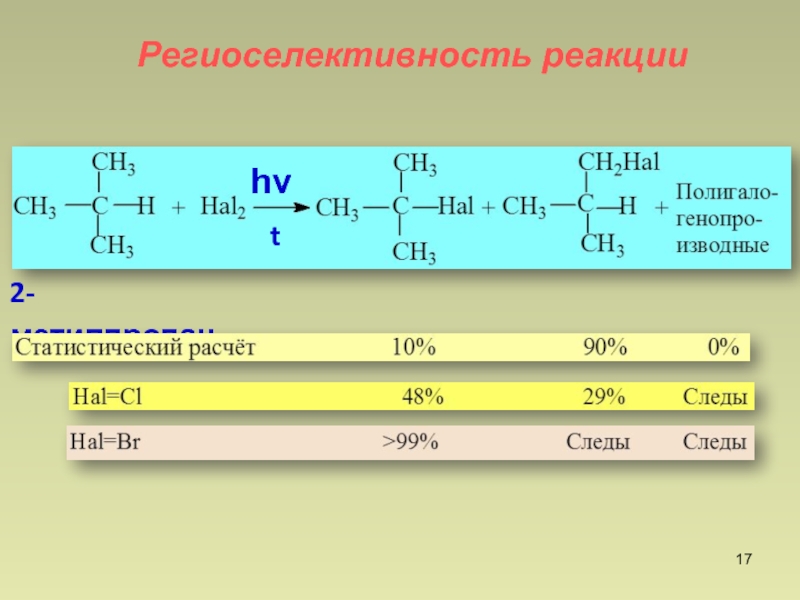
- 17. 2-метилпропанРегиоселективность реакцииһνt
- 18. Слайд 18
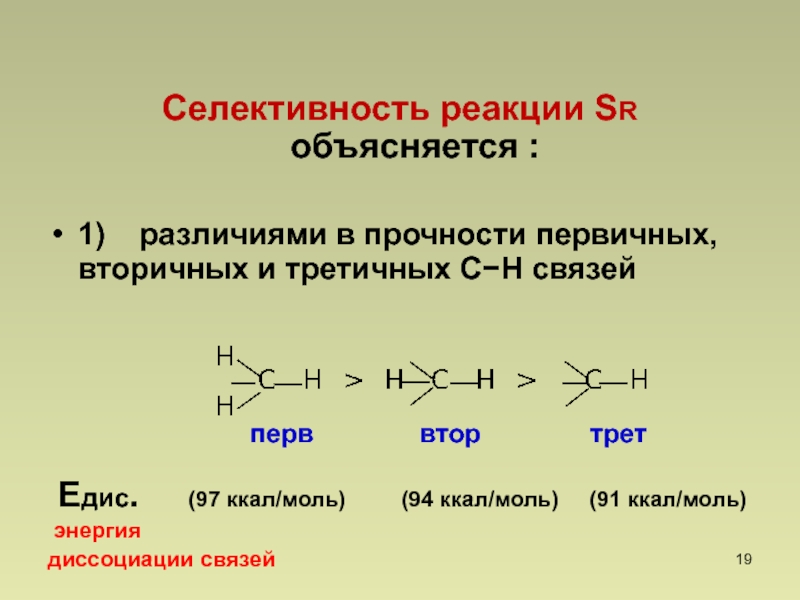
- 19. Селективность реакции SR объясняется :1) различиями
- 20. 2. образованием наиболее стабильного промежуточного свободного радикалаСтабильность радикалов:
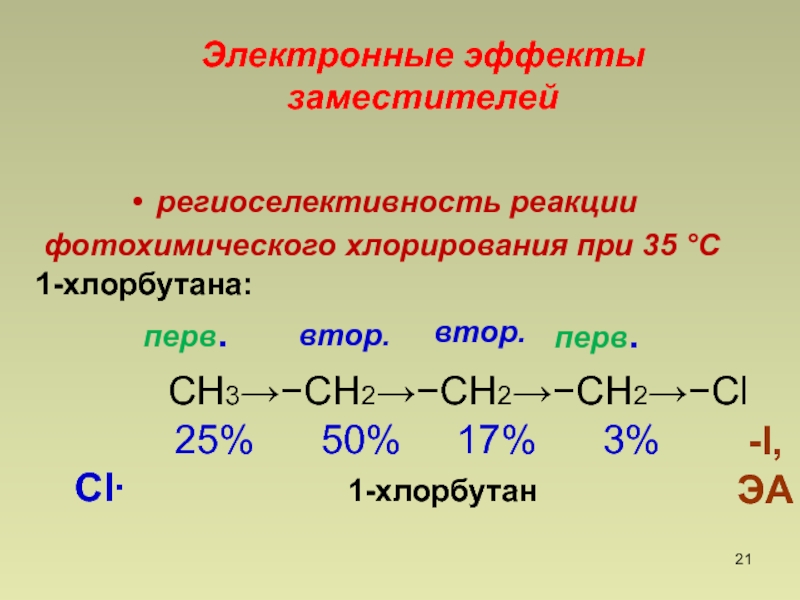
- 21. региоселективность реакции фотохимического хлорирования при 35 ССН3СН2СН2СН2Cl
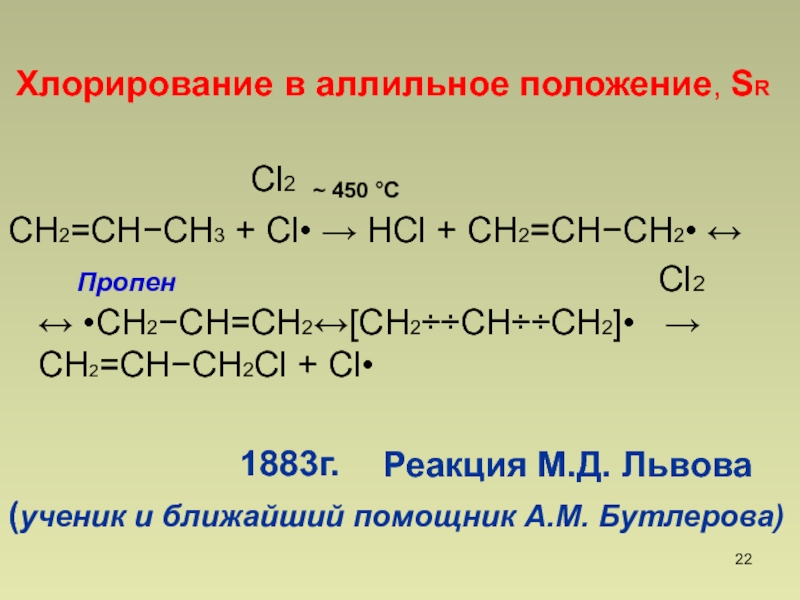
- 22. СН2=СНСН3 + Cl• НCl + СН2=СНСН2•
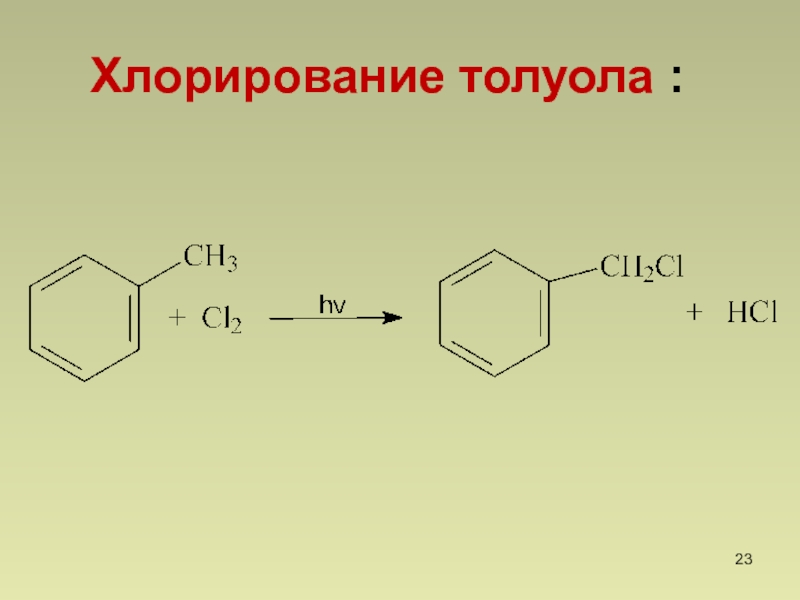
- 23. Хлорирование толуола :
- 24. Избирательное замещение в -положение (аллильное положение) к двойной связи:
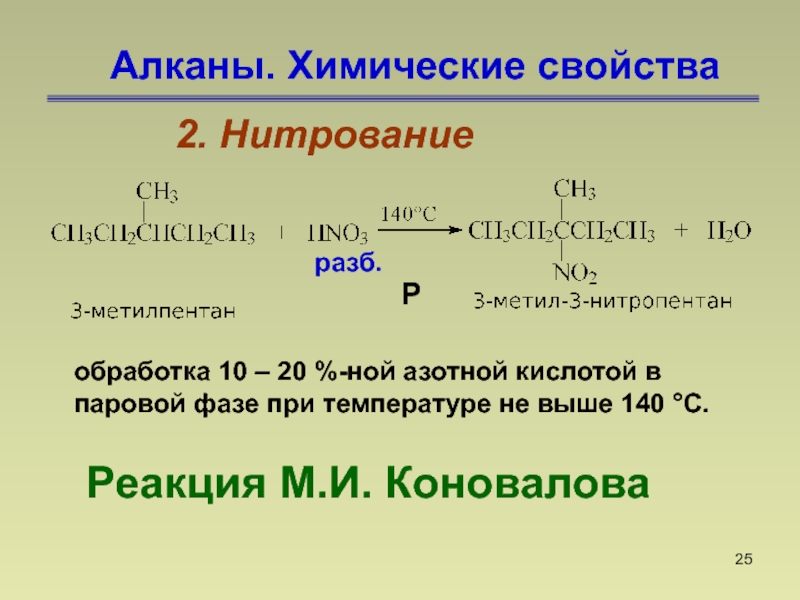
- 25. Алканы. Химические свойства2. Нитрование Реакция М.И. Коноваловаобработка
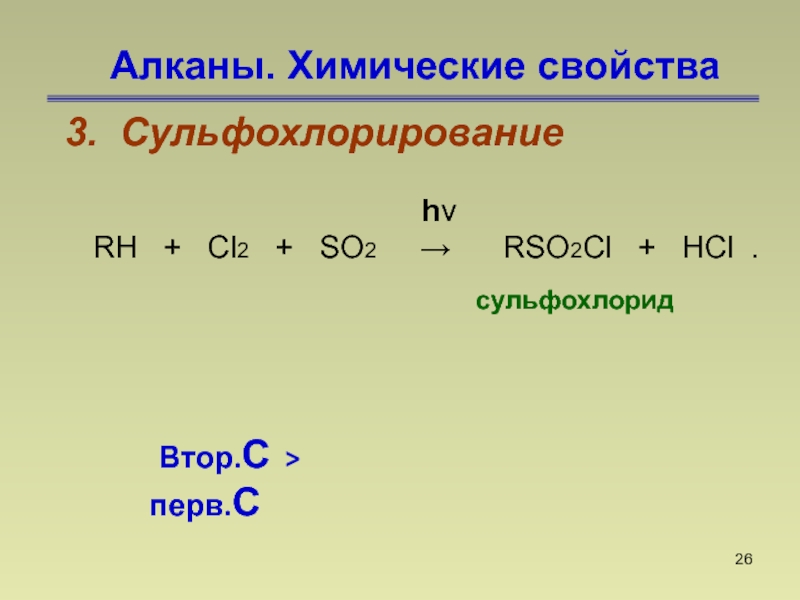
- 26. Алканы. Химические свойства3. Сульфохлорирование сульфохлорид hνRH
- 27. Реакция
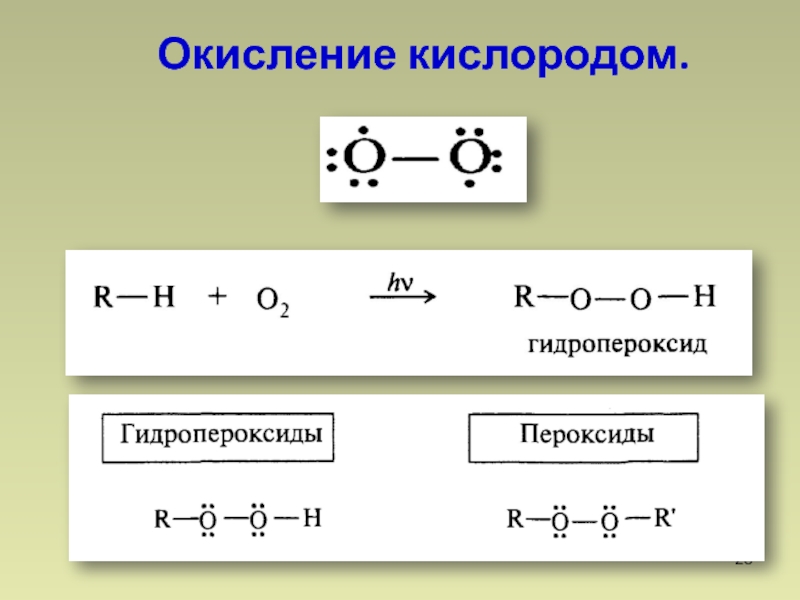
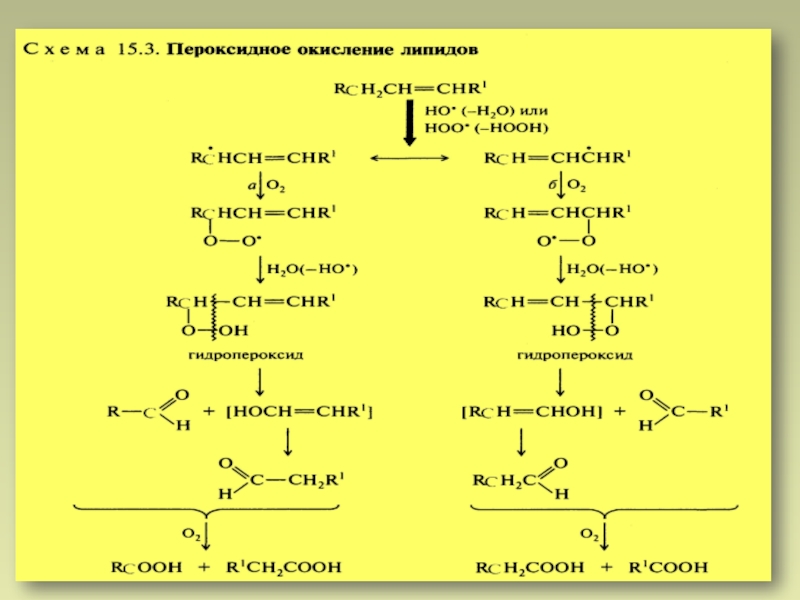
- 28. Окисление кислородом.
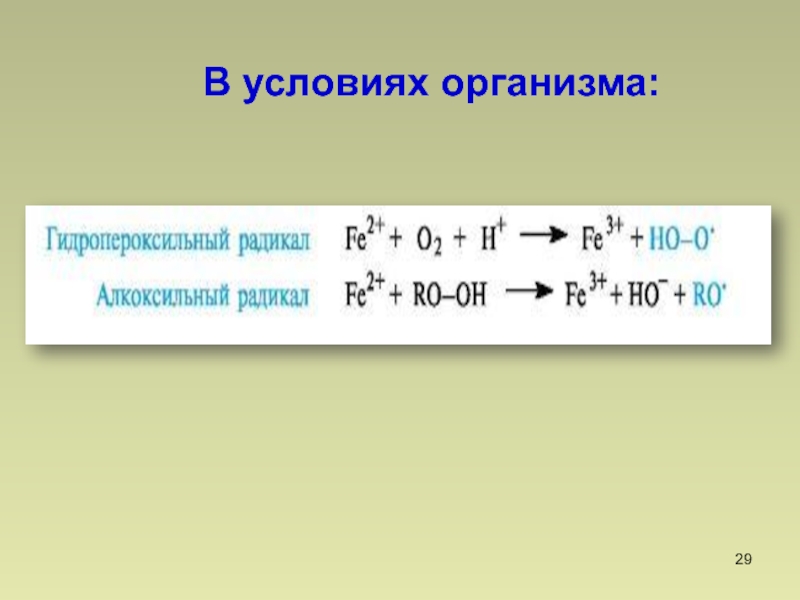
- 29. В условиях организма:
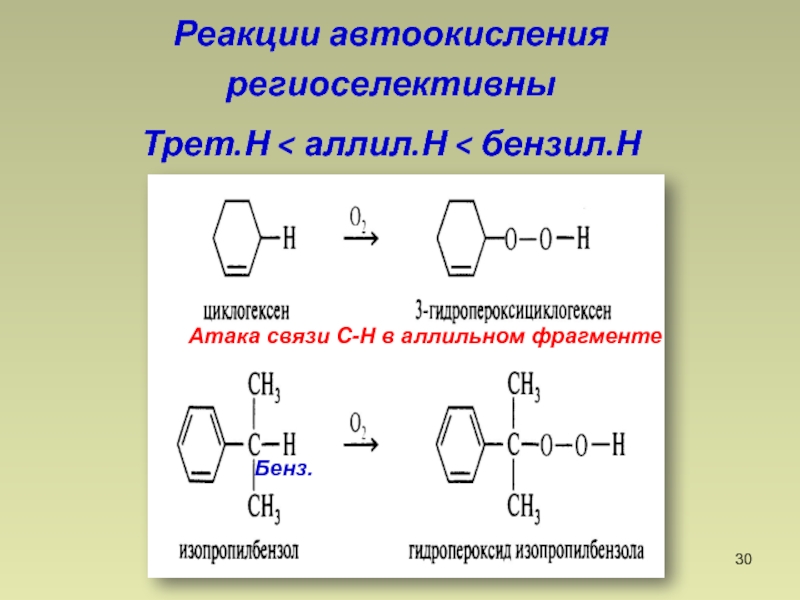
- 30. Реакции автоокисления региоселективныТрет.Н < аллил.Н < бензил.НАтака связи С-Н в аллильном фрагментеБенз.
- 31. Проба с раствором KI в разбавленной уксусной
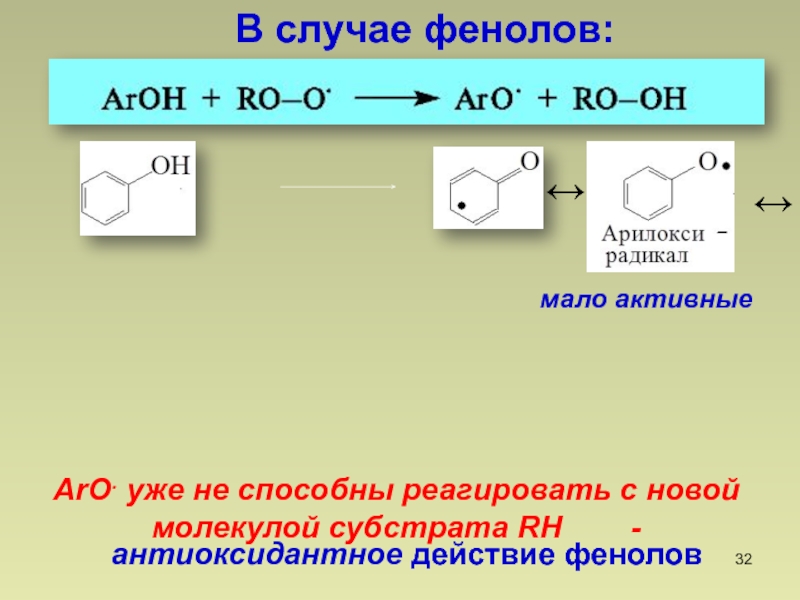
- 32. мало активныеВ случае фенолов:ArO. уже не способны
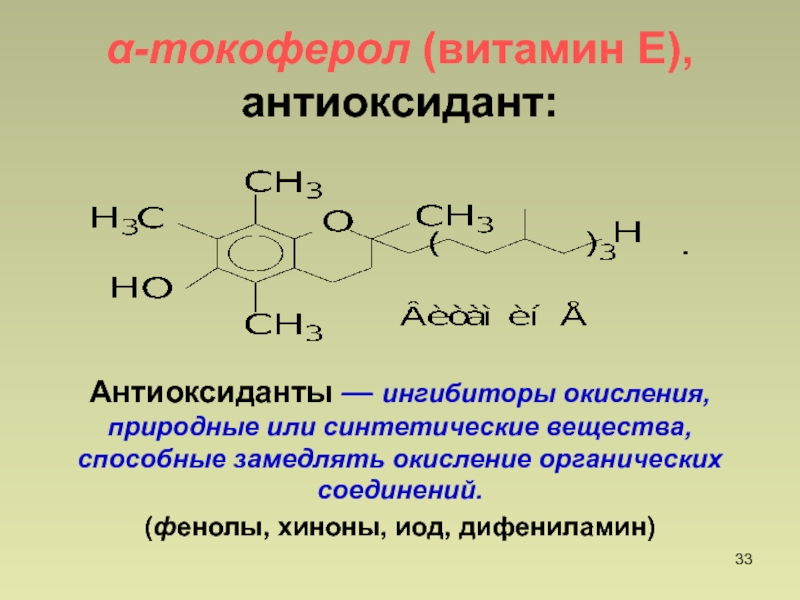
- 33. -токоферол (витамин Е), антиоксидант:Антиоксиданты — ингибиторы окисления,
- 34. Сравнительно малоактивны
- 35. Слайд 35
- 36. Спасибо за Ваше внимание!
- 37. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Общие закономерности реакционной способности органических соединений как
химическая основа их биологического функционирования.
Слайд 4Алканы.
Е связи С-С 83 ккал/моль
σ
неполярные Csp3-
Csp3 и
практически неполярные Csp3- H σ-связи
этан
Е связи С-Н
97 ккал/мольСлайд 6Алканы. Способы получения
Реакция Ш.А. Вюрца (1854)
t
1. Получение из галогенопроизводных
(Реакция Вюрца)
Симметричные галогеналканы
Слайд 8Алканы. Способы получения
2. Получение алканов
из солей карбоновых кислот
(сплавление)
Реакция Дюма
t
Слайд 10Адольф Вильгельм Герман Кольбе (Adolph Wilhelm
Hermann Kolbe)
немецкий
химик-органик
1818 г. – 1884 г.
Слайд 13Инициирование радикальных реакций :
термолиз (> 300 С)
фотолиз
(лучистая энергия, кванты света h)
3) химическое инициирование
Веществa, достаточно
легко генерирующие свободные радикалы:Pb(C2H5)4 Pb + C2H5 •
Тетраэтилат свинца
Cl • • Cl + C2H5 • Cl • + C2H5Cl
Слайд 18
трет. Н : втор.Н :
перв.НБром 1600 : 82 : 1
Хлор 5.0 : 3.8 : 1
Br2 менее реакционноспособен, чем Cl2 и поэтому более селективен !
Слайд 19Селективность реакции SR объясняется :
1) различиями в прочности первичных,
вторичных и третичных СН связей
Едис.
(97 ккал/моль) (94 ккал/моль) (91 ккал/моль)энергия
диссоциации связей
перв
втор
трет
Слайд 202. образованием наиболее стабильного промежуточного свободного радикала
Стабильность радикалов:
Слайд 21региоселективность реакции
фотохимического хлорирования при 35 С
СН3СН2СН2СН2Cl
25% 50%
17% 3%Cl 1-хлорбутан
Электронные эффекты заместителей
-I,
ЭА
перв.
перв.
втор.
втор.
1-хлорбутана:
Слайд 22СН2=СНСН3 + Cl• НCl + СН2=СНСН2•
Пропен
Cl2 •СН2СН=СН2СН2СНСН2• СН2=СНСН2Cl + Cl•Реакция М.Д. Львова
(ученик и ближайший помощник А.М. Бутлерова)
Хлорирование в аллильное положение, SR
450 С
Cl2
1883г.
Слайд 25Алканы. Химические свойства
2. Нитрование
Реакция М.И. Коновалова
обработка 10 – 20
%-ной азотной кислотой в паровой фазе при температуре не выше
140 °С.разб.
Р
Слайд 26Алканы. Химические свойства
3. Сульфохлорирование
сульфохлорид
hν
RH +
Cl2 + SO2 →
RSO2Cl + HCl . Втор.С > перв.С