Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно –восстановительные Реакции
Содержание
- 1. Окислительно –восстановительные Реакции
- 2. Вспомним …1.Валентность.2.Степень окисления.3.Восстановитель.4.Окислитель.5.Типы химических реакций.
- 3. Окислительно –восстановительные Реакции
- 4. Цель урока:1.Сформировать понятие об окислительно-восстановительных реакциях.2.Научиться уравнивать записи ОВР методом электронного баланса.
- 5. Пример:2Cu0 + O2 =2 Cu2+O2-2H+CL- + Zn0
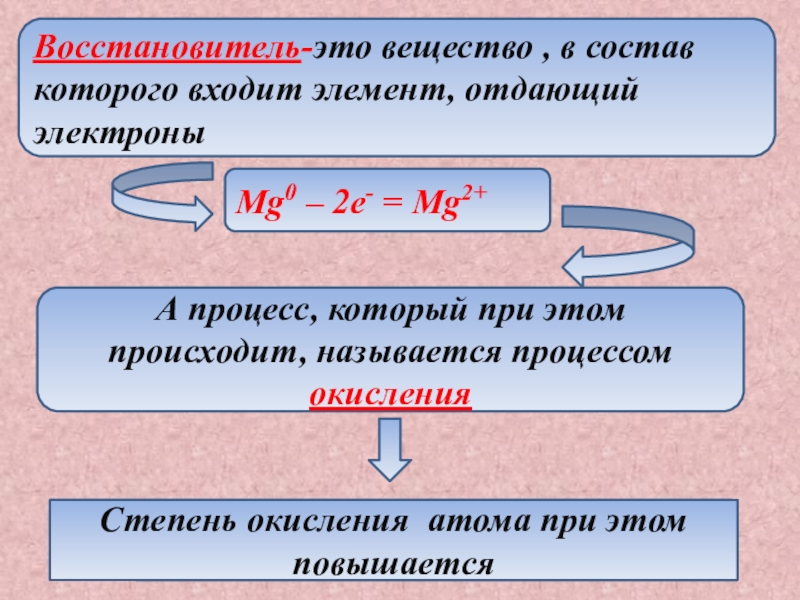
- 6. Восстановитель-это вещество , в состав которого входит
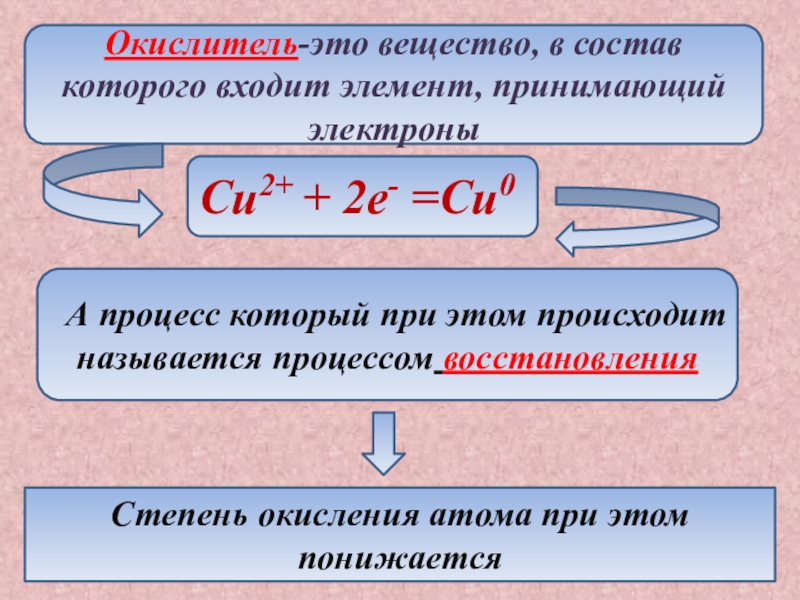
- 7. Окислитель-это вещество, в состав которого входит элемент,
- 8. Слайд 8
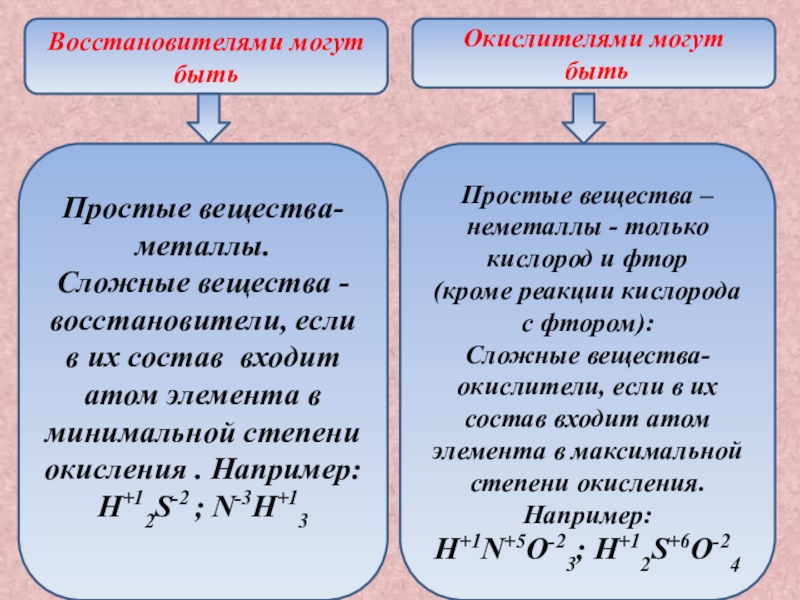
- 9. Восстановителями могут бытьОкислителями могут быть Простые вещества-металлы.Сложные
- 10. Различают:минимальную (низшую) степень окисления
- 11. План составления окислительно -восстановительной реакцииЗаписываем схему химической
- 12. 5. Ca0– 2e-=Ca2+ O20
- 13. Используя метод электронного баланса, допишите схемы и
- 14. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Вспомним …
1.Валентность.
2.Степень окисления.
3.Восстановитель.
4.Окислитель.
5.Типы химических реакций.
Слайд 4Цель урока:
1.Сформировать понятие об окислительно-восстановительных реакциях.
2.Научиться уравнивать записи ОВР
методом
электронного баланса.
Слайд 5Пример:
2Cu0 + O2 =2 Cu2+O2-
2H+CL- + Zn0 = Zn2+CL2- +
H20
Реакции, в резултате которых изменяются степени окисления атомов всех или
некоторых элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.Слайд 6Восстановитель-это вещество , в состав которого входит элемент, отдающий электроны
Mg0
– 2e- = Mg2+
А процесс, который при этом происходит, называется
процессом окисленияСтепень окисления атома при этом повышается
Слайд 7Окислитель-это вещество, в состав которого входит элемент, принимающий электроны
Cu2+ +
2e- =Cu0
А процесс который при этом происходит называется процессом
восстановленияСтепень окисления атома при этом понижается
Слайд 9Восстановителями могут быть
Окислителями могут
быть
Простые вещества-металлы.
Сложные вещества - восстановители,
если в их состав входит атом элемента в минимальной степени
окисления . Например:H+12S-2 ; N-3H+13
Простые вещества –неметаллы - только кислород и фтор
(кроме реакции кислорода с фтором):
Сложные вещества-окислители, если в их состав входит атом элемента в максимальной степени окисления. Например:
H+1N+5O-23; H+12S+6O-24
Слайд 10Различают:
минимальную (низшую) степень окисления
S-2 2e-
8e- 8e-
промежуточную степень окисления
S0 2e- 8e- 6e-
максимальную (высшую) степень окисления
S+6 2e- 8e- 0e-в минимальной степени окисления, може
Атом, находящийся т быть только восстановителем.
S-2 -2е = S0 S-2- 6е = S+4 S-2-8е = S+6
Атом, находящийся в максимальной степени окисления, может быть только окислителем.
S+6 +2е = S+4 S+6+ 6е = S0 S+6- 8е =S-2
Атом, находящийся в промежуточной степени окисления может быть как восстановителем, так и окислителем.
S0 +2е = S-2 S0 - 4е = S+4
Слайд 11План составления окислительно -восстановительной реакции
Записываем схему химической реакции
Ca + O2
2. Расставляем степени окисления атомов,
участвующих в
химической реакцииCa0 + O20 Ca2+O2-
3.Находим атомы, которые изменяют свою
степень окисления
Ca0 и O20
Далее
Слайд 125. Ca0– 2e-=Ca2+
O20 + 4e- =
2O2-
4
2
2
1
восстановитель
окислитель
6. Расставляем цифры, полученные в электронном балансе в химическое
уравнение 2Ca + O2= 2CaO
4.Составляем электронный баланс,записывая
процесс отдачи и присоединения электронов
Ca0 – 2e- = Ca2+
O20 + 4e- = 2O2-
Слайд 13Используя метод электронного баланса, допишите схемы и составьте уравнения,
расставив коэффициенты
Mg + O2
HCL + Zn
SO2 + O2
S + HNO3
NO2 + H2SO4 + H2OMg + H2SO4 H2S + MgSO4 + H2O