Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
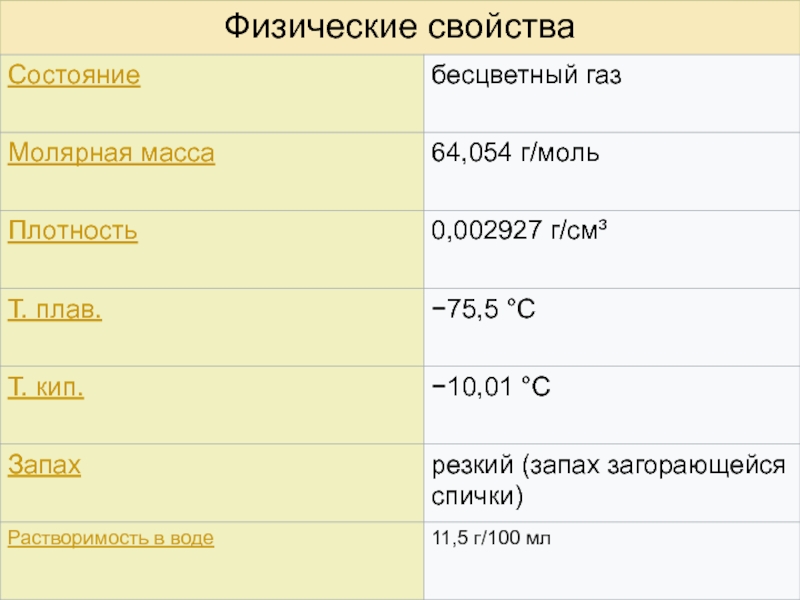
Оксид серы ( IV)
Содержание
ИсторияСера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился,
Слайды и текст этой презентации
Слайд 4Сернистый газ обладает высокой реакционной способностью. Диоксид серы – кислотный
оксид. Он довольно хорошо растворим в воде с образованием гидратов.
Также он частично взаимодействует с водой, образуя слабую сернистую кислоту, которая не выделена в индивидуальном виде:SO2 + H2O = H2SO3 = H+ + HSO3- = 2H+ + SO32-.
В результате диссоциации образуются протоны, поэтому раствор имеет кислую среду.
При пропускании газообразного диоксида серы через раствор гидроксида натрия образуется сульфит натрия. Сульфит натрия реагирует с избытком диоксида серы и образуется гидросульфит натрия:
2NaOH + SO2 = Na2SO3 + H2O;
Na2SO3+ SO2 = 2NaHSO3.
Для сернистого газа характерна окислительно-восстановительная двойственность, например, он, проявляя восстановительные свойства, обесцвечивает бромную воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
и раствор перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2KНSO4 + 2MnSO4 + H2SO4.
окисляется кислородом в серный ангидрид:
2SO2 + O2 = 2SO3.
Окислительные свойства проявляет при взаимодействии с сильными восстановителями, например:
SO2 + 2CO = S + 2CO2 (при 500 °С, в присутствии Al2O3);
SO2 + 2H2 = S + 2H2O.
Химические свойства
Слайд 5Сжигание серы на воздухе
S + O2 = SO2.
Окисление сульфидов
4FeS2 + 11O2 = 2Fe2O3 +
8SO2.
Действие сильных кислот на сульфиты металлов
Na2SO3 + 2H2SO4 = 2NaHSO4 + H2O +
SO2.Получение
Слайд 6Большая часть оксида серы(IV) используется для производства сернистой кислоты.
Используется
также в виноделии в качестве консерванта (пищевая добавка E220).
Так
как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Применяется он также и в качестве растворителя в лабораториях. При таком его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и, как следствие присутствия воды, H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре.
Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
Применение