Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 3. Второй закон термодинамики
Самопроизвольные
и несамопроизвольные процессы. Второй закон термодинамики.
Энтропия как критерий самопроизвольности процесса
в изолированной системе.
Энергия Гиббса и Гельмгольца как критерий самопроизвольности в закрытых и открытых системах.
Критерии направленности процессов в системах переменного состава. Химический потенциал.
Лектор: доцент кафедры химии
Григорьева Марина Викторовна
Слайд 21. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Процессы подразделяются на
самопроизвольные и не самопроизвольные.
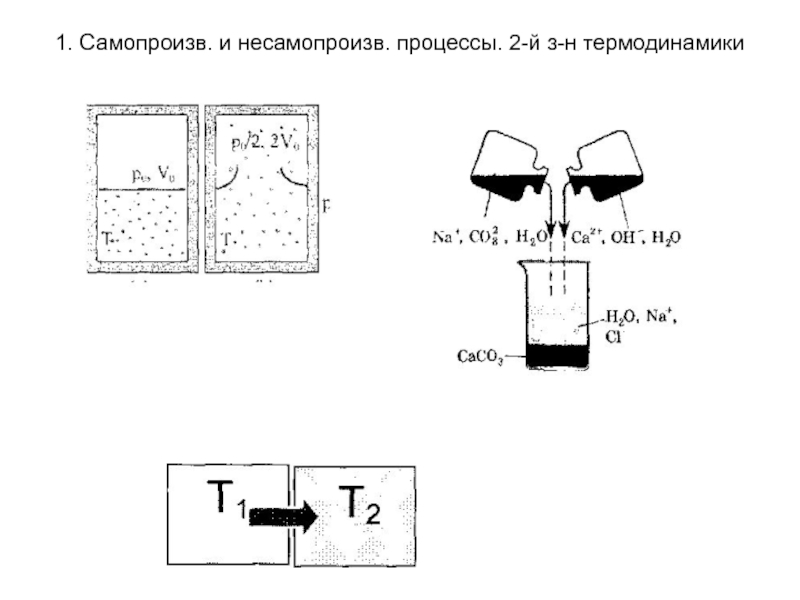
Самопроизвольные процессы - процессы протекающие без сообщения
энергии системе извне. Они протекают до установления равновесия в термодинамической системе. К ним относят переход теплоты от горячего тела к холодному, расширение газа при подвижных границах раздела система -среда, реакции протекающие с выпадением осадка, реакции протекающие с выделением газа и т.д. За счет самопроизвольных процессов может быть совершена работа: например, за счет разности давлений можно получить механическую работу; за счет разности температур может работать тепловой двигатель или термопара.
Слайд 31. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Слайд 41. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
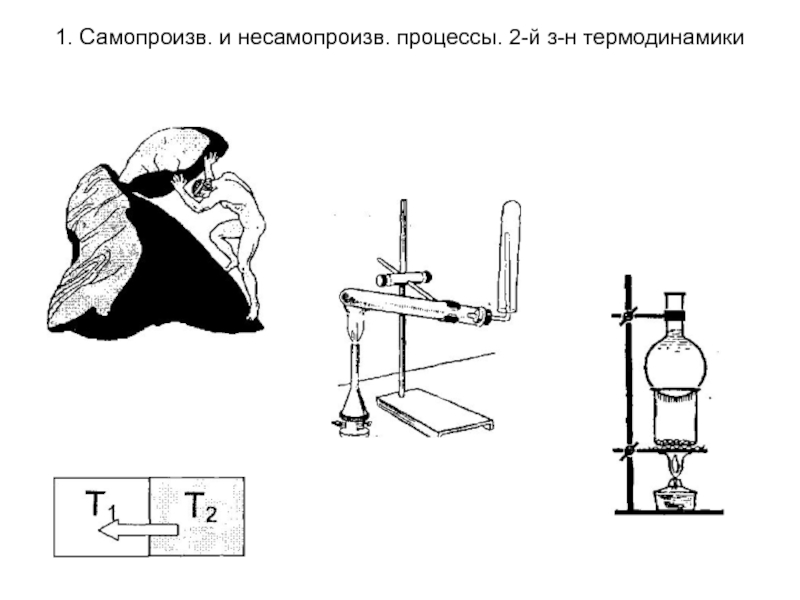
Несамопроизвольные процессы -
процессы протекающие при сообщении системе энергии извне. В результате таких
процессов система удаляется от состояния равновесия. Примерами таких процессов служит подъем тела в гору («сизифов труд»), переход теплоты от более холодного тела к более нагретому (в холодильных машинах), разложение воды на водород и кислород , разложение перманганата калия, возгонка нафталина и т.д.
Слайд 51. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Слайд 61. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Первый
закон термодинамики не дает ответа на вопрос «Что является критерием
самопроизвольности процесса?»
Данные критерии определяются 2-м законом термодинамики.
2-й закон термодинамики как и 1-й, является постулатом. Его справедливость подтверждается опытами. Основоположниками закона являются С. Карно, Р.Клаузис, У.Томсон, Дж. Максвелл и др. Сначала закон был сформулирован как основной закон действия тепловых машин, затем его границы расширились до объяснения физико-химических процессов.
Слайд 71. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Предложено много разнообразных
качественных формулировок 2-го начала термодинамики:
теплота не может переходить сама собой
от менее нагретого тела к более нагретому. (Р. Клаузиус, 1850)
невозможно превратить в механическую работу теплоту какого-либо тела, не произведя никакого другого действия, кроме охлаждения этого тела (Кельвин, 1854)
невозможен вечный двигатель второго рода, т.е. невозможно полное превращение теплоты в работу (В. Освальд, 1888).
Слайд 81. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
Количественно
второй закон термодинамики можно сформулировать так: существуют некие функции состояния
системы - термодинамические потенциалы, по значению изменения которых можно определить возможность, направление и предел протекания самопроизвольного процесса.
Слайд 92. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Термодинамическими потенциалами являются различные функции состояния в зависимости от вида
термодинамической системы:
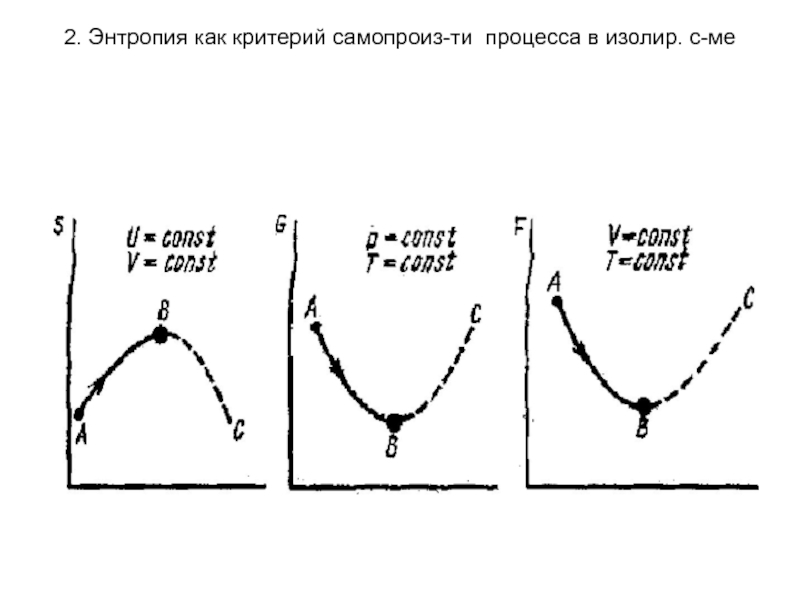
для изолированной системы (при U=const, V= const) критерием самопроизвольности процесса является энтропия (S). Процесс протекает самопроизвольно, если ΔS> 0, будет протекать не самопроизвольно, если ΔS< 0, в момент равновесия ΔS = 0. В неизолированной системе энтропия может уменьшаться но при этом должен происходить рост энтропии в окружающей среде.
Слайд 102. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
для закрытой
системы (при T=const, V= const) критерием самопроизвольности процесса является энергия
Гельмгольца (F). ΔF=0 - равновесие;
ΔF< 0 - самопроизвольный процесс;
ΔF>0 – не самопроизвольный процесс.
для открытой системы (при T=const, р= const) критерием самопроизвольности процесса является энергия Гиббса (G). ΔG=0 - равновесие;
ΔG< 0 - самопроизвольный процесс;
ΔG >0 - не самопроизвольный процесс.
Слайд 112. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Слайд 122. Энтропия как критерий самопроизвольности процесса в изолированной системе
Термодинамическое определение
энтропии введено Р. Клаузиусом в 1865г . На основе изучения
процессов превращения теплоты в работу, происходящих в тепловой машине (нагреватель - рабочее тело - холодильник), он вывел, что существует некоторое экстенсивное свойство системы S, называемое энтропией, которое может служить мерой рассеивания энергии при переходе теплоты в работу.
Слайд 132. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Приращение энтропии в равновесном процессе равно приведенной теплоте – отношению
элементарного количества теплоты к температуре.
Энтропия является функцией состояния системы, следовательно изменение энтропии зависит от начального и конечного состояния системы и не зависит от пути процесса: ΔS = S2-S1
Слайд 142. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Статистическое определение
энтропии в 1896 г дает Л. Больцман. В связи с
тем, что теплота, связана с идеей хаотического движения молекул, следовательно можно определить физический смысл энтропии на основе представлений молекулярной статистики.
Слайд 152. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Макросостояние системы
характеризуется определенными термодинамическими параметрами , в т.ч. и энтропией. Микросостояние
системы определяется энергией и положением каждой частицы. Макросостояние системы может существовать при различном расположении и разной энергии частиц определяющих микросостояние. Число микросостояний, которое соответствует данному макросостоянию вещества, называется термодинамической вероятностью W. Например, для системы состоящей из 10 частиц W=12600.
Слайд 162. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Больцман
установил взаимосвязь энтропии с термодинамической вероятностью:
S= КБ In W ,где
КБ - постоянная Больцмана (КБ = R/NA= 1,38 ·10-23 Дж/ моль),
Энтропия - мера наиболее вероятностного состояния системы, а следовательно и мера беспорядка (хаотичности) системы.
Слайд 172. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
При абсолютном
нуле прекращаются колебательные движения частиц, образующих кристаллическую решетку. Такое микросостояние
достигается лишь при одном варианте расположения микрочастиц (W) и в соответствии с формулой Больцмана:
S = КБ In 1 = 0
Эта закономерность известна как третий закон термодинамики (постулат Планка): при абсолютном нуле энтропия чистого вещества равна нулю.
Слайд 182. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Расчет абсолютного
значения энтропии
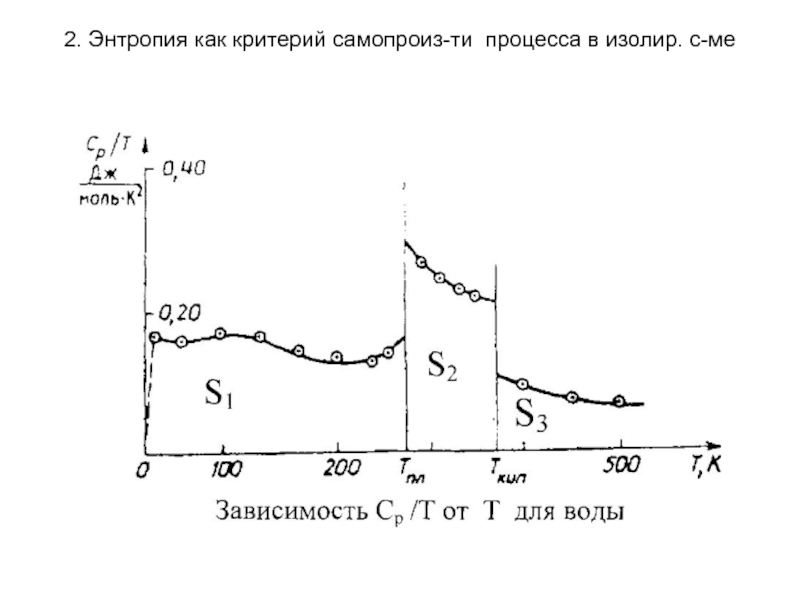
Для многих практических целей, особенно для расчета химических равновесий,
надо знать стандартные энтропии веществ S°. Для их вычисления используют табличные данные теплоемкости, определенные при возможно низких температурах и теплоты фазовых переходов. Значение теплоемкости вблизи абсолютного нуля находят путём экстраполяции. Если в интервале температур от 0 до Т вещество претерпевает ф.п., то они должны быть учтены.
Слайд 192. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Где S0ид
- поправка на неидеальность газа (пара) при данной температуре.
Расчет энтропии
осуществляется графически: каждый интеграл равен соответствующей площади.
Слайд 202. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Слайд 212. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
Сложив сумму этих интегральных членов с изменениями энтропии при всех
фазовых переходах в исследуемом интервале температур (от О К до Т К) и с поправкой на неидеальность, находят значение абсолютной энтропии данного вещества при температуре Т.
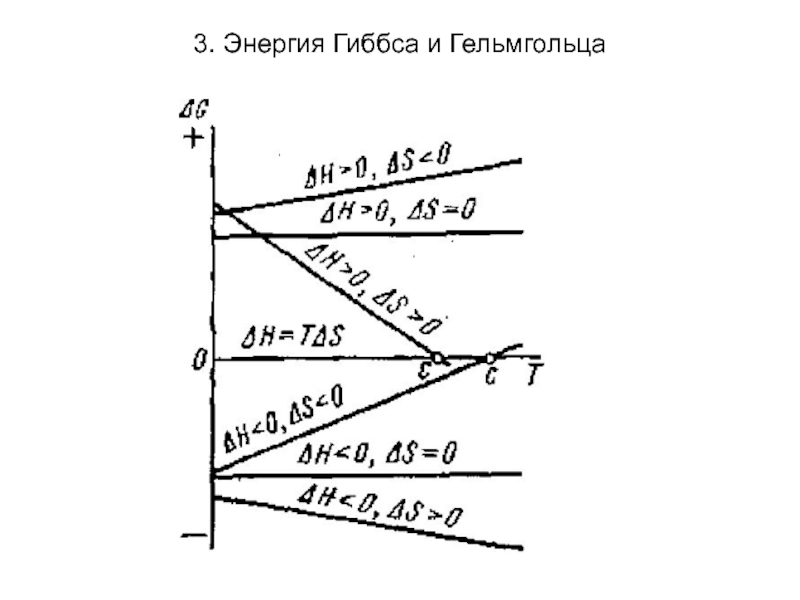
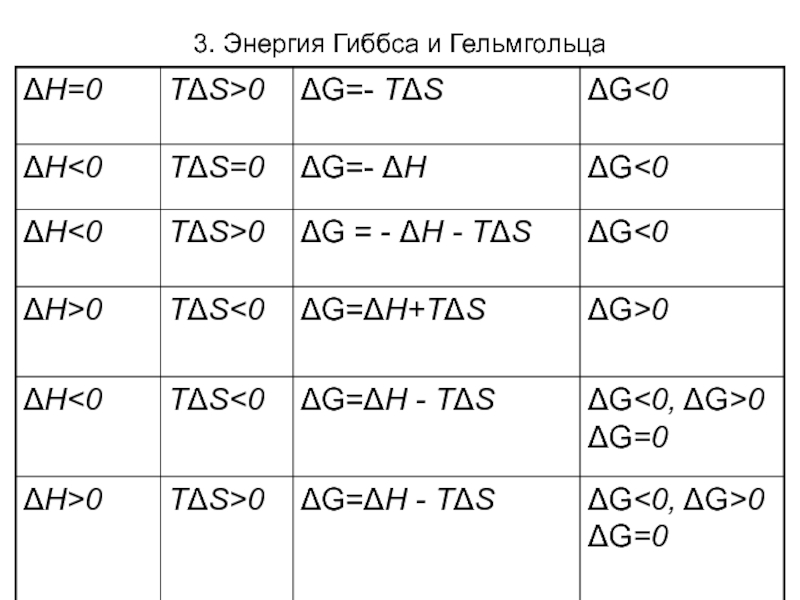
Слайд 223. Энергия Гиббса и Гельмгольца
При Т,р =const (изохорно-изотермические
условия) критерием самопроизвольности является изобарно-изотермический потенциал (энергия Гиббса) G =
Н - TS (ΔG = ΔН -TΔS).
При ΔG=0 -равновесие;
ΔG<0 самопроизвольный процесс;
ΔG>0 – не самопроизвольный процесс.
Знак и величина ΔG определяется энтальпий-ным ΔН и энтропийным факторами TΔS. Возможные случаи зависимости энтальпийного и энтропийного фактора:
Слайд 253. Энергия Гиббса и Гельмгольца
При T,V = const,
критерием самопроизвольности является изохорно-изотермический потенциал (энергия Гельмгольца) F = U
-TS (ΔF = ΔU -TΔS).
Слайд 263. Энергия Гиббса и Гельмгольца
Характеристические функции - функции,
частные производные которых по какому-либо из параметров (естественной переменной) равны
другому параметру. Энергия Гиббса относится к характеристическим функциям.
Слайд 274. Химический потенциал
Химический потенциал μ – термодинамическая функция
состояния, определяющая изменение термодинамических потенциалов при изменении числа частиц в
системе и необходимая для описания свойств открытых систем (с переменным числом частиц).
Слайд 284. Химический потенциал
Наиболее просто химический потенциал связан с
термодинамическим потенциалом G: G=∑μi Ni .
Для однокомпонентной
системы
μ = G/N, т. е. представляет собой энергию Гиббса, отнесённую к одной частице.
Слайд 294. Химический потенциал
В простейшем случае идеальных газов зависит
только от концентрации i -го компонента:
μi = μi0+
kT ln С