Слайд 1
ОРГАНИЧЕСКАЯ ХИМИЯ
Карбоновые кислоты
Слайд 2План:
Понятие о карбоновых кислотах.
Одноосновные карбоновые кислоты
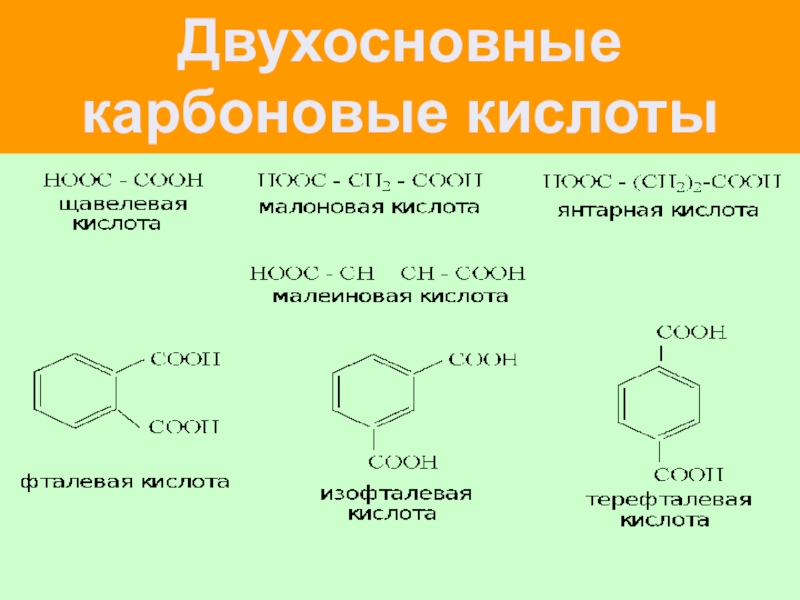
Двухосновные карбоновые кислоты.
Слайд 3
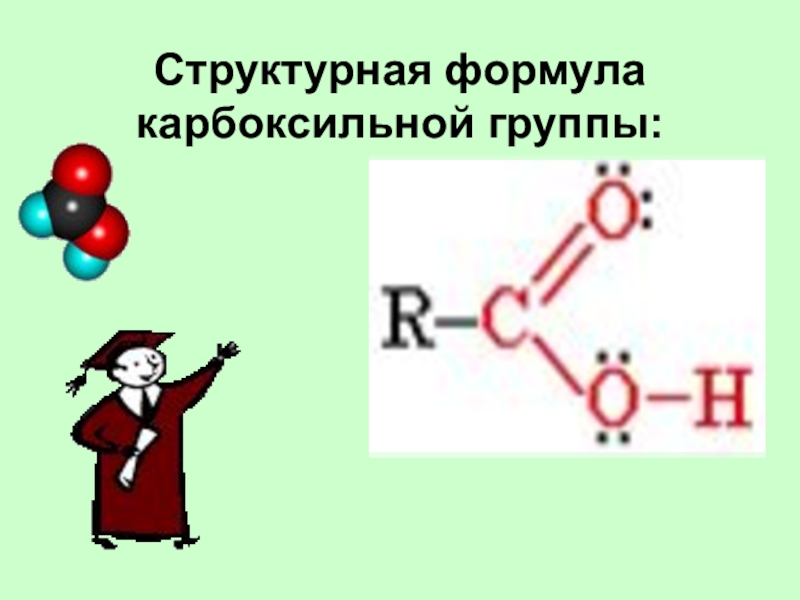
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна
или несколько карбоксильных групп –COOH, связанных с углеводородным радикалом
Общая формула
предельных одноосновных кислот:
СnH2n+1COOH (или СnH2nO2)
В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические.
Число карбоксильных групп определяет основность кислот.
Понятие о карбоновых кислотах.
Слайд 4Структурная формула карбоксильной группы:
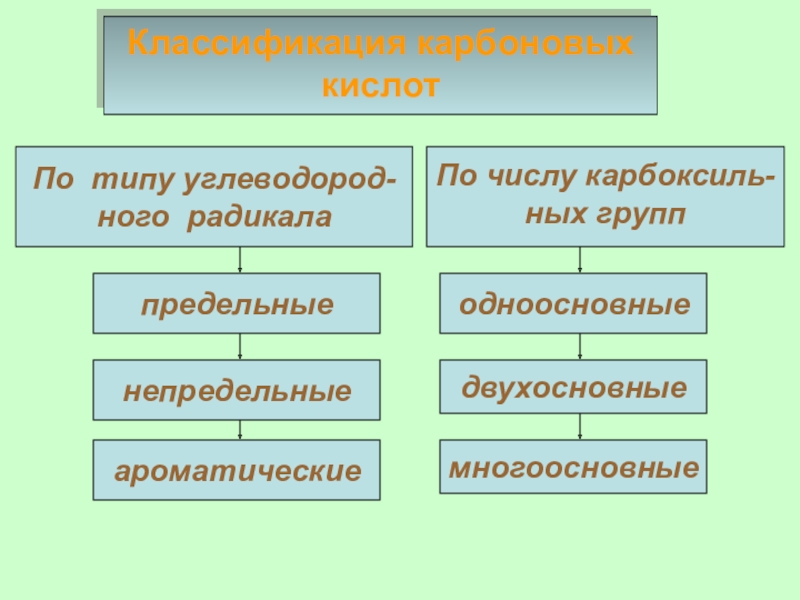
Слайд 5Классификация карбоновых кислот
По числу карбоксиль-
ных групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводород-
ного радикала
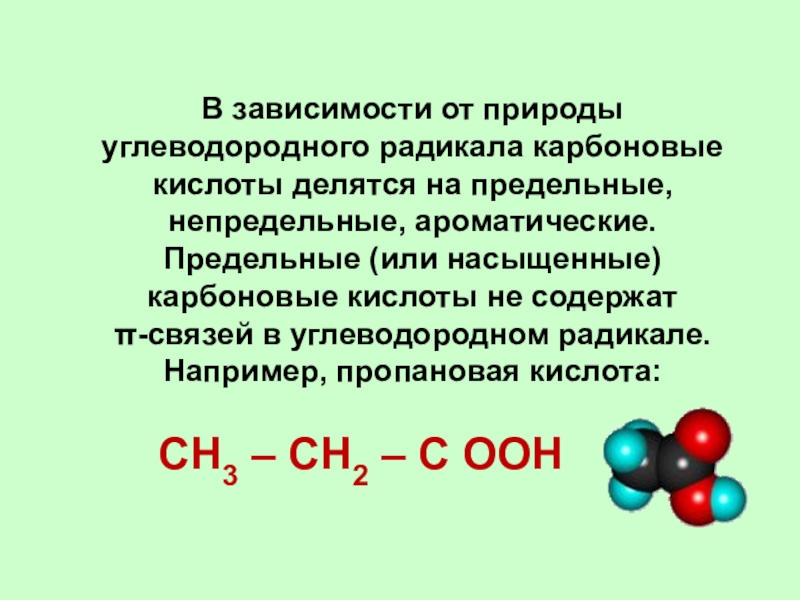
Слайд 6В зависимости от природы углеводородного радикала карбоновые кислоты делятся на
предельные, непредельные, ароматические. Предельные (или насыщенные) карбоновые кислоты не содержат
π-связей в углеводородном радикале. Например, пропановая кислота:
CH3 – CH2 – C ОOH
Слайд 7В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным,
непредельным углеводородным радикалом. Например, акриловая кислота:
CH2 = CH –
COOH
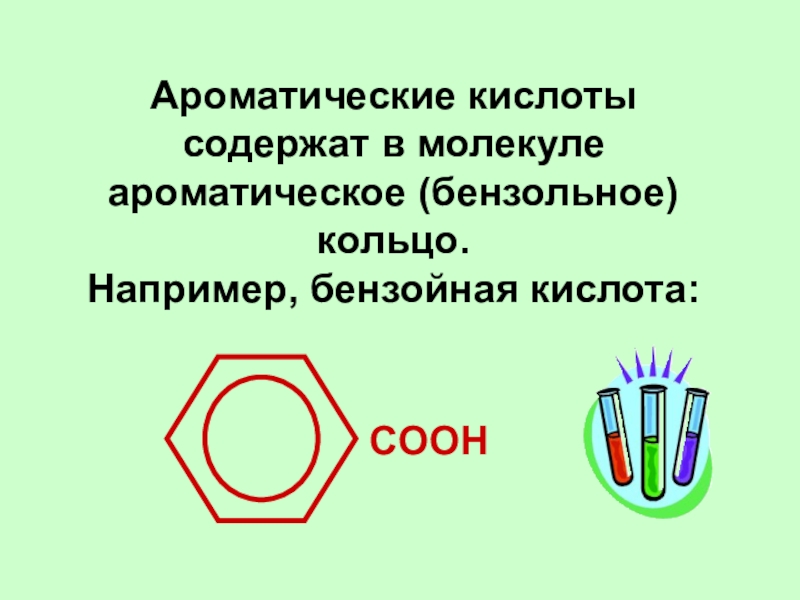
Слайд 8Ароматические кислоты содержат в молекуле ароматическое (бензольное) кольцо.
Например, бензойная
кислота:
COOH
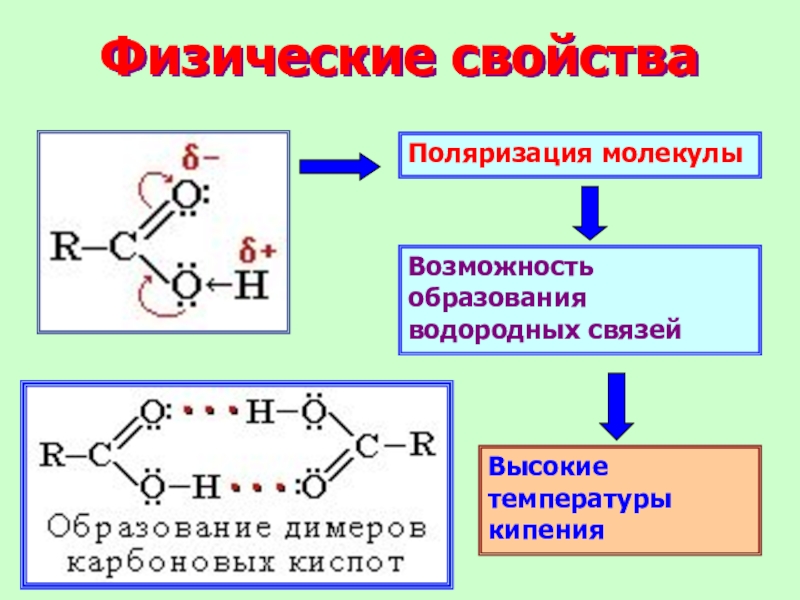
Слайд 12Физические свойства
Поляризация молекулы
Возможность образования водородных связей
Высокие температуры кипения
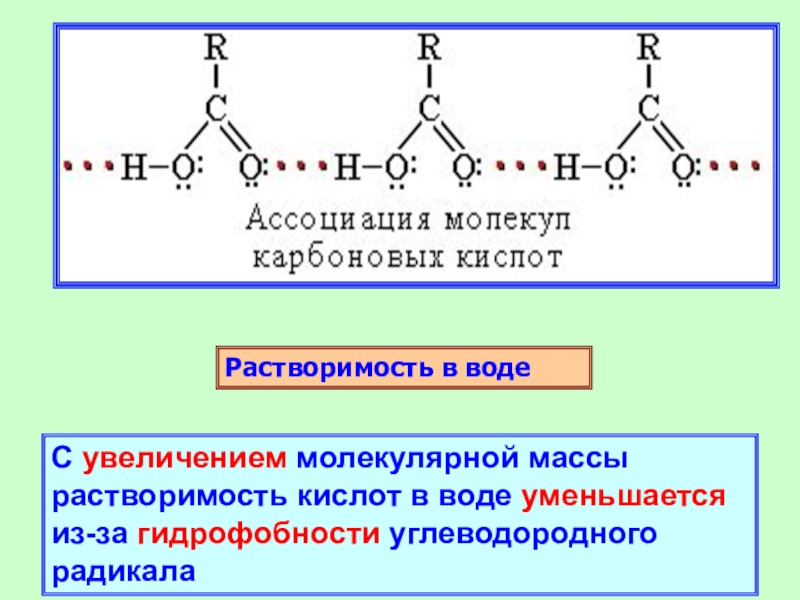
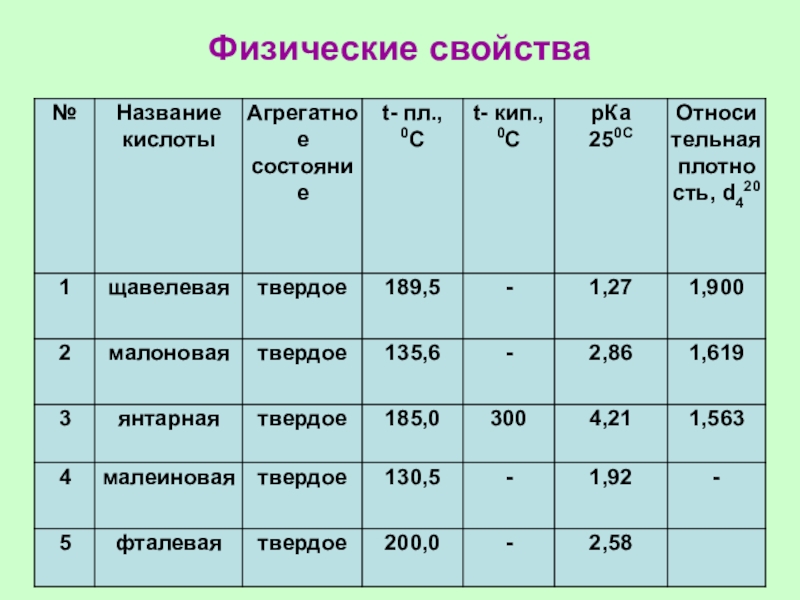
Слайд 14Растворимость в воде
С увеличением молекулярной массы растворимость кислот в воде
уменьшается из-за гидрофобности углеводородного радикала
Слайд 15Физические свойства
Низшие карбоновые кислоты — жидкости
с острым запахом, хорошо растворимые
в
воде. С повышением относительной
молекулярной массы растворимость
кислот в
воде уменьшается, а температура
кипения повышается. Высшие кислоты,
начиная с пеларгоновой С8Н17СООН —
твердые вещества, без запаха,
нерастворимые в воде.
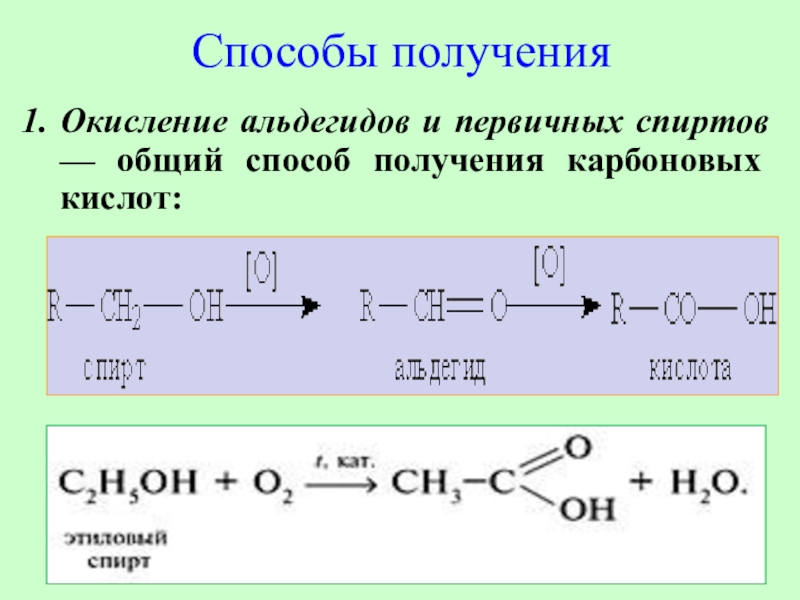
Слайд 16Способы получения
Окисление альдегидов и первичных спиртов — общий способ получения
карбоновых кислот:
Слайд 17
2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три
атома галогена у одного атома углерода:
-3NaCl
Слайд 183. Взаимодействие реактива Гриньяра с СО2:
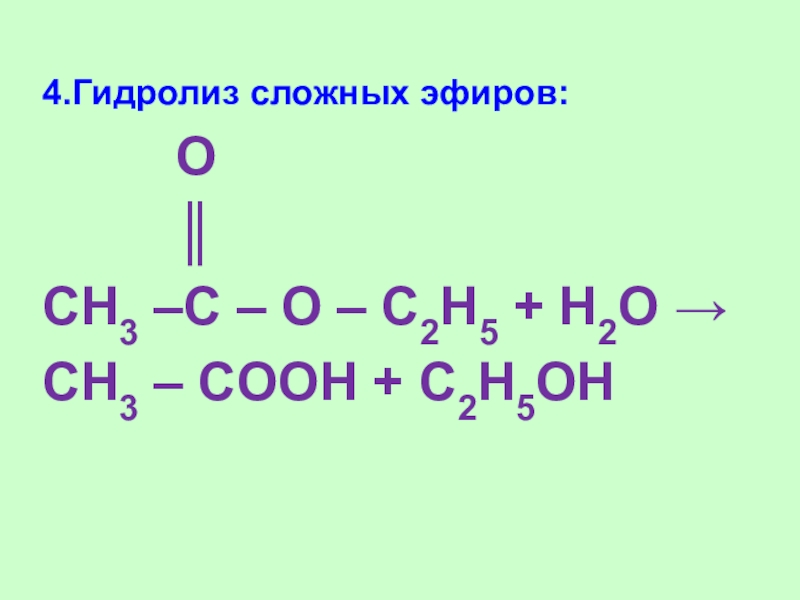
Слайд 194.Гидролиз сложных эфиров:
O
║
CH3
–C – O – C2H5 + H2O →
CH3 – COOH + C2H5OH
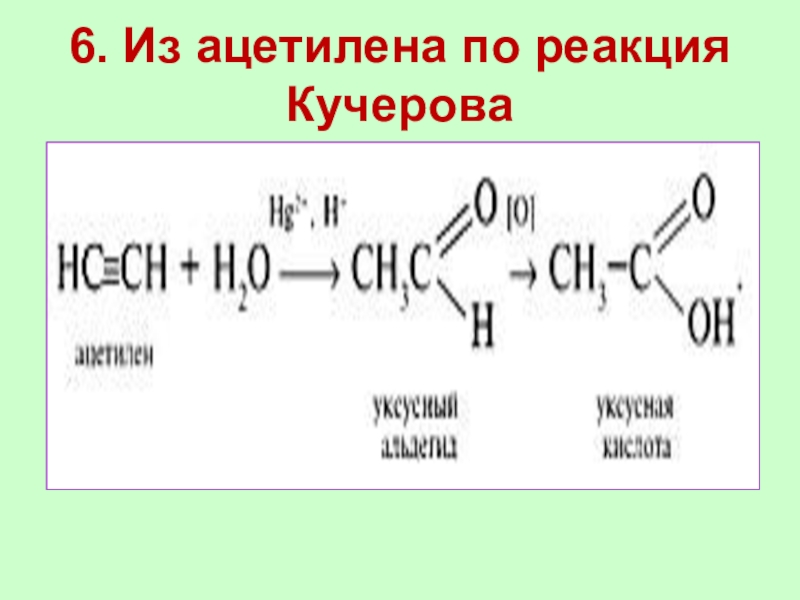
Слайд 216. Из ацетилена по реакция Кучерова
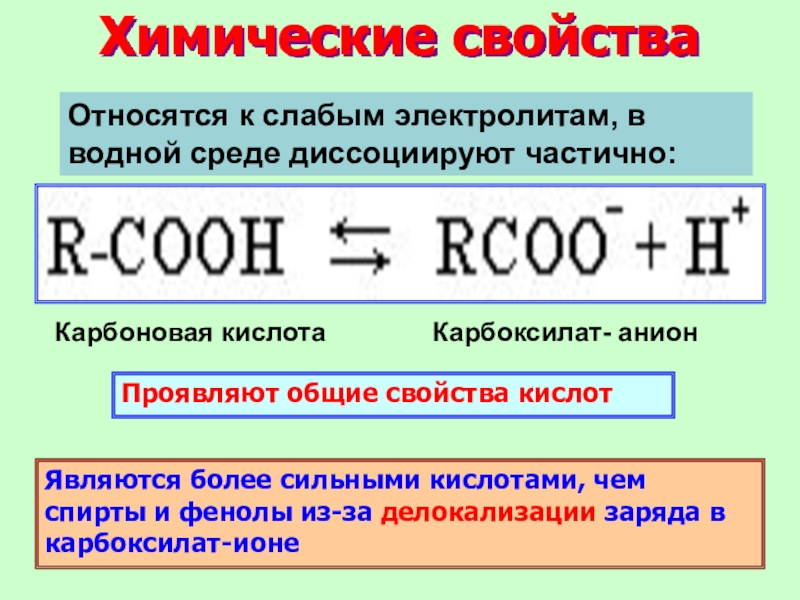
Слайд 23Химические свойства
Проявляют общие свойства кислот
Являются более сильными кислотами, чем спирты
и фенолы из-за делокализации заряда в карбоксилат-ионе
Карбоновая кислота
Карбоксилат- анион
Относятся к
слабым электролитам, в водной среде диссоциируют частично:
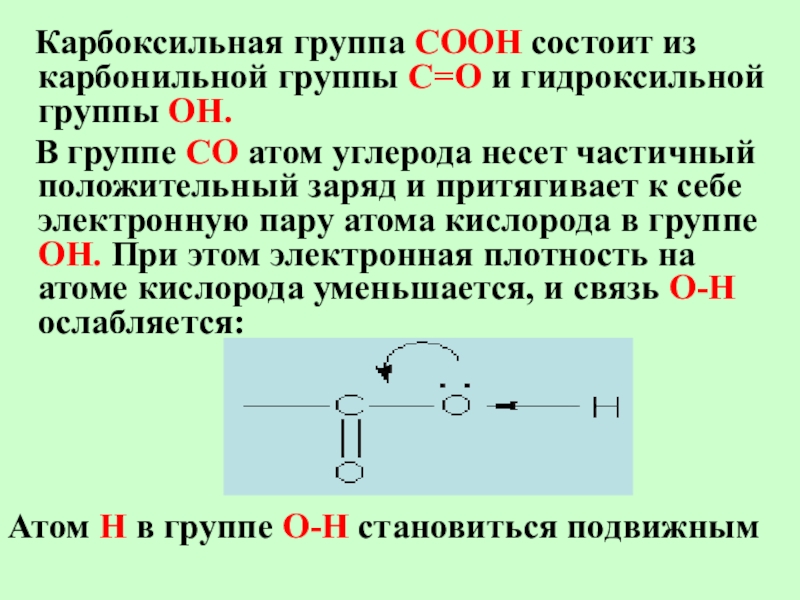
Слайд 24 Карбоксильная группа СООН состоит из карбонильной группы С=О
и гидроксильной группы ОН.
В группе СО атом
углерода несет частичный положительный заряд и притягивает к себе электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
Атом Н в группе О-Н становиться подвижным
Слайд 25Уксусная кислота
Уксусная кислота (этановая)СН3СООН– самая древняя из органических кислот. Аптекари
– алхимики средневековья получали её из перебродившего вина.
Чистая уксусная кислота
– б/ц жидкость с резким запахом. 100% кислота называется «ледяной»Она используется
при консервировании пищевых продуктов.
Слайд 26
Уксусная кислота в больших количествах применяется в химической промышленности.
Основную часть
уксусной кислоты используют для получения искусственных волокон и пластмасс на
основе целлюлозы. Уксусную кислоту применяют в производстве красителей, медикаментов, ядохимикатов, органического стекла.
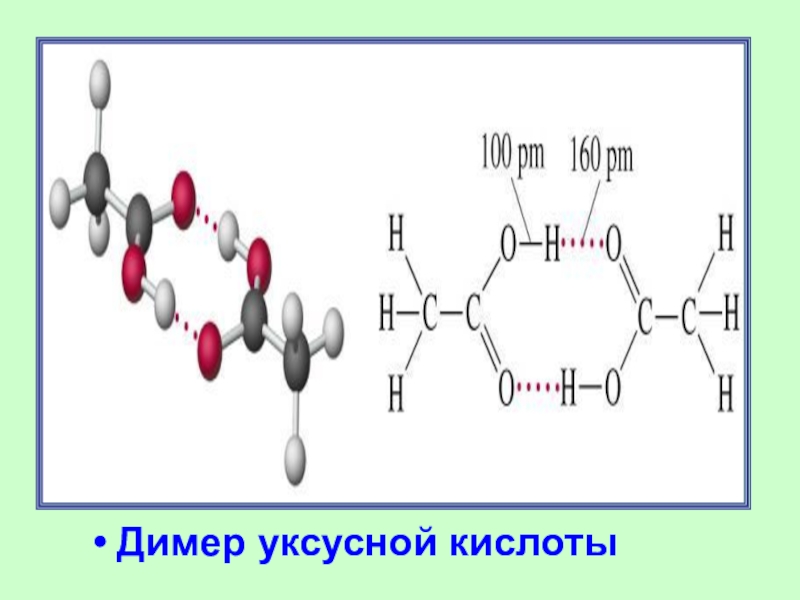
Слайд 27Модель молекулы уксусной кислоты:
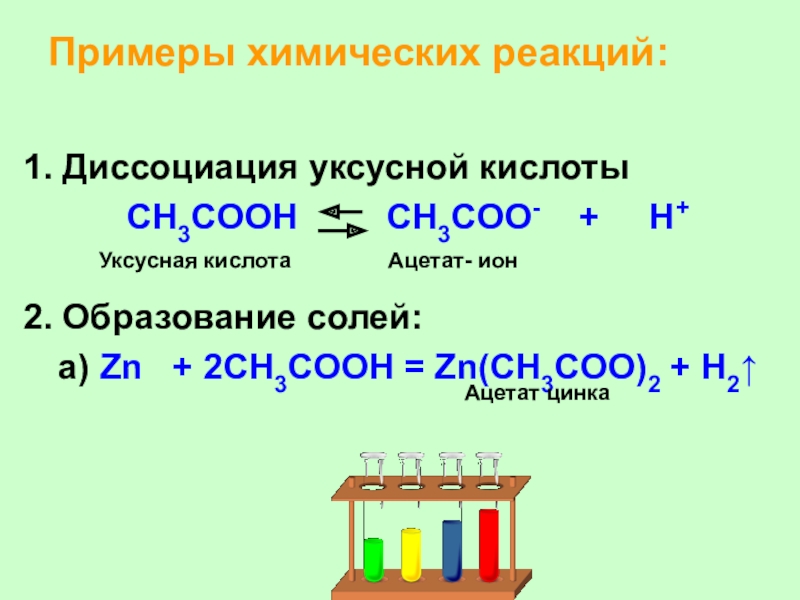
Слайд 28Примеры химических реакций:
1. Диссоциация уксусной кислоты
CH3COOH
CH3COO- + H+
2. Образование солей:
а)
Zn + 2CH3COOH = Zn(CH3COO)2 + H2
Уксусная кислота
Ацетат- ион
Ацетат цинка
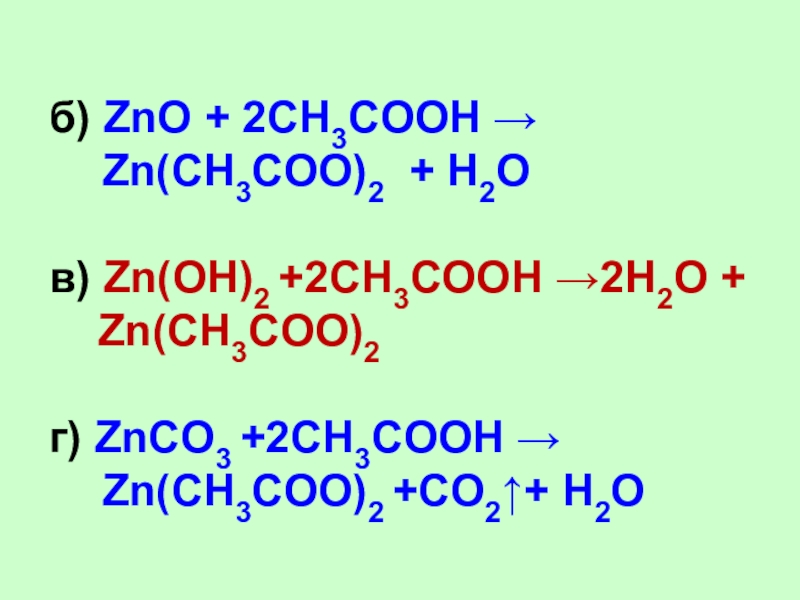
Слайд 29б) ZnO + 2CH3COOH → Zn(CH3COO)2 + H2O
в) Zn(OH)2
+2CH3COOH →2H2O +
Zn(CH3COO)2
г) ZnCO3 +2CH3COOH → Zn(CH3COO)2 +CO2+
H2O
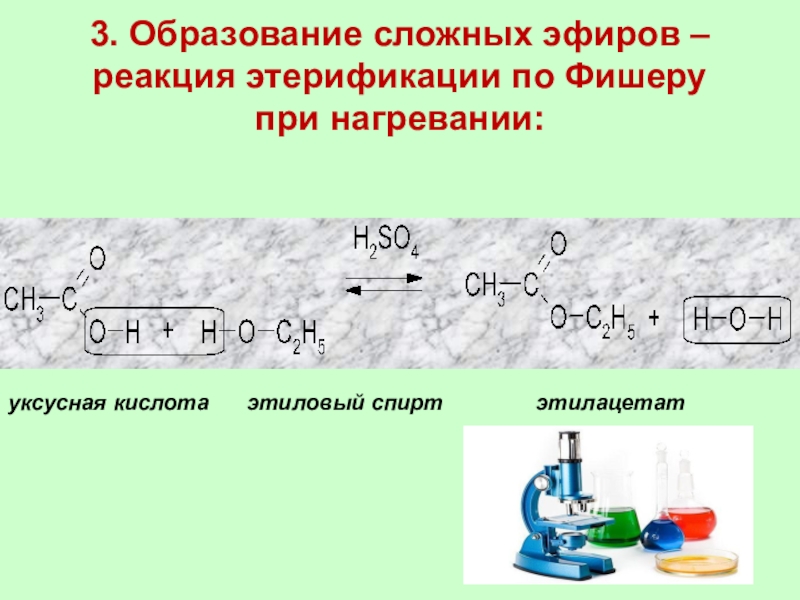
Слайд 303. Образование сложных эфиров – реакция этерификации по Фишеру
при нагревании:
уксусная
кислота этиловый спирт
этилацетат
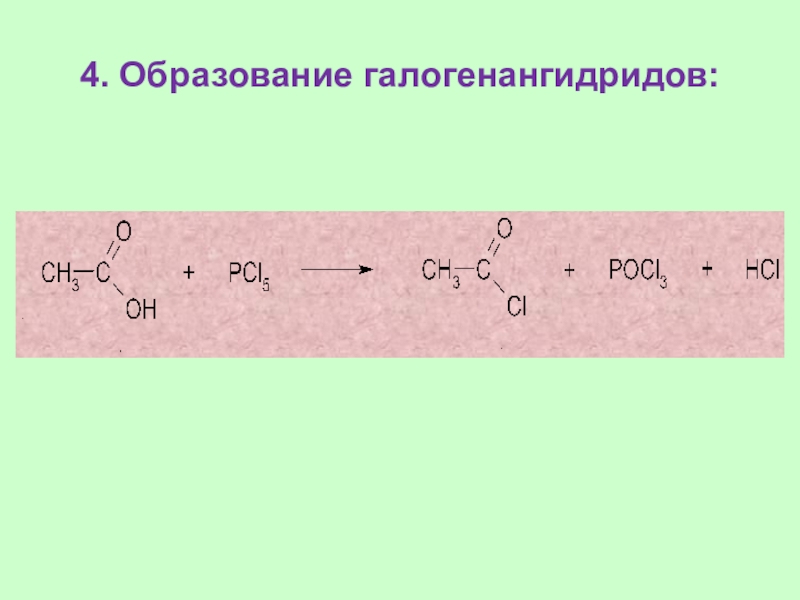
Слайд 314. Образование галогенангидридов:
Слайд 32 5. Реакции замещения (с галогенами) – в нее способны
вступать предельные карбоновые кислоты.
CH3 – COOH + Cl2 →
CH2Cl –COOH+ HCl
монохлоруксусная кислота
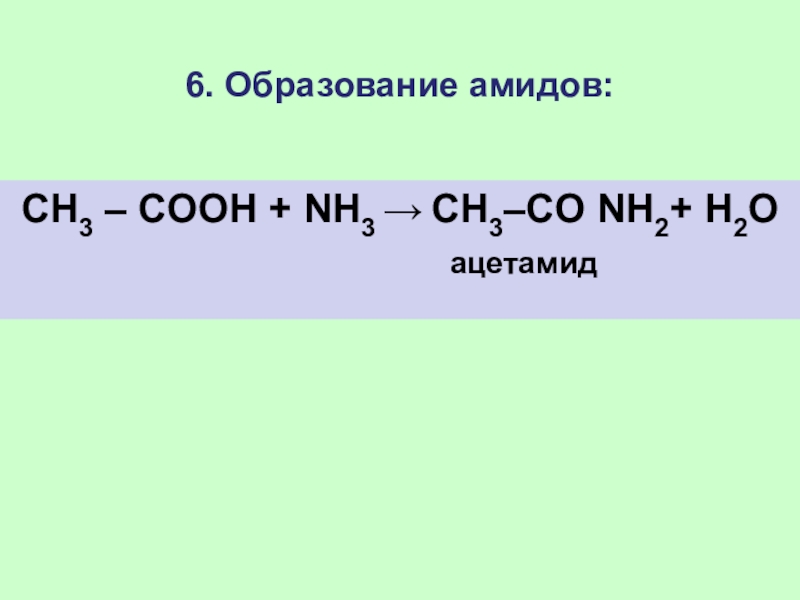
Слайд 336. Образование амидов:
CH3 – COOH + NН3 → CH3–CO NН2+
H2О
ацетамид
Слайд 34
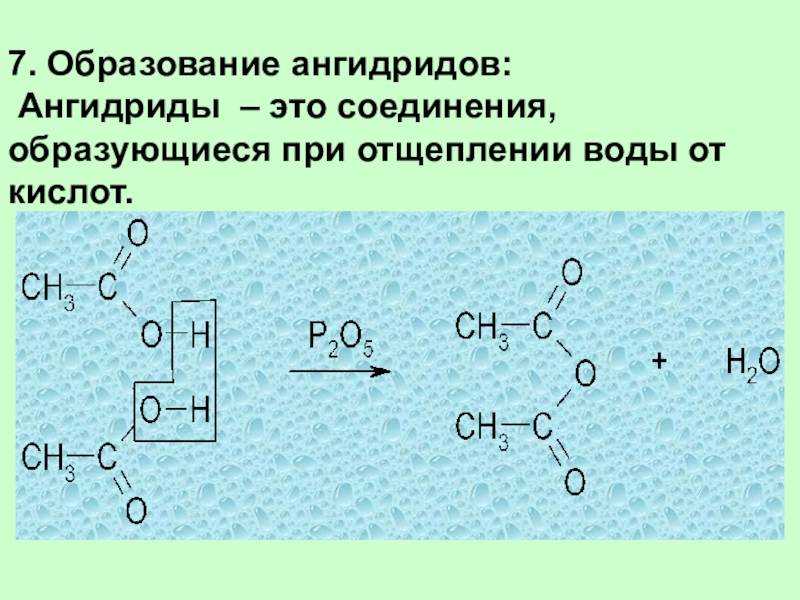
7. Образование ангидридов:
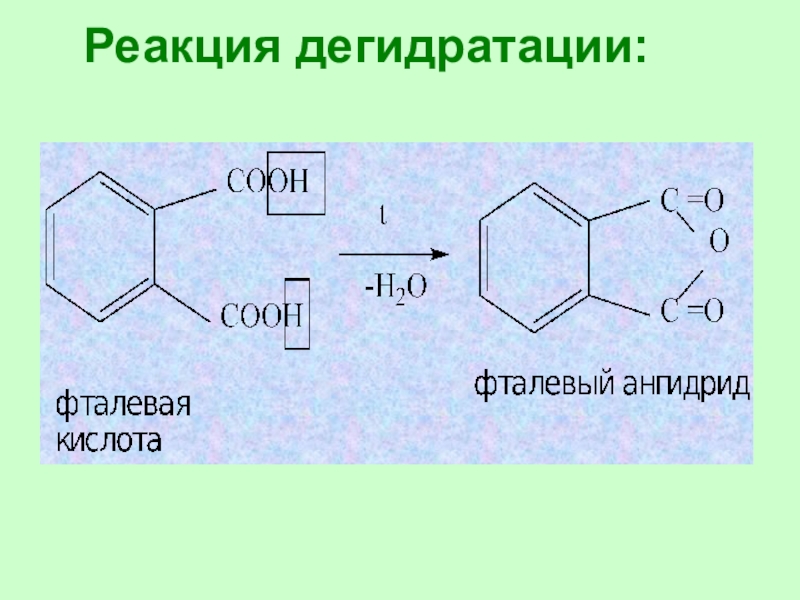
Ангидриды – это соединения, образующиеся при отщеплении
воды от кислот.
Слайд 35Муравьиная кислота (метановая) НСООН -
Содержится в выделениях муравьёв, в
щетинках
крапивы, в яде пчёл. Спиртовые растворы муравьиной
кислоты используются в
лечении
ревматизма. В структуре
этой кислоты есть альдегидная группа,
поэтому для нее характерны следующие реакции:
Слайд 36Модель молекулы муравьиной кислоты:
Слайд 37
1. Окисление муравьиной кислоты (эта реакция свойственна только для данной
кислоты):
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 +
+5CO2↑ + 8H2O
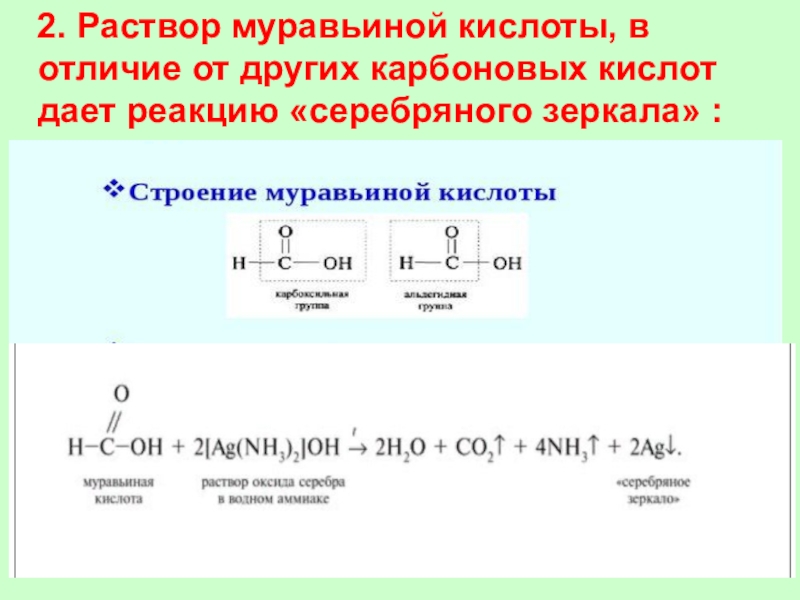
Слайд 38 2. Раствор муравьиной кислоты, в отличие от других
карбоновых кислот дает реакцию «серебряного зеркала» :
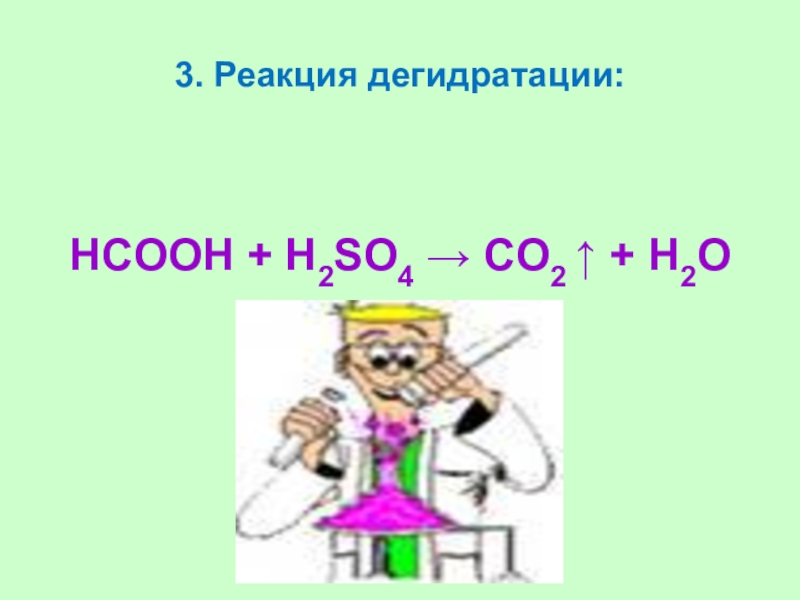
Слайд 403. Реакция дегидратации:
HCOOH + Н2SO4 → CO2 ↑ +
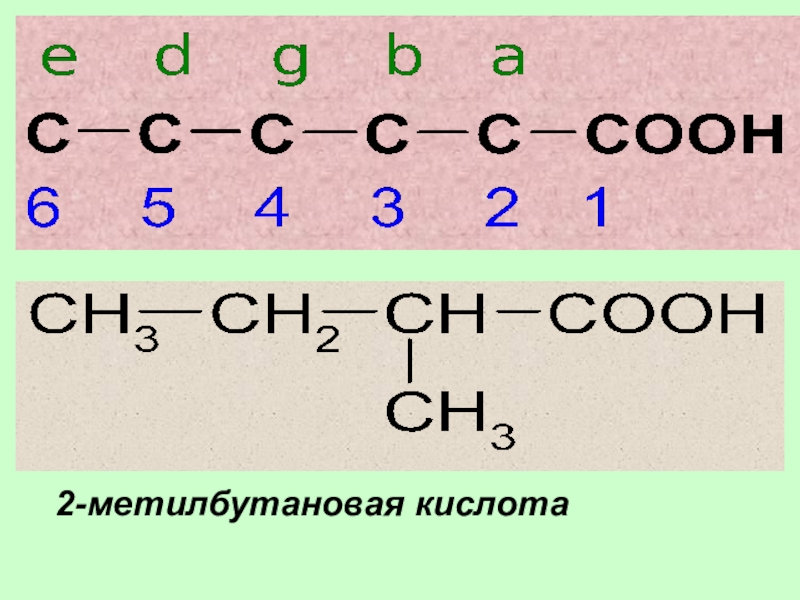
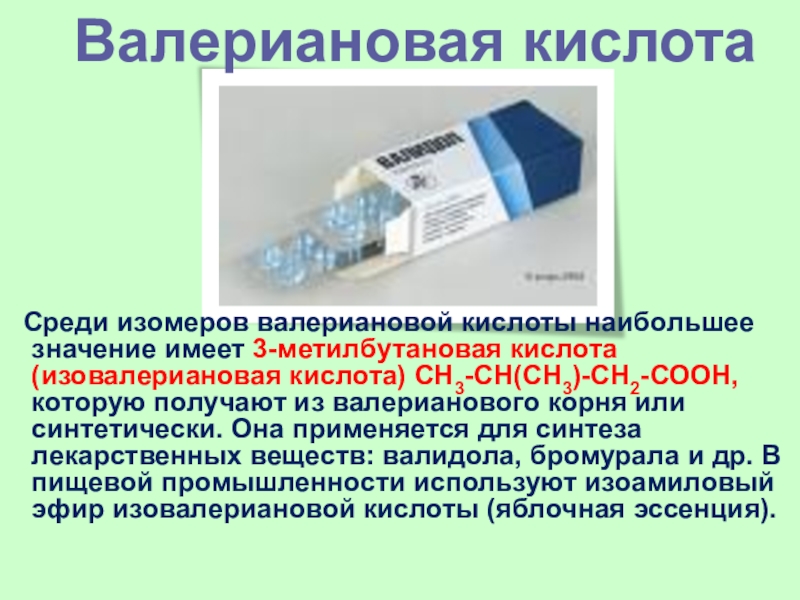
Слайд 41 Среди изомеров валериановой кислоты наибольшее значение имеет 3-метилбутановая кислота
(изовалериановая кислота) СН3-СH(СН3)-СН2-СООН, которую получают из валерианового корня или синтетически.
Она применяется для синтеза лекарственных веществ: валидола, бромурала и др. В пищевой промышленности используют изоамиловый эфир изовалериановой кислоты (яблочная эссенция).
Валериановая кислота
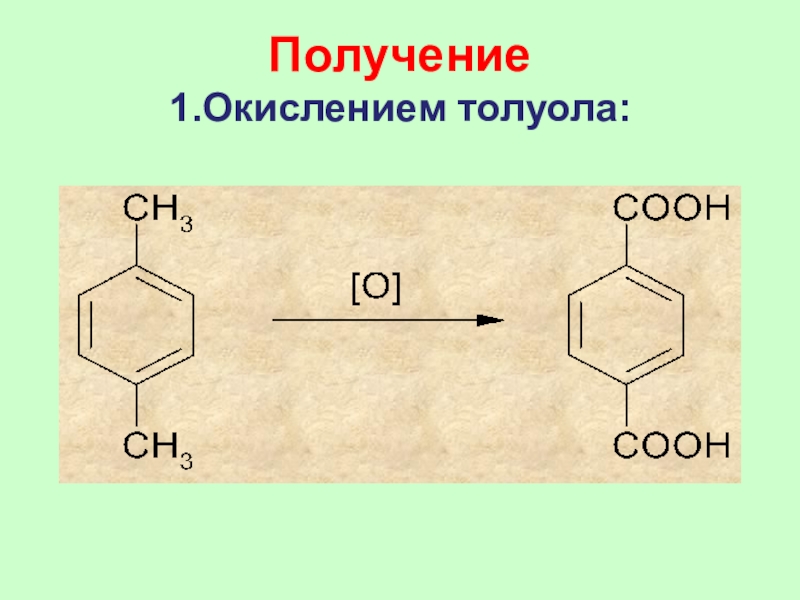
Слайд 42 В промышленных масштабах бензойную кислоту получают окислением
толуола.
Применяют в медицине при кожных заболеваниях как
наружное антисептическое противогрибковое средства, а её натриевую соль – как отхаркивающее средство. Кроме того, бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213). Эфиры бензойной кислоты (от метилового до амилового) обладают сильным запахом и применяются в парфюмерной промышленности. Некоторые другие производные бензойной кислоты, широко применяются для синтеза красителей.
Бензойная кислота
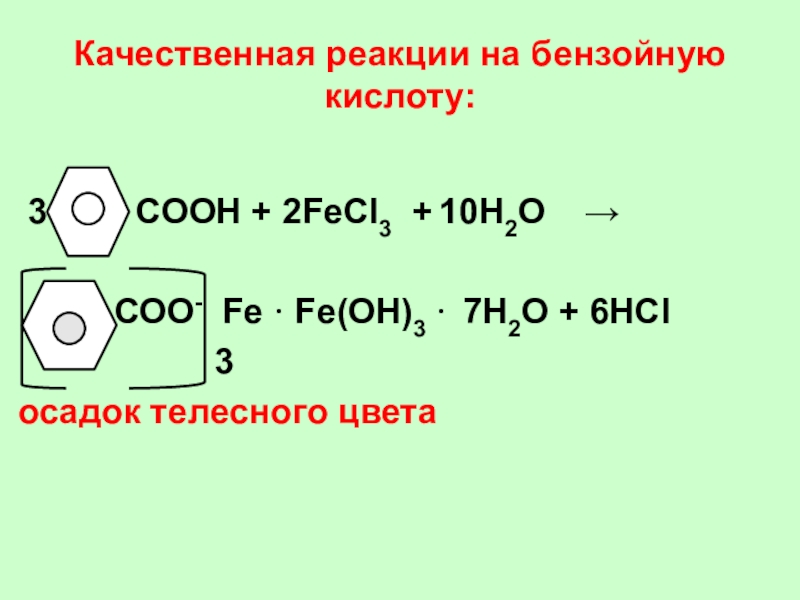
Слайд 43Качественная реакции на бензойную кислоту:
3
СООН + 2FeCl3 + 10Н2О
→
СОО- Fe · Fe(ОН)3 · 7Н2О + 6НCl
3
осадок телесного цвета
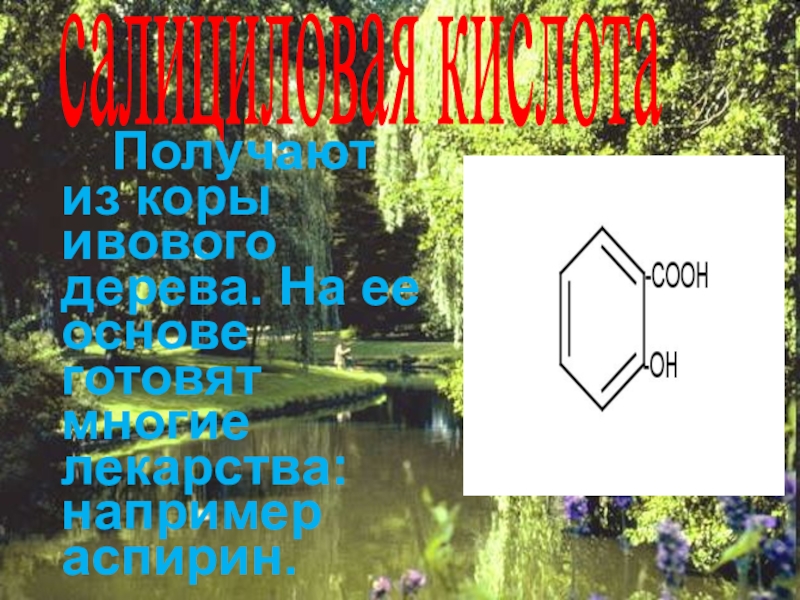
Слайд 44салициловая кислота
Получают из коры ивового дерева. На ее основе готовят
многие лекарства: например аспирин.
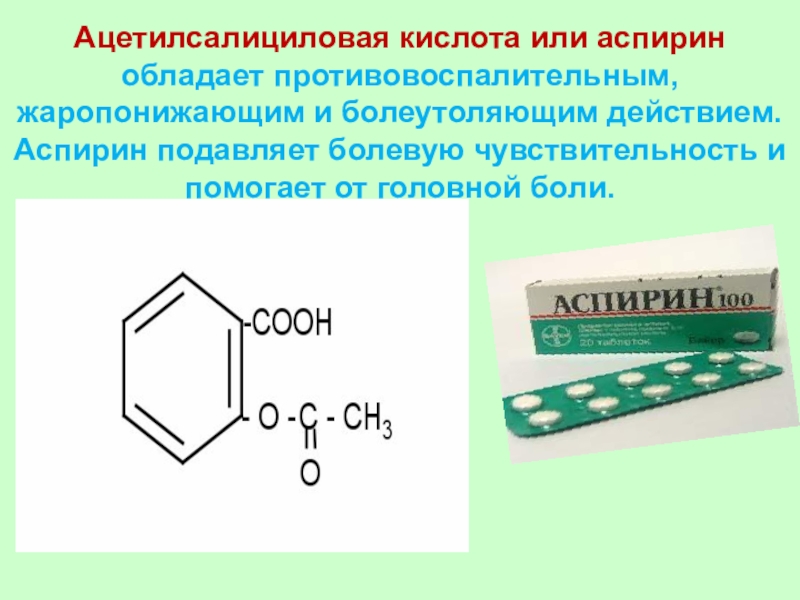
Слайд 45
Ацетилсалициловая кислота или аспирин обладает противовоспалительным,
жаропонижающим и болеутоляющим действием. Аспирин
подавляет болевую чувствительность и помогает от головной боли.
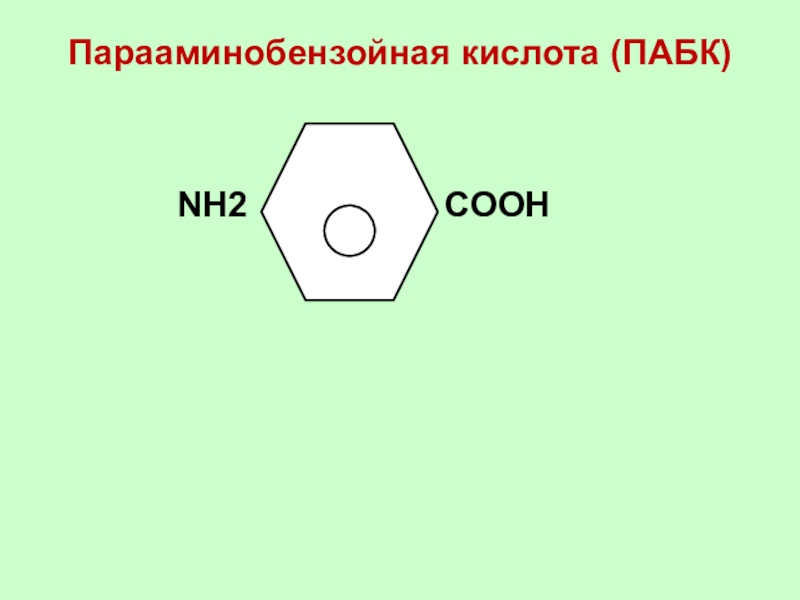
Слайд 46Парааминобензойная кислота (ПАБК)
NН2
СООН
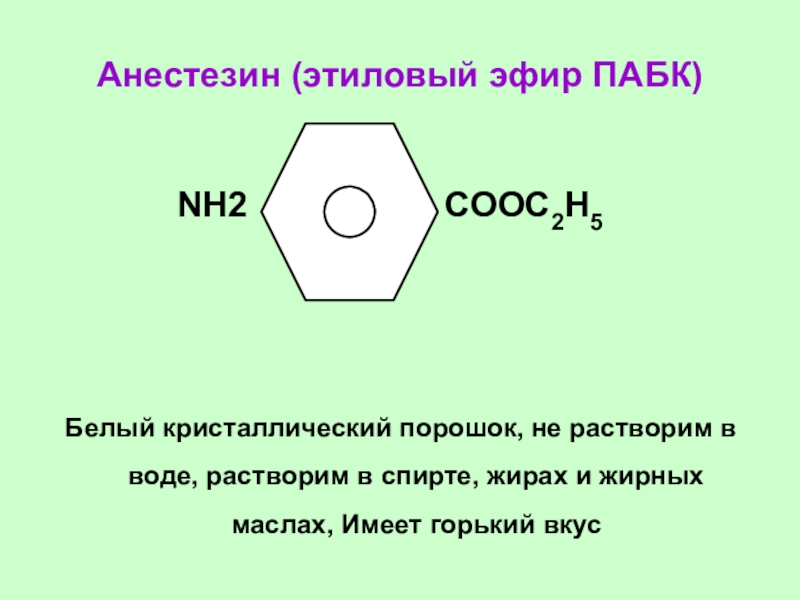
Слайд 47Анестезин (этиловый эфир ПАБК)
NН2
СООС2Н5
Белый кристаллический порошок, не растворим в воде, растворим в спирте, жирах и жирных маслах, Имеет горький вкус
Слайд 48 Стеариновая кислота относится к высшим карбоновым кислотам и имеет формулу
С17Н35СООН.
Она является одной из наиболее распространённых в природе высших
жирных кислот. Стеариновая кислота — главная составная часть многих жиров и масел, из которых её выделяют гидролизом.
Высшие карбоновые кислоты
Слайд 49Соли стеариновой кислоты называются стеаратами.
Стеараты кальция, магния или железа, так
же как сама стеариновая кислота, в воде нерастворимы.
Стеараты щелочных металлов,
например стеарат натрия С17Н35СООNa, хорошо растворимы в воде. Они являются основой мыл: хозяйственного,
банного, туалетного,
детского.
Слайд 50пальмитиновая кислота
Насыщенная карбоновая кислота. Наиболее распространённая в природе жирная предельная
кислота: в виде сложных эфиров глицерина входит в состав почти
всех природных жиров. Соли пальмитиновой кислоты наряду с солями некоторых др. карбоновых кислот являются мылами. Смесь пальмитиновой кислоты и стеариновой кислоты составляет основу стеарина.
Слайд 52Номенклатура
Систематическая номенклатура непредельных карбоновых кислот (ИЮПАК):
Выбирают в молекуле наиболее длинную
углеродную цепь с двумя карбоксильными группами СООН.
Нумерацию цепи начинают с
атома углерода карбоксильной группы, причем, с того конца молекулы, у которого ближе и больше радикалов.
Называют окружающие радикалы: в порядке возрастания, с указанием количества и положения в цепи.
По длине цепи называют углеводород (алкен, алкин, диен и т.д.), указывая положение ненасыщенных связей, добавляя –диовая кислота.
Слайд 54Изомерия
Изомерия строения углеродного скелета (структурная):
а) строение углеводородного радикала
2. Положение карбоксильной
группы
Слайд 55б)структурная изомерия связанная с положением ненасыщенных связей:
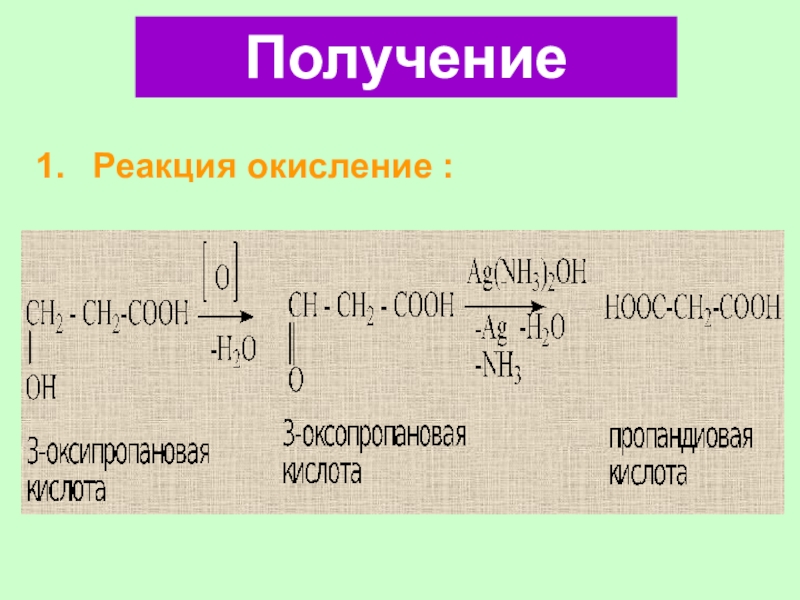
Слайд 582. Реакция окисления двухатомного спирта:
СН2-СООН [О] С-ОН
Аg(NН3)2ОН
СН2-СООН С-ОН
диальдегид -Аg,- NН3,-Н2О
СООН
СООН [О] – 2КМnО4+3Н2SО4
Щавелевая кислота
Слайд 593. Из дигалогенпроизводных углеводородов:
Слайд 604. Промышленный способ получения щавелевой кислоты:
НСООNа- НСООNа → СООNа- СООNа
+Н2
2) СООNа- СООNа + 2НСl → СООН- СООН +
2 NаСl
Слайд 61Благодаря наличию в молекуле
двухосновных карбоновых кислот двух
функциональных групп СООН,
увеличиваются кислотные
свойства
соединения по сравнению с
одноосновными карбоновыми кислотами
аналогичного строения.
Химические свойства
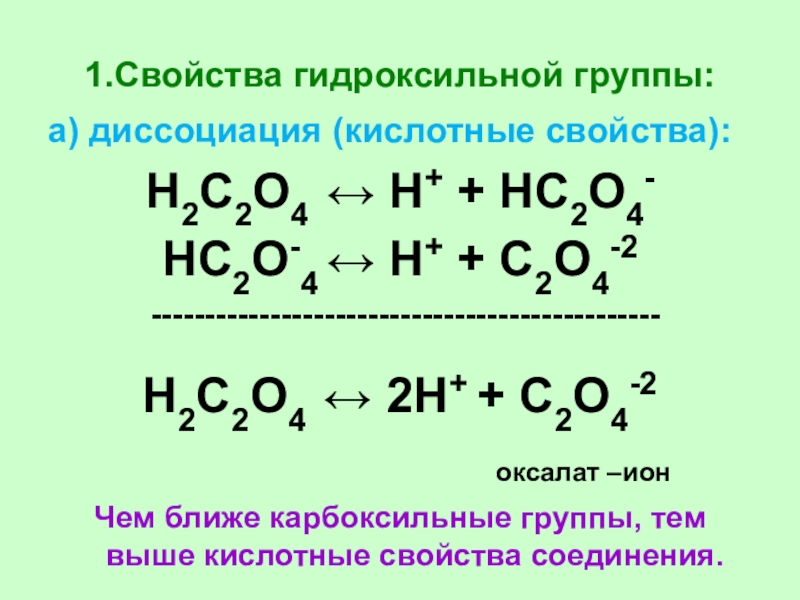
Слайд 621.Свойства гидроксильной группы:
а) диссоциация (кислотные свойства):
Н2С2О4 ↔ Н+ + НС2О4-
НС2О-4
↔ Н+ + С2О4-2
-----------------------------------------------
Н2С2О4 ↔ 2Н+ + С2О4-2
оксалат –ион
Чем ближе карбоксильные группы, тем выше кислотные свойства соединения.
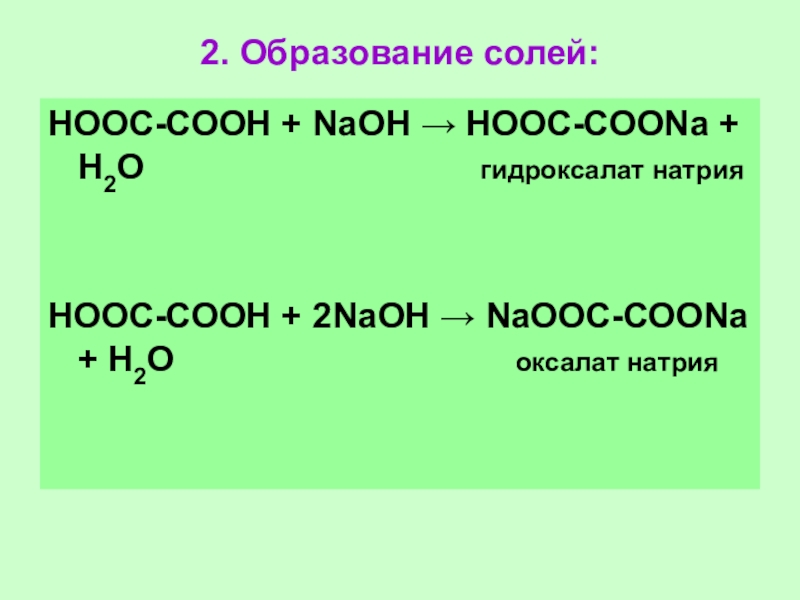
Слайд 632. Образование солей:
НООС-СООН + NаОН → НООС-СООNа + Н2О
гидроксалат натрия
НООС-СООН + 2NаОН → NаООС-СООNа + Н2О оксалат натрия
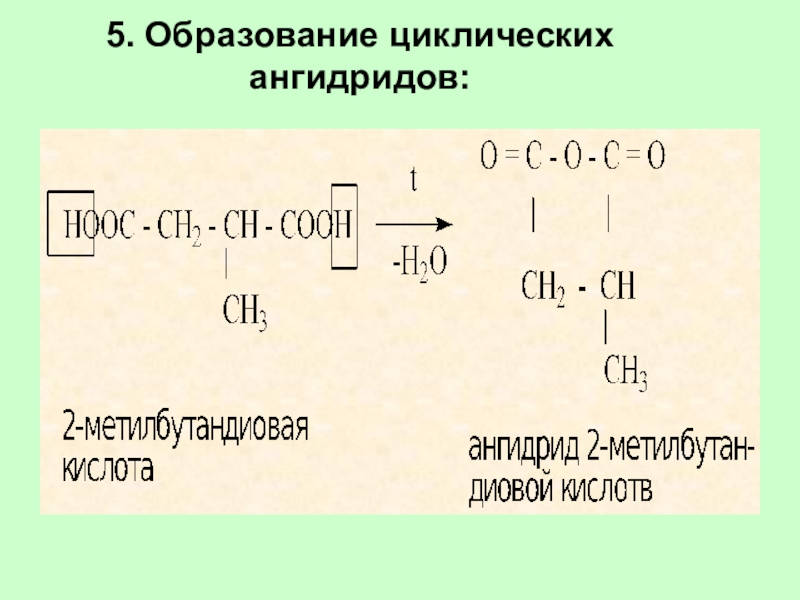
Слайд 665. Образование циклических ангидридов:
Слайд 676.Образование хлорангидридов:
НООС-СООН + РСl5 → НООС-СОСl + Н2О
неполный хлорангидрид
щавелевой кислоты
НООС-СООН + 2РСl5 → СlОС-СОСl + 2Н2О
полный хлорангидрид
щавелевой кислоты
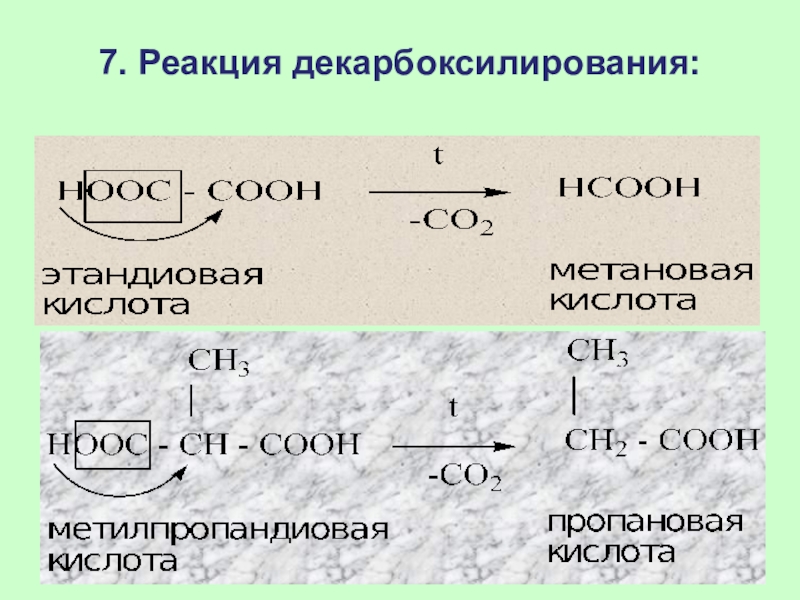
Слайд 698. Реакция окисления:
[О]
НООС-СООН СО2↑ + Н2О
[О] – КМnО4 + Н2SО4
Слайд 709. Качественная реакция на щавелевую кислоту:
НООС-СООН + СаСl2 → ООС-СОО↓ +2НСl
Са
оксалат кальция
белый
Слайд 71Щавелевая кислота
Бесцветное
вещество в виде кристаллов.
Содержится в щавеле, ревене,
шпинате,
клевере и помидорах.
Применяется в текстильной
промышленности, органическом
синтезе, для отчистки
металлов
от ржавчины и накипи.
Слайд 72
Впервые получена в XVII веке
перегонкой янтаря.
Содержится
недозрелых фруктах и буром
угле. Используется, как лекарст-
венное средство. Для получения
пластмасс,
смол, пищевой промы-
шленности используется в качест
ве пищевой добавки E363.
Янтарная кислота
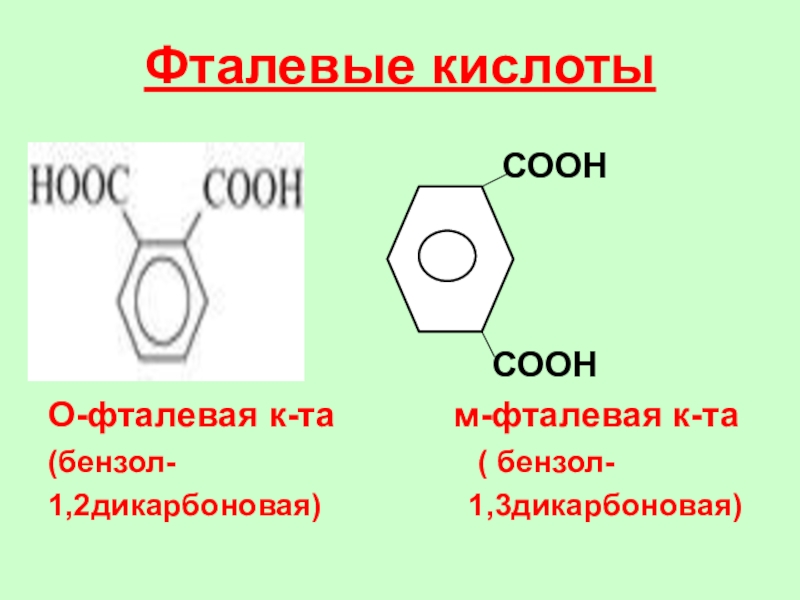
СООН
СООН
О-фталевая к-та м-фталевая к-та
(бензол- ( бензол-
1,2дикарбоновая) 1,3дикарбоновая)
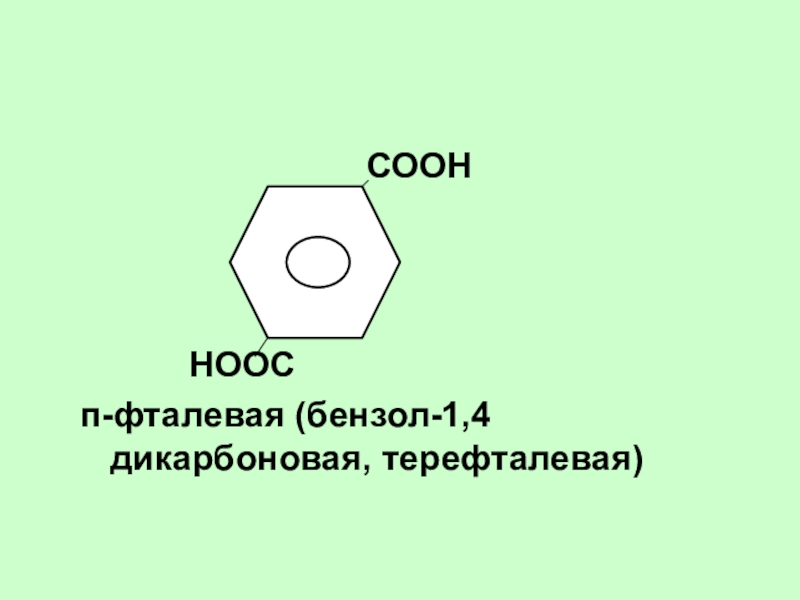
СООН
НООС
п-фталевая (бензол-1,4дикарбоновая, терефталевая)
Слайд 75
Получение
1.Окислением толуола:
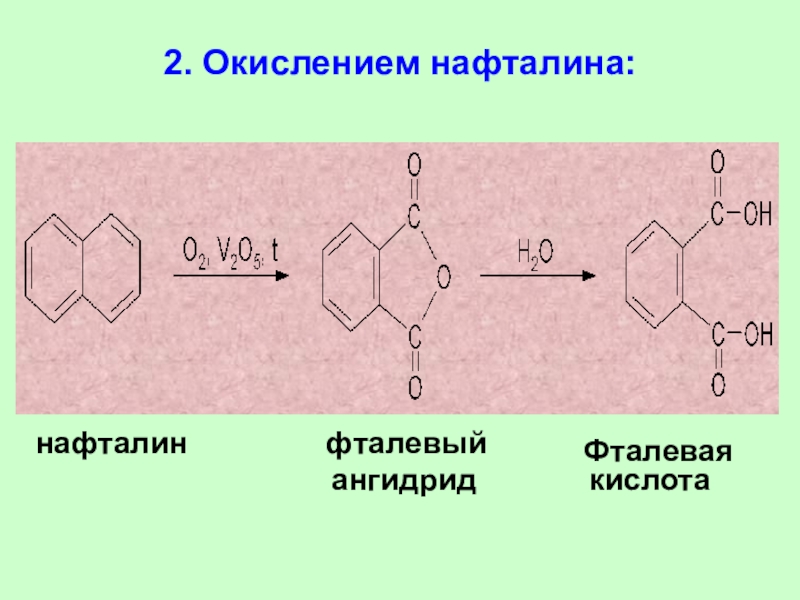
Слайд 762. Окислением нафталина:
нафталин
фталевый
ангидрид кислота
Фталевая
Слайд 78Применение
При конденсации фталевого ангидрида с фенолом в присутствии безводного хлорида
цинка образуется фенолфталеин, который применяется в медицине как слабительное средство
(пурген). Фенолфталеин применяется в химии как индикатор.
Слайд 794. Вопросы и задания.
Что называется карбоновыми кислотами?
Напишите молекулярную и структурную
формулу карбоксильной функциональной группы.
Напишите структурную формулу уксусной кислоты. Каковы её
физические свойства и где она применяется?
Перечислите химические свойства уксусной кислоты.
Слайд 80 5. С какими из ниже перечисленных
веществ будет реагировать
уксусная кислота? Напишите уравнения воз-можных реакций и назовите вещества.
Zn(OH)2, Cu,
NaCl, Mg, BaCO3, FeO, CO2, KOH.
6. Назовите формулу известной вам жирной карбоновой кислоты.
7. Где применяются стеараты натрия и калия?


























![ОРГАНИЧЕСКАЯ ХИМИЯ Карбоновые кислоты 2. Реакция окисления двухатомного спирта:СН2-СООН [О] С-ОН Аg(NН3)2ОНСН2-СООН 2. Реакция окисления двухатомного спирта:СН2-СООН [О] С-ОН Аg(NН3)2ОНСН2-СООН](/img/thumbs/7ce344fcebd880de162fdbfebff17a2a-800x.jpg)