Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основания органические и неорганические
Содержание
- 1. Основания органические и неорганические
- 2. Термин "основание" встречается очень часто в процессе
- 3. 3. Электронная теория Льюиса. Является еще более
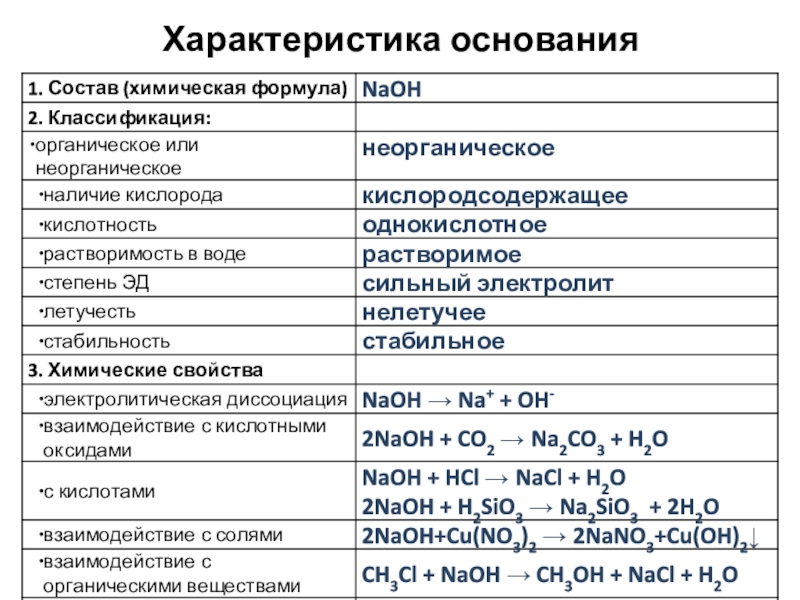
- 4. Характеристика основания
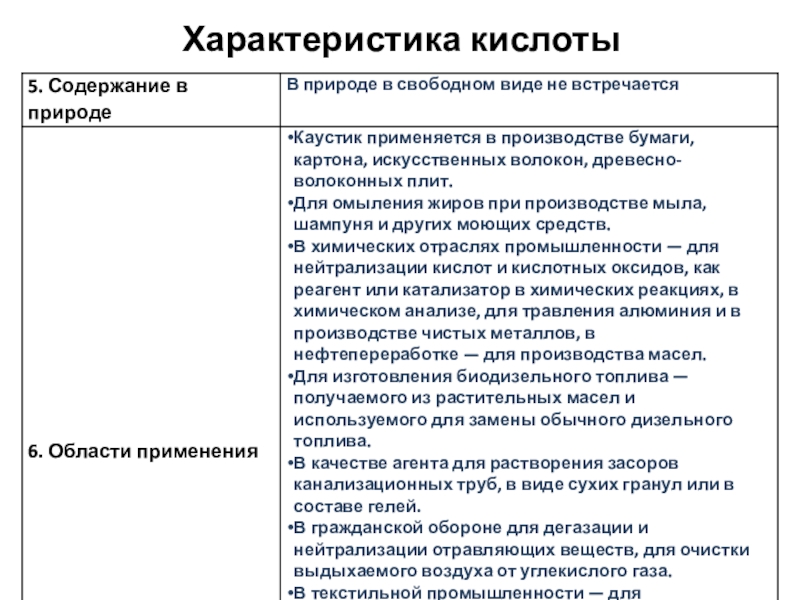
- 5. Характеристика кислоты
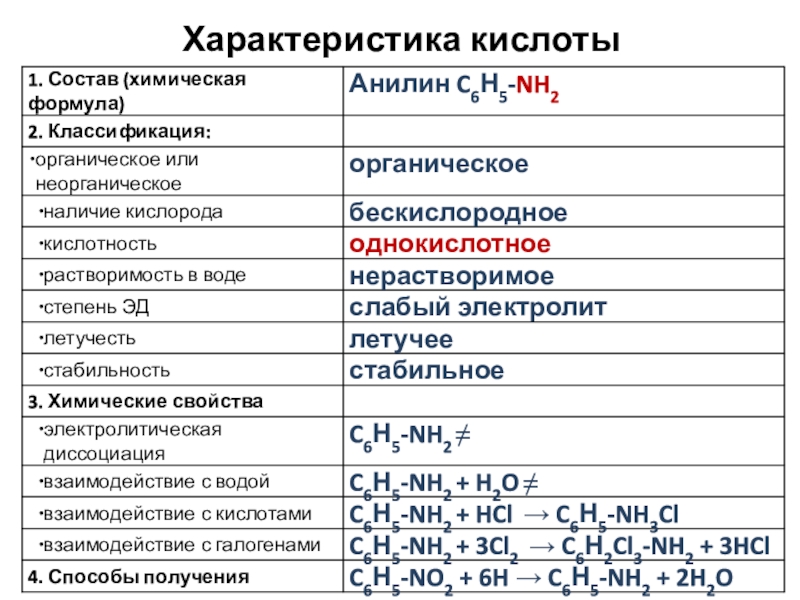
- 6. Характеристика кислоты
- 7. Характеристика кислоты
- 8. 1. Астахов Д. - KOH, этиланин2. Висягин
- 9. Скачать презентанцию
Термин "основание" встречается очень часто в процессе изучения химии, притом как органической, так и неорганической. Ученые впервые задались вопросом: «Что такое «основание» в химии?» еще в XVII веке. Результатом стало возникновение
Слайды и текст этой презентации
Слайд 2Термин "основание" встречается очень часто в процессе изучения химии, притом
как органической, так и неорганической. Ученые впервые задались вопросом: «Что
такое «основание» в химии?» еще в XVII веке. Результатом стало возникновение нескольких теорий кислот и оснований, носящих имена их основателей.Наиболее известных теорий в настоящий момент четыре.
1. Теория электролитической диссоциации Аррениуса-Оствальда. Основана на представлениях о распаде веществ на ионы в водной среде. Согласно этой теории, основаниями являются вещества, при диссоциации образующие гидроксид-анион. Преимуществом ее является возможность классификации кислот и оснований по силе. Недостаток же заключается в применимости только для водных растворов и невозможности объяснения основных свойств веществ, не содержащих гидроксильных групп.
2. Протолитическая теория Бренстеда-Лоури. В данном случае основанием считается вещество, способное присоединять протон (катион водорода). При этом появляется понятие амфотерности – возможности наличия у соединений либо кислотных, либо основных свойств в зависимости от условий. В ней отдельно не рассматриваются основные и кислотные свойства. Основное положение теории – вещество становится тем или другим в присутствии другого соединения в зависимости от их природы. Утверждается, что кислоты и основания обязательно существуют в виде пар соединений. Эта теория является более общей, объясняет основные свойства соединений, не имеющих в молекуле гидроксильных групп, а также позволяет понять, что такое «основание» в органической химии. Именно с помощью теории Бренстеда-Лоури удалось объяснить механизм действия кислотно-основных индикаторов.
Слайд 33. Электронная теория Льюиса. Является еще более расширенной. Она объясняет
механизм миграции протона, описанный в предыдущей теории. Льюис утверждал, что
основание – это такое соединение, которое может выступать донором свободной электронной пары. Примером оснований Льюиса в химии является вода, аммиак. Основность органических соединений также по большей части объясняется данной теорией.4. Обобщенная теория Усановича. В ней принято оперировать зарядами частиц. Так, согласно Усановичу, основание – это частица, которая может присоединять протон или другие катионы, либо отдавать электрон и другие анионы. К сожалению, она не описывает неионогенные процессы. Теория Усановича не была доработана. По сей день учеными предпринимаются попытки довести ее до логического завершения. Ожидается, что в этом случае именно теория Усановича станет наиболее точно и правильно описывающей природу кислотно-основных свойств соединений.
В настоящее время используются все четыре теории в зависимости от рассматриваемых систем.
Слайд 81. Астахов Д. - KOH, этиланин
2. Висягин П. – Са(ОН)2,
триметиламин
3. Емельянова Д. – Fe(OH)3, метиламин
4. Карпова К. – NH3,
дифениламин5. Куриленко А. – Cu(OH)2, этиланин
6. Моисеев И. – Ва(OH)2, фенилэтиламин
7. Никишин С. – LiOH, дифениламин
8. Синяев Н. – Al(OH)3, триметиламин
9. Цвентарный В. – Fe(OH)2, метиламин