Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
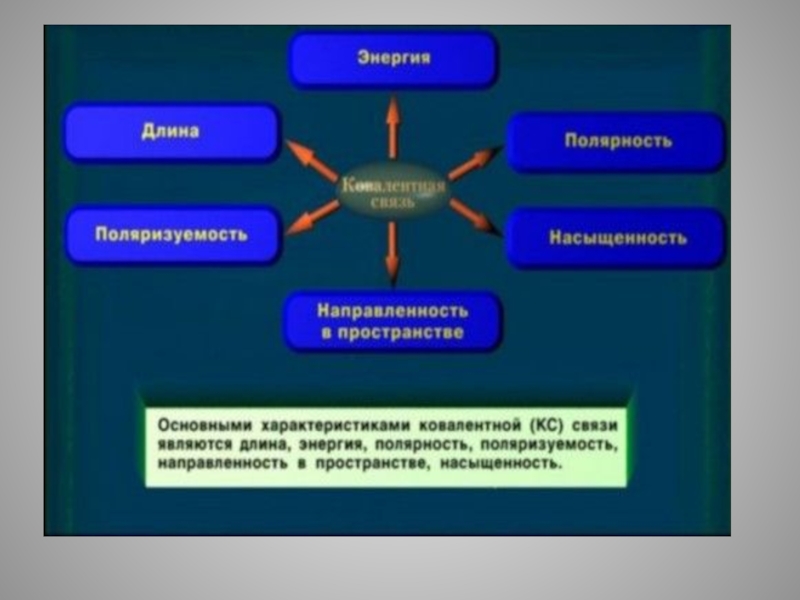
Основные характеристики ковалентной связи
Содержание
- 1. Основные характеристики ковалентной связи
- 2. Слайд 2
- 3. Длина связи- расстояние между химически связанными атомами
- 4. При образовании химической связи всегда происходит сближение
- 5. 1. Длина химической связи элемент–водород в ряду
- 6. 3. Длина связи уменьшается в ряду 1)
- 7. 5. Длина связи увеличивается в ряду :
- 8. 7. Длина связи в ряду H2Te →
- 9. 9. Длина связи Э-Сl увеличивается в ряду
- 10. 10. Длина связи Э-О увеличивается в ряду1)
- 11. Энергия связи. Существенной характеристикой химической связи
- 12. Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов.
- 13. Химическое соединение образуется из отдельных атомов только
- 14. Энергия ковалентной связи зависит от размеров связываемых
- 15. Слайд 15
- 16. Энергия связи увеличивается в ряду:
- 17. Как изменяется энергия связи и межъядерное расстояние
- 18. Наименее прочная химическая связь в молекуле 1)
- 19. 1. Молекула, в которой наиболее прочная химическая
- 20. 3. Прочность углеродной-углеродной связи в ряду этан–
- 21. 4. Установите соответствие между химической связью и ее энергией
- 22. 5.Прочность связи увеличивается в ряду:а) H2O, H2S
- 23. 7. Прочность связи увеличивается в ряду1) NH3,
- 24. Кратность связи- число общих электронных пар, образующих
- 25. 1.Число химических связей в молекулах увеличивается в
- 26. 3. Число химических связей в молекулах увеличивается
- 27. 5.Число химических связей в молекулах уменьшается в
- 28. 7. Число химических связей в молекулах увеличивается
- 29. 9.Число двойных связей увеличивается в ряду1) SO3,
- 30. 11. Число σ-связей уменьшается в ряду1) SF6,
- 31. 13. Число двойных связей увеличивается в ряду1)
- 32. 15.Число двойных связей уменьшается в ряду 1)
- 33. Полярность связи.Полярность химической связи зависит от разности
- 34. Слайд 34
- 35. 1.Полярность связи С-Э уменьшается в ряду1) CO2,
- 36. 3.Полярность химической связи O-Н увеличивается в ряду1)
- 37. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями
- 38. Валентные возможности атома серы:
- 39. Образование иона аммония.Число общих электронных пар может
- 40. Направленность-– определенное направление химической связи, которое возникает
- 41. Слайд 41
- 42. СТРОЕНИЕ МОЛЕКУЛ. РХТУ.
- 43. Слайд 43
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Основные характеристики ковалентной связи.
Молчанова Елена Робертовна.
МБОУ СОШ 144
Красноярск 2009.
Слайд 4При образовании химической связи всегда происходит сближение атомов - расстояние
между ними меньше, чем сумма радиусов изолированных атомов.
Слайд 51. Длина химической связи элемент–водород в ряду соединений
СН4 –
BH3 – BeH2 – LiH:
1) уменьшается;
2) увеличивается;
3) сначала увеличивается, затем
уменьшается;4) сначала уменьшается, затем увеличивается.
2. Химическая связь наименее прочна в молекуле:
1)бромоводорода;
2)хлороводорода;
3)иодоводорода;
4)фтороводорода.
Слайд 63. Длина связи уменьшается в ряду
1) HF, H2, HCl;
2) CO2, SO2, J2O5;
3) H2O, NH3, SiH4;
4) ClF,
HCl, HF. 4. Длина связи наименьшая в молекуле:
1) H2S
2) SF6
3) SO2
4) SO3
Слайд 75. Длина связи увеличивается в ряду :
1)CCl4-CBr4-CF4;
2)SO2-SeO2-TeO2;
3)H2S-H2O-H2Se;
4)P2O5-P2S5-PCl5.
6.
Длина связи увеличивается в ряду:
1) PCl5, PF5;
2) ClF3,
BrF3;3) SnCl4, SiCl4;
4) C2H6, C2H4.
Слайд 87. Длина связи в ряду H2Te → H2Se → H2S
1) не изменяется;
2) увеличивается;
3) уменьшается;
4) сначала уменьшается,
затем растет. 8. Длина ковалентной связи увеличивается в ряду
1) PCl3, PBr3, PH3;
2) NH3, NF3, NCl3;
3) SO2, CO2, NO2;
4) BrCl3, BrF3, HBr.
Слайд 99. Длина связи Э-Сl увеличивается в ряду
1) хлорид углерода
(IV), хлорид сурьмы (III);
2) хлорид мышьяка (III), хлорид фосфора
(III); 3) хлорид олова (IV), хлорид фосфора (V);
4) хлорид ванадия (III), хлорид бора (III).
Слайд 1010. Длина связи Э-О увеличивается в ряду
1) оксид кремния (IV),
оксид углерода (IV); 2) оксид серы (IV), оксид теллура (IV);
3)
оксид стронция, оксид бериллия;4) оксид серы (IV), оксид углерода (IV).
Слайд 11Энергия связи. Существенной характеристикой химической связи является ее прочность. Для
оценки прочности связей обычно пользуются понятием энергии связей.
Слайд 12Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая
для разъединения двух связанных атомов.
Слайд 13Химическое соединение образуется из отдельных атомов только в том случае,
если это энергетически выгодно.
Чем выше энергия химической связи, тем прочнее
связь.Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи.
Слайд 14Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи)
и от кратности связи. Чем меньше атомы и больше кратность
связи, тем больше ее энергия.Энергия связи характеризует ее прочность.
Слайд 17 Как изменяется энергия связи и межъядерное расстояние в рядах:
А) HF,
HCl, HBr, HI
Увеличивается размер галогенов, следовательно увеличивается межъядерное расстояние. Это
значит, что происходит уменьшение энергии связи.Б) NH3, PH3, AsH3
Увеличивается размер элементов 5-й группы с увеличение порядкового номера, следовательно увеличивается межъядерное расстояние. Это значит, что происходит уменьшение энергии связи.
Слайд 18Наименее прочная химическая связь в молекуле
1) О2
2) N2
3) Cl2
4) F2
Ответ:
4
У кислорода связь двойная, у азота – тройная. Фтор, казалось
бы, должен иметь более прочную связь, но на самом деле связь более прочная у хлора. Это связано с тем, что хлор является элементом третьего периода и у него имеется возможность для дополнительного размещения электронов на d-подуровне.Слайд 191. Молекула, в которой наиболее прочная химическая связь:
1) HF;
2)
F2;
3) H2S;
4) O2.
2. Прочность связи увеличивается в
ряду: 1) CBr4, CCl4, CF4;2) CO2, CS2, CCl4;
3) CF4, CH4, CO;
4) CCl4, CF4, CBr4.
Слайд 203. Прочность углеродной-углеродной связи в ряду этан– бензол–этилен–ацетилен
1) увеличивается
2) уменьшается
3)
сначала увеличивается, затем уменьшается
4) сначала уменьшается, затем увеличивается
Слайд 225.Прочность связи увеличивается в ряду:
а) H2O, H2S
б) NH3, PH3
в)
CS2, CO2
г) N2, O2
6. Наименее прочная химическая связь в
молекуле1) фтора
2) хлора
3) брома
4) иода
Слайд 237. Прочность связи увеличивается в ряду
1) NH3, PH3;
2) H2, Br2;
3) CS2, CO2;
4) HBr, HJ.
8.Прочность связи увеличивается в ряду
1) CBr4,
CCl4, CF4;2) CO2, CS2, CCl4;
3) CF4, CH4, CO;
4) CCl4, CF4, CBr4.
Слайд 24Кратность связи- число общих электронных пар, образующих связь.
Расстояние между атомами
существенно уменьшается при образовании кратных связей. Чем выше кратность связи,
тем короче межатомное расстояние.Слайд 251.Число химических связей в молекулах увеличивается в ряду
1) H2O, CO2,
H2S;
2) N2, CH4, O2;
3) NH3, C2H4, PCl3;
4) SO3, C2H6, H2SO4.
2.
Число химических связей в молекулах увеличивается в ряду1) HClO, CO2, HClO3;
2) O2, CF4, Cl2;
3) NF3, C2H2, PCl5;
4) SO2, CH4, H2S.
Слайд 263. Число химических связей в молекулах увеличивается в ряду
1) HClO2,
CO, HCl;
2) O2, CF4, C2H6;
3) HF, C2H2, PF3;
4) SO2,
CCl4, Na2S.4. Число химических связей в молекулах уменьшается в ряду
1) HClO, CO2, HClO3;
2) O2, CF4, PCl5;
3) NF3, C2H2, PCl5;
4) SO3, CH4, H2S
Слайд 275.Число химических связей в молекулах уменьшается в ряду
1) HCl, CS2,
HClO2;
2) CF4, Cl2, Ar;
3) NH3, C2H4, PCl5;
4) S,
H2, SO2.6.Число σ-связей увеличивается в ряду
1) СO2, SO2, NO2;
2) C2H6, CO2, SO3;
3) H2SO4, C2H2, N2;
4) H3PO4, CrO3, C2H4.
Слайд 287. Число химических связей в молекулах увеличивается в ряду
1) NСl3,
C2H6, PCl5;
2) CCl4, Cl2, O2;
3) HJ, CO2, HClO4;
4) As2O3,
F2, SO2.8. Число π-связей уменьшается в ряду
1) СO2, SO2, NO2;
2) C2H2, C2H4, C2H6;
3) H2SO4, C2H2, N2;
4) H3PO4, CrO3, C2H4.
Слайд 299.Число двойных связей увеличивается в ряду
1) SO3, H2SO4, H3PO4;
2) C2H4,
C2H2, NO;
3) NO, CS2, SO3;
4) N2, PCl3O, C3H6.
10. Вещество,
имеющее молекулу с кратной связью1) оксид углерода (IV); 2) хлор;
3) аммиак;
4) сероводород.
Слайд 3011. Число σ-связей уменьшается в ряду
1) SF6, SO2, SO3;
2) H3PO4,
WF6, SiCl4;
3) NH3, HClO4, SiF4;
4) H2SO4, PCl5, JF7.
12.Число двойных связей
уменьшается в ряду1) NO, CS2, SO3;
2) C2H4, C2H2, NO;
3) SO3, H2SO4, H3PO4;
4) N2, PCl3O, C3H6.
Слайд 3113. Число двойных связей увеличивается в ряду
1) SO2, H2SO3, H3PO4;
2)
C2H6, C2H4, NO;
3) СO, CS2, SO3;
4) N2, PCl3O, C3H6.
14.Число σ-связей
увеличивается в ряду1) H2SO4, PCl5, НJ;
2) H3PO4, WF6, SiCl4;
3) NH3, HClO4, SiF4;
4) SО2, SO3, SF6.
Слайд 3215.Число двойных связей уменьшается в ряду
1) NO, CS2, SO3;
2)
C2H4, C2H2, NO;
3) SO3, H2SO4, H3PO4;
4) N2, PCl3O,
C3H6.16. Число двойных связей увеличивается в ряду
1) SO2, H2SO3, H3PO4;
2) C2H6, C2H4, NO;
3) СO, CS2, SO3;
4) N2, PCl3O, C3H6.
Слайд 33Полярность связи.
Полярность химической связи зависит от разности электроотрицательностей связываемых атомов.
Полярность
связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях
атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.Слайд 351.Полярность связи
С-Э уменьшается в ряду
1) CO2, CS2, CCl4;
2)
CF4, C2H6, CO2;
3) Al4C3, CCl4, CF4; 4)CO2, CCl4, CS2.
2. Полярность
химической связи Э-Н увеличивается в ряду 1) H2S, HCl;
2) H2O, HF;
3) NH3, C2H6;
4) H2S, H2Se.
Слайд 363.Полярность химической связи O-Н увеличивается в ряду
1) H2SO4, H3PO4;
2)
HClO4, HClO3;
3) HNO3, Al(OH)3;
4) H3AsO4, H2SO4.
4.Полярность химической связи увеличивается в
ряду1) CO2, SiO2, ZnO, CaO; 2) CaCl2, ZnSO4, CuCl2, Na2O;
3) NaBr, NaCl, KBr, LiF; 4) FeCl2, CoCl2, NiCl2, MnCl2.