Слайд 1Основные объекты исследования молекулярной биофизики и биофизики клетки
Лекция 1
Слайд 2 Биофизика - это наука, изучающая физические и физико-химические процессы,
которые протекают в биологических системах на разных уровнях организации и
являются основой физиологических актов.
Биофизика - интегративная наука, изучающая структуру, физические свойства и характеристики биологических объектов, фундаментальные взаимодействия молекул и молекулярных комплексов, лежащие в основе физиологических реакций и биологических явлений, а также влияние на биологические объекты различных физических факторов (света, ионизирующего излучения, температуры и т.д.).
Слайд 3В трудах основоположника учения о кровообращении, английского врача и анатома
Гарвея (16в-17в) были использованы прямые наблюдения на людях и применено
учение о гидродинамике.
Принципы механики использовал Дж. Борели (17в.) для объяснения физических основ ходьбы, бега, плавания, полета.
В 18 в. в работах Л. Эйлера идеи механики были использованы для создания учения о гемодинамике - движении крови и других биологических жидкостей.
М. В. Ломоносов проводил теоретические работы по термодинамике, в области цветного зрения (теория " трехкомпонентного цветного зрения").
Значительный вклад в развитие биофизики внёс А. Л. Лавуазье. Он доказал, что дыхание животных равнозначно окислению и горению веществ.
В конце 18 в. Л. Гальвани и А. Вольт установили наличие “животного” электричества и химического источника электрического тока в живом организме.
Юлиус Роберт Майер (1814-1878) в 1842 г. дал формулировку первого закона термодинамики для живых организмов.
В 1886 г. немецкий исследователь Ю. Бернштейн зарегистрировал потенциал действия, который возникал и развивался по принципу " всё или ничего".
Г. Гельмгольц в 1856-1867 гг. выпустил трехтомник по физиологической оптике. Он разработал офтальмологическое зеркало, экспериментально обосновал трехкомпонентную гипотезу цветового зрения. В области физиологии слуха разработал резонансную теорию слуха.

Слайд 4В 1920 г. Нобелевская премия присуждена В. Нернсту за создание
ионной теории биоэлектрических явлений (происхождение потенциала действия и покоя).
Следует отметить
труды другого Нобелевского лауреата А. Хилла по термодинамике мышечного сокращения.
Нобелевская премия 1963 г присуждена А. Ходжкину, А. Ф. Хаксли, Дж. Эклсому за создание мембранной теории биоэлектрогенеза.
В 1961 г. биофизика как самостоятельная наука была зарегистрирована на международном уровне созданием Международного союза общей и прикладной биофизики.
Слайд 5Биофизика как наука отвечает трем основным требованиям:
1. имеет свои собственные
цели и задачи
2. имеет собственные объекты
3. имеет собственные методы исследования
Целью
биофизики
является изучение фундаментальных процессов, обеспечивающих основу жизнедеятельности всех без исключения живых организмов, независимо от уровня развития, эволюционной ступени, возраста индивидуума, среды обитания.
Слайд 6В задачи биофизики входят:
изучение на молекулярном уровне
структур субклеточных образований и механизмов их функционирования;
выявление общих законов (закономерностей)
обмена веществ и энергии на уровне клетки и организмов;
исследование молекулярных механизмов транспорта ионов, молекул через многочисленные и разнообразные мембраны, поверхности разделов и фаз;
изучение молекулярных механизмов дыхания, подвижности;
исследование поглощения, размена энергии на химические превращения, влияние их на жизнедеятельность при действии энергии электромагнитных полей, проникающей радиации;
термодинамический анализ сложных систем с использованием законов классической термодинамики и термодинамики неравновесных процессов;
кинетический аналитический подход к изучению сложных систем и предсказание их поведения.
Слайд 7Основные разделы биофизики
Молекулярная биофизика (изучает физическую структуру и физико-химические свойства
биологически важных молекул и физические процессы, лежащие в основе их
функционирования);
Биофизика клетки (изучает особенности строения и функционирования клеточных и тканевых систем, молекулярную организацию и конформационные свойства биологических мембран, процессы транспорта веществ через мембрану, высокоспециализированные функциональные проявления клеток такие как генерация возбуждения и биопотенциалы).
Биофизика органов исследует молекулярные механизмы рецепции, процессы преобразования энергии внешних воздействий в специфические реакции нервных клеток, механизмы кодирования информации в органах чувств.
Биофизика сложных систем изучает проблемы регулирования и саморегулирования сложноустроенных многоклеточных организмов, термодинамику биосистем и поведение во времени разнообразных процессов присущих живой материи.
Слайд 8Разделы биофизики:
Квантовая биофизика изучает структуру электронных энергетических уровней атомов, ионов,
молекул, их донорно-акцепторные свойства, электронные переходы при поглощении квантов света
и пути дезактивации поглощенной энергии, химические превращения электронно-возбужденных молекул, образование фотопродуктов и молекулярные взаимодействия, лежащие в основе фотобиологических процессов и явлений.
Молекулярная биофизика изучает пространственную структуру биополимеров, исследует механизмы функционирования макромолекул.
Биофизика клетки изучает структуру и функции биологических мембран, процессы транспорта веществ через мембрану, биоэлектрические процессы, электропроводность
Слайд 9Разделы биофизики:
Биофизика сложных систем изучает термодинамику и кинетику биологических процессов.
Кинетика
биологических процессов рассматривает скорости и механизмы протекания биохимических реакций, их
взаимосвязь; биохимические реакции, лежащие в основе физиологических процессов и биологических явлений.
Фотобиология исследует влияние видимого и ультрафиолетового излучений на биообъекты, начиная от биополимеров и кончая растительными и животными организмами.
Радиационная биофизика исследует процессы взаимодействия ионизирующего излучения с биовеществом, размен энергии ионизирующего излучения на радиационно- химические реакции, развитие и исходы лучевого поражения как на уровне молекул и субклеточных образований, так и на уровне организма.
Слайд 10Основные объекты молекулярной биофизики:
Белки и нуклеиновые кислоты (информационные макромолекулы,
кодирование информации в которых осуществляется аминокислотным или нуклеотидным алфавитом).
полисахариды
и липиды.
Молекулярная физика изучает физические явления, существенным образом зависящие от атомно-молекулярной природы вещества.
Молекулярная биофизика дает информацию:
о строении молекул на основании изучения их физических свойств;
о природе физико-химических процессов в веществе исходя из его строения.
Основная задача молекулярной биофизики – выяснение связи физической структуры и свойств биологически важных молекул (прежде всего белков и нуклеиновых кислот) с выполняемой ими в организме функцией.
Молекулярная биофизика исследует условия равновесия молекулярных биологических процессов, изменения их течения во времени, термодинамику биологических процессов, изменчивость структуры молекул в зависимости от параметров среды: температуры, ионной силы, рН, наличия определенных ионов.
Слайд 11Живой организм - открытая, саморегулируюшаяся, самовоспроизводящаяся и развивающаяся гетерогенная (неоднородная)
система, важнейшими функциональными веществами которой являются биологические полимеры – белки
и нуклеиновые кислоты сложного атомно-молекулярного строения.
Основные задачи биофизики:
Раскрытие общих закономерностей поведения открытых неравновесных систем. Теоретическое обоснование термодинамических основ жизни.
Научное истолкование явлений индивидуального и эволюционного развития, саморегуляции и самовоспроизведения.
Выяснение связей между строением и функциональными свойствами биополимеров и других биологически активных веществ.
Создание и теоретическое обоснование физико-химических методов исследования биообъектов.
Физическое истолкование всего комплекса функциональных явлений (генерация и распределение нервного импульса, мышечное сокращение, рецепция, фотосинтез и др.)
Биологи задают вопрос «Для чего?», а физики – «Почему?»
Слайд 12В молекулярной биофизике характеристика молекулы включает в себя:
структурную химическую
формулу,
длины всех связей и углы между связями,
распределение зарядов на поверхности,
подвижность отдельных участков
Основная проблема заключается в том, чтобы раскрыть природу взаимодействия атомных групп, определяющих конформационные особенности и внутреннюю динамику биологических макромолекул, механизмы взаимодействия электронных и конформационных переходов и этой основе понять механизм функционирования биополимеров в живых системах.
,
В настоящее время приоритетными считаются следующие вопросы:
1) Изучение структуры и механизмов выражения генов;
2) Разнообразные аспекты клеточной биологии (в том числе хромосомно-генетические исследования, проблемы клеточной дифференцировки и межклеточных взаимодействий);
3) Изучение структуры биополимеров (белков, нуклеиновых кислот, полисахаридов и их комплексов друг с другом и низкомолекулярными лигандами).
Слайд 13Все виды взаимодействий между атомами независимо от их физической природы
при формировании различных макромолекулярных связей можно разделить на 2 основных
типа:
взаимодействия ближнего порядка между атомами соседних звеньев;
дальние взаимодействия между атомами, которые хотя и отстоят по цепи далеко друг от друга, но случайно встретились в пространстве в результате изгибов цепи.
Типы объемных взаимодействий в белковых макромолекулах
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться. Энергия отталкивания дается выражением
E = + k / rn,, где k - постоянная отталкивания, n принимает различные целые значения. Силы межмолекулярного отталкивания действуют на малых расстояниях.
Общее уравнение межмолекулярного взаимодействия при постоянной температуре (уравнение Леннарда-Джонсона) в большинстве случаев имеет вид
EM = − a / r6 + b / r12
и носит название "потенциала 6-12", поскольку энергия притяжения пропорциональна 1 / r6, а энергия отталкивания - 1 / r12.
Слайд 14Химическое соединение образуется из отдельных атомов только в том случае,
если это энергетически выгодно. Если силы притяжения преобладают над силами
отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r0) эта энергия минимальна
Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи.
Слайд 15Электроотрицательность − условная величина, характеризующая способность атома в молекуле притягивать
электроны. Если в двухатомной молекуле А−В образующие связь электроны притягиваются
к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным. Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними.
Предельный случай поляризации химической связи - полный переход электрона от одного атома к другому. При этом образуются два иона, между которыми возникает ионная связь. Для того чтобы два атома смогли создать ионную связь, необходимо, чтобы их электроотрицательности очень сильно различались. Если электроотрицательности атомов равны (при образовании молекул из одинаковых атомов), связь называют неполярной ковалентной. Чаще всего встречается полярная ковалентная связь - она образуется между любыми атомами, имеющими разные значения электроотрицательности.
Количественной оценкой полярности ("ионности") связи могут служить эффективные заряды атомов, характеризуемые разность между числом электронов, принадлежащих данному атому в химическом соединении, и числом электронов свободного атома. Если электроны, образующие связь между атомами, принадлежат им в равной степени, эффективные заряды равны нулю. В ионных соединениях эффективные заряды должны совпадать с зарядами ионов. А для всех других частиц они имеют промежуточные значения.

Слайд 16Электростатические взаимодействия
Этот вид взаимодействий дает не только существенный вклад в
энергию водородной связи, но и играет большую роль в стабилизации
биоструктур. Различные атомы в пептидных цепях существенно различаются по характеру взаимодействия в их частях. Взаимодействие частично заряженных атомов характеризуется электростатическим потенциалом, который в квазиклассическим приближении описывается законом Кулона:
где
- проницаемость, для белков~3,5.
проницаемость, для белков~3,5
Распределение зарядов частично заряженных атомов в трифосфате имеет вид:
Подобное точечное представление, полученное на основе квантовых расчетов, оправдано в тех случаях, когда размеры составляют 60-70% от суммы радиусов Ван-дер-Ваальса, т.е. характерных расстояний, которые определяются дисперсионными, ориентационными и индукционными взаимодействиями.
Слайд 17Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических
связей (с учетом наличия неподеленных пар электронов). Если полярные связи
расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода. Многоатомные молекулы с несимметричным расположением полярных связей (и, следовательно, электронной плотности) являются в целом полярными. Это относится, в частности, к молекуле воды.
Диполь –две точечные частицы с одинаковыми по величине разноимёнными зарядами
Электрический дипольный момент такой системы по модулю равен произведению величины положительного заряда на расстояние между зарядами и направлен от отрицательного заряда к положительному
1873 г. голландский ученый И. Ван-дер-Ваальс предположил,что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название ван-дер-ваальсовых сил. Они включают в себя три составляющие: диполь-дипольное (а), индукционное (б) и дисперсионное (в) взаимодействия.

Слайд 18Силы Ван-дер-Ваальса (ВВ)
Биомакромолекулы можно рассматривать как своего рода конденсируемые
системы, состояния которых определяются относительно слабых невалентных взаимодействий. Именно такие
взаимодействия дают основной вклад к стабилизации конденсации состояния биополимеров и его изменения в процессе функционирования.
ВВ силы играют важнейшую роль в образовании конденсированных жидких и твёрдых состояний. Ими определяются взаимодействия газов и возникающие отклонения законов идеальных газов. Эти отклонения подчиняются уравнению Ван-дер-Ваальса для газов:
,
где a, b - константы притяжения и отталкивания; V -объем
Значения энергии при ВВ взаимодействиях лежат в интервале 4-8 кДж/моль и выше. Энергия при комнатной (температуре) составляет 2,5 кДж/моль, а энергия коллективных ионных связей составляет 150 -600 кДж/моль
Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.

Слайд 19Силы ВВ имеют электромагнитную природу и определяются взаимодействием электрических диполей
молекул. В зависимости от того, обладает ли взаимодействие молекулы электрическим
дипольным моментом, или последнее возникает вследствие поляризации оболочек, существуют различные типы сил ВВ
Ориентационное взаимодействие: полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.
Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород)
Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением:
EК = −2 μ1 μ2 / 4π ε0 r3,
где μ1 и μ2 - дипольные моменты взаимодействующих диполей, r - расстояние между ними.
Слайд 20Индукционное взаимодействие
Если полярная молекула окажется рядом с неполярными, она начнет
влиять на них. Поляризация нейтральной частицы под действием внешнего поля
(наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.
Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением:
EД = −2 μнав2 γ / r6,
где μнав - момент наведенного диполя.
Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях

Слайд 21Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые
находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными
с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
Энергия такого взаимодействия (энергия Лондона) дается соотношением:
EЛ = −2 μмгн2 γ2 / r6,
где μмгн - момент мгновенного диполя.
Лондоновские силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят от размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами
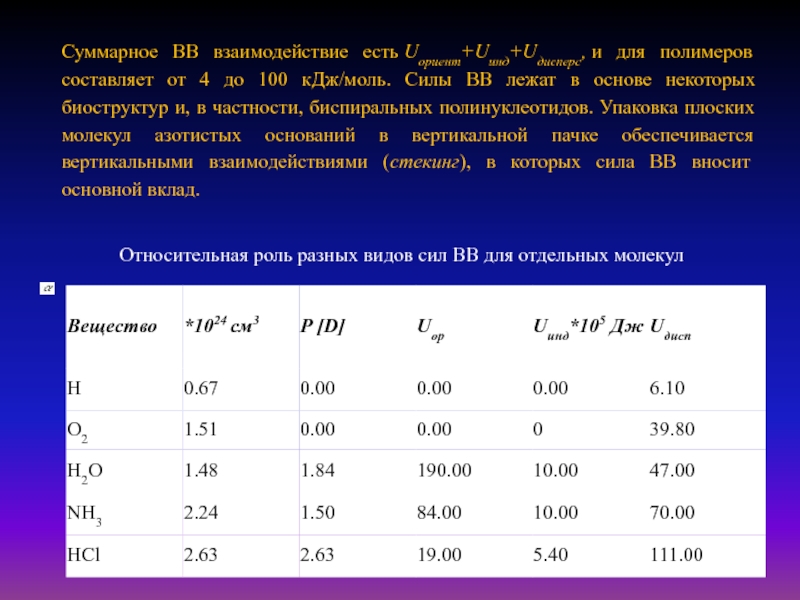
Слайд 22Относительная роль разных видов сил ВВ для отдельных молекул
Суммарное ВВ
взаимодействие есть Uориент+Uинд+Uдисперс, и для полимеров составляет от 4 до 100 кДж/моль.
Силы ВВ лежат в основе некоторых биоструктур и, в частности, биспиральных полинуклеотидов. Упаковка плоских молекул азотистых оснований в вертикальной пачке обеспечивается вертикальными взаимодействиями (стекинг), в которых сила ВВ вносит основной вклад.
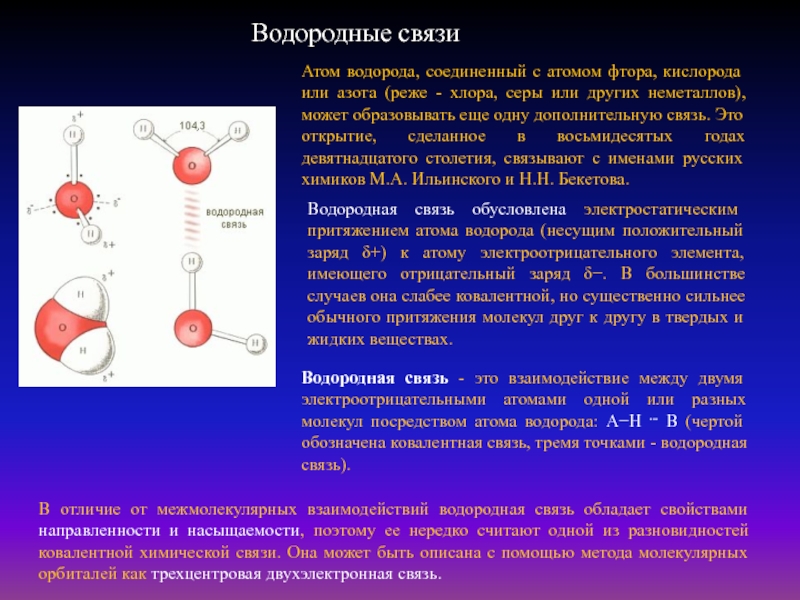
Слайд 23Водородные связи
Атом водорода, соединенный с атомом фтора, кислорода или азота
(реже - хлора, серы или других неметаллов), может образовывать еще
одну дополнительную связь. Это открытие, сделанное в восьмидесятых годах девятнадцатого столетия, связывают с именами русских химиков М.А. Ильинского и Н.Н. Бекетова.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь).
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах.
В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентровая двухэлектронная связь.
Слайд 24Прочные водородные связи образуются в таких жидких веществах, как вода,
фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины.
При кристаллизации водородные связи в этих веществах обычно сохраняются., поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед). Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Водородная связь играет важнейшую роль в стабилизации макромолекулярных структур, в частности, стабилизирует внутреннюю структуру полинуклеотидных цепей.
Если водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца .Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи.
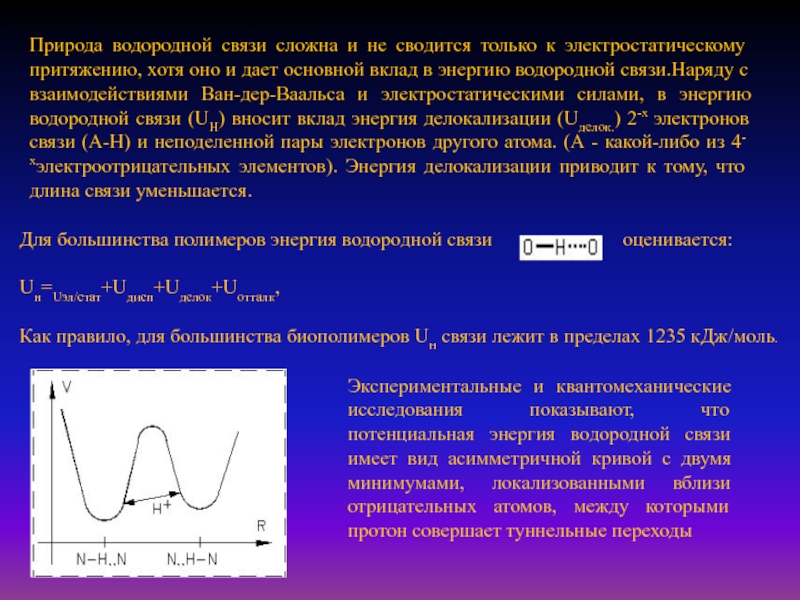
Слайд 25Природа водородной связи сложна и не сводится только к электростатическому
притяжению, хотя оно и дает основной вклад в энергию водородной
связи.Наряду с взаимодействиями Ван-дер-Ваальса и электростатическими силами, в энергию водородной связи (UH) вносит вклад энергия делокализации (Uделок.) 2-х электронов связи (А-Н) и неподеленной пары электронов другого атома. (А - какой-либо из 4-хэлектроотрицательных элементов). Энергия делокализации приводит к тому, что длина связи уменьшается.
Для большинства полимеров энергия водородной связи
Для большинства полимеров энергия водородной связи оценивается:
Uн=Uэл/стат+Uдисп+Uделок+Uотталк,
Как правило, для большинства биополимеров Uн связи лежит в пределах 1235 кДж/моль.
Экспериментальные и квантомеханические исследования показывают, что потенциальная энергия водородной связи имеет вид асимметричной кривой с двумя минимумами, локализованными вблизи отрицательных атомов, между которыми протон совершает туннельные переходы
Слайд 26Вода.
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том
числе воды. Трехатомная молекула Н2О образует четыре водородные связи. В
их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды
Если бы не было водородных связей, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда.
Слайд 27Лиофильность и лиофобность (от греч. lýo — растворяю, philéo —
люблю и phóbos — страх) — качественные характеристики межмолекулярного взаимодействия
вещества и среды, в которой оно находится. Если вещество и среда близки по строению молекул или молекулы вещества сильно взаимодействуют со средой, например, образуют водородные связи, то говорят о лиофильности, при слабом взаимодействии вещества и среды — о лиофобности. В случаях, когда средой служит вода, используют обычно термины «гидрофильность» и «гидрофобность» (от греч. hydro — вода) Общей мерой гидрофильности служит энергия связи молекул воды с поверхностью тела; Гидрофобность следует рассматривать как малую степень гидрофильности, т.к. между молекулами воды и любого тела всегда будут действовать в большей или меньшей степени межмолекулярные силы притяжения. Гидрофильность и гидрофобность можно оценить по растеканию капли воды на гладкой поверхности тела. (краевому углу смачивания)
Слайд 28Гидрофобные взаимодействия в биоструктурах.
Гидрофобное взаимодействие - неспецифическое притяжение, возникающее в
молекуле белка между радикалами гидрофобных аминокислот - вызывается силами Ван-дер-Ваальса
и дополняется выталкивающей силой воды.
Гидрофобные взаимодействия играют существенную роль в формировании биоструктур, представляя собой один из основных факторов их стабилизации. Эффект взаимодействия полярных групп белка с полярными молекулами воды связан с преобладанием полярных аминокислотных остатков на поверхности белковой глобулы. Однако наряду с этим возможно и взаимодействие посредством водородных связей полярных пептидных связей (NH---OC), принадлежащих разным участкам цепи внутри глобулы. Так как энергия водородных связей между пептидными связями в белке и между ними и водой примерно одинакова, это должно было бы приводить к рыхлой структуре макромолекулы в водном растворе. Однако реально существующая структура упорядочена и компактна и, как можно заключить, в основном определяется именно гидрофобными взаимодействиями.
Слайд 29Образование структур из амфифильных молекул
Как правило, гидрофобная часть амфифильного соединения
представляет собой длинную неразветвлённую углеводородную цепь CH3 (CH2)n, где n
> 4, а гидрофильная — полярную функциональную группу типа COOH или ион небольшого размера, например, COO- или N (CH3)3+. Существование полярной и неполярной частей молекулы способствует агрегации частиц с образованием мицелл, бислоев и других структур. Амфифильными свойствами обладают ПАВ, липиды, многие пептиды, белки, полимеры
Отдельные аминокислотные остатки различаются по своим гидрофобным свойствам и могут вести себя как полярные или неполярные соединения. Распределение полярных и неполярных свойств не всегда совпадает с гидрофобностью аминокислот, которые могут проявлять те или иные свойства в зависимости от своего положения и окружения в белке. Взаимодействие неполярных групп с водой приводит к их преимущественному «заталкиванию» внутрь белковой глобулы и соответственно выходу наружу полярных групп. В предельном случае общая топографическая модель белковой глобулы предполагает существование ядра глобулы, заполненного гидрофобными аминокислотами и защищенного слоем обращенных в воду полярных групп

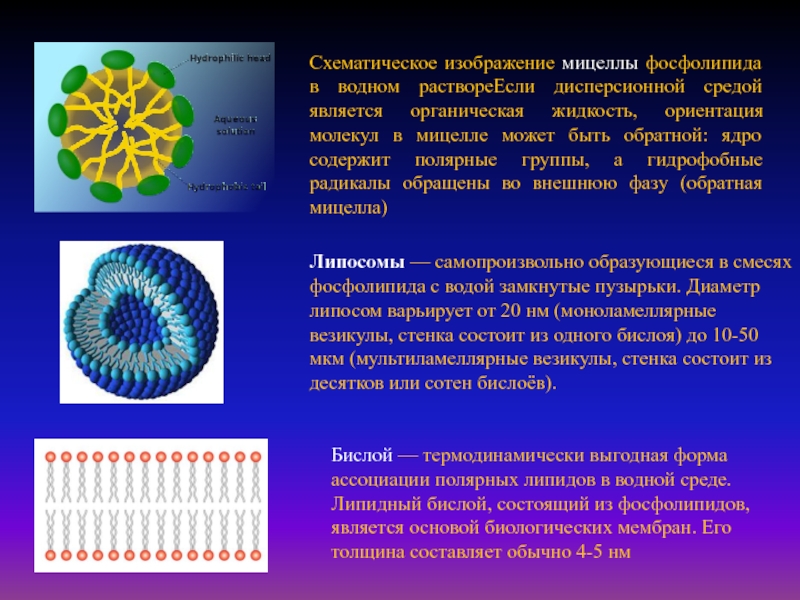
Слайд 30Схематическое изображение мицеллы фосфолипида в водном раствореЕсли дисперсионной средой является
органическая жидкость, ориентация молекул в мицелле может быть обратной: ядро
содержит полярные группы, а гидрофобные радикалы обращены во внешнюю фазу (обратная мицелла)
Липосомы — самопроизвольно образующиеся в смесях фосфолипида с водой замкнутые пузырьки. Диаметр липосом варьирует от 20 нм (моноламеллярные везикулы, стенка состоит из одного бислоя) до 10-50 мкм (мультиламеллярные везикулы, стенка состоит из десятков или сотен бислоёв).
Бислой — термодинамически выгодная форма ассоциации полярных липидов в водной среде. Липидный бислой, состоящий из фосфолипидов, является основой биологических мембран. Его толщина составляет обычно 4-5 нм
Слайд 31Методы исследования
Метод электронной микроскопии. Электронный микроскоп более чем в
500 раз превосходит разрешающую способность оптического микроскопа. Принцип его действия
основан на том, что пучок электронов в магнитном или электрическом поле может сходиться в другой точке оси симметрии или расходиться из другой точки оси, другими словами поток электронов выполняет роль световой волны.
Слайд 32Методы исследования
Метод электронного парамагнитного резонанса – ЭПР – это явление
резкого возрастания поглощения энергии электромагнитной волны системой парамагнитных частиц, помещенных
во внешнее магнитное поле, при резонансной частоте волны νрез. ЭПР основан на взаимодействии магнитных момен-тов неспаренных электронов молекулы с магнитным полем среды. Для ЭПР необходимы спиновые метки:
- Если спин-меченный радикал связывается при помощи ковалентных связей, то это спиновая метка.
-Если спин-меченный радикал связывается за счет электростатических или гидрофобных связей, то это спиновой зонд.
Слайд 33Методы исследования
Метод ядерного магнитного резонанса – ЯМР - это явление
резкого возрастания поглощения энергии электромагнитной волны системой атомных ядер, помещенных
во внешнее магнитное поле, при резонансной частоте волны νрез. ЯМР основан на использовании собственного магнитного момента. ЯМР не модифицирует белки мембраны и поэтому позволяет получить сведения об интактной мембране.
Слайд 34Методы исследования
Метод флюоресцентной спектроскопии.
Используются флюоресцентные зонды, которые
связываются с мембраной. Связывание заряженных молекул зонда с мембраной зависит
от плотности электрических зарядов в ней и при правильно подобранной концентрации интенсивность флюоресценции будет целиком зависеть от флюоресценции связанного с мембраной зонда. Это позволяет определить количество заряженных групп в мембране и величину трансмембранного потенциала.
Слайд 35Методы исследования
Метод радиоактивных меток. Принцип метода состоит в подборе соответствующего
иона, молекулы вещества, введении препарата в среду, клетку, организм и
регистрации скорости его поступления, распределения в объеме, выведении радиоактивной метки.
Слайд 36Методы исследования
Метод регистрации биопотенциалов клетки.
Метод регистрации электропроводности.
Слайд 37Математическое моделирование как отдельный метод биофизики
Математическое моделирование биологических
объектов представляет собой аналитическое описание идеализированных процессов и систем, адекватных
реальным.
Математические модели строятся либо на основе экспериментальных данных либо умозрительно, используя гипотезу или известную закономерность какого-либо явления.
Функциональные модели отражают временные и причинно-следственные отношения между параметрами, характеризующими функции биологического объекта без учета его структуры.
Структурные модели строятся с учетом структуры объекта, отражающей его основные уровни.
Слайд 38Значение биофизики для теоретической и практической медицины:
Исследования в различных
разделах биофизики позволили раскрыть механизмы возникновения и протекания патологических процессов
в организме на молекулярном уровне
Исследования в различных разделах биофизики позволяют наметить пути лечения заболевания
В 1949 г.Лайнус Поллинг показал, что при серповидно-клеточной анемии именно молекула аномального гемоглобина HbS ответственна за приобретение эритроцитами серповидной формы. Он обнаружил, что HbS отличается от HbА лишь тем, что в β-цепях HbS в 6 положении глутаминовая кислота заменена на валин. Понимание молекулярного механизма возникновения серповидно-клеточной анемии позволило найти способ лечения данного заболевания.