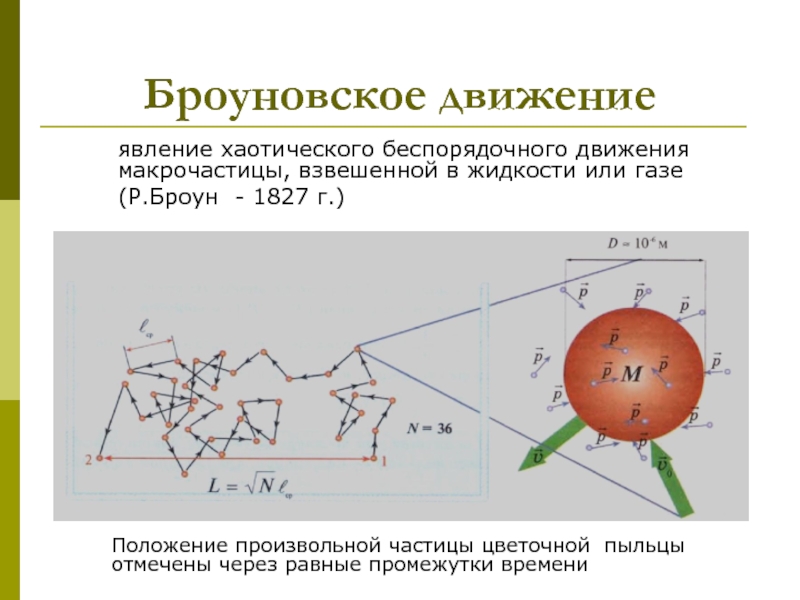
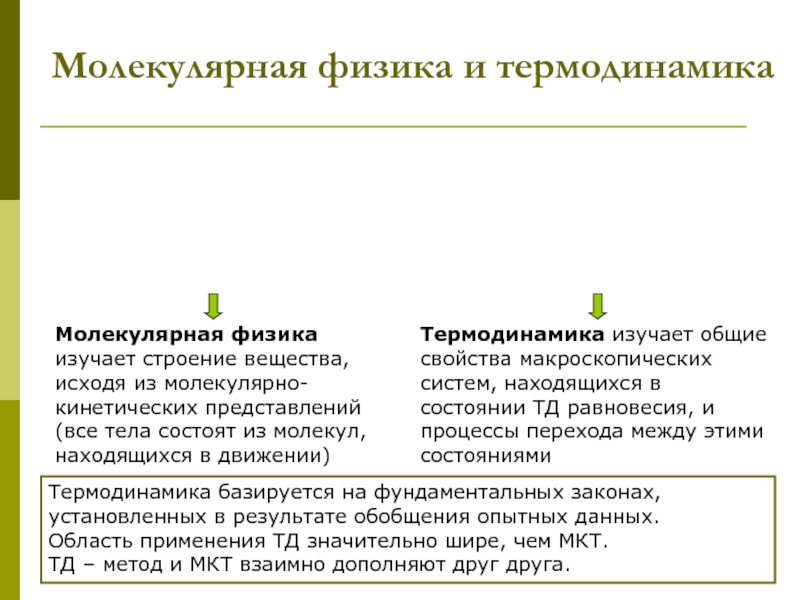
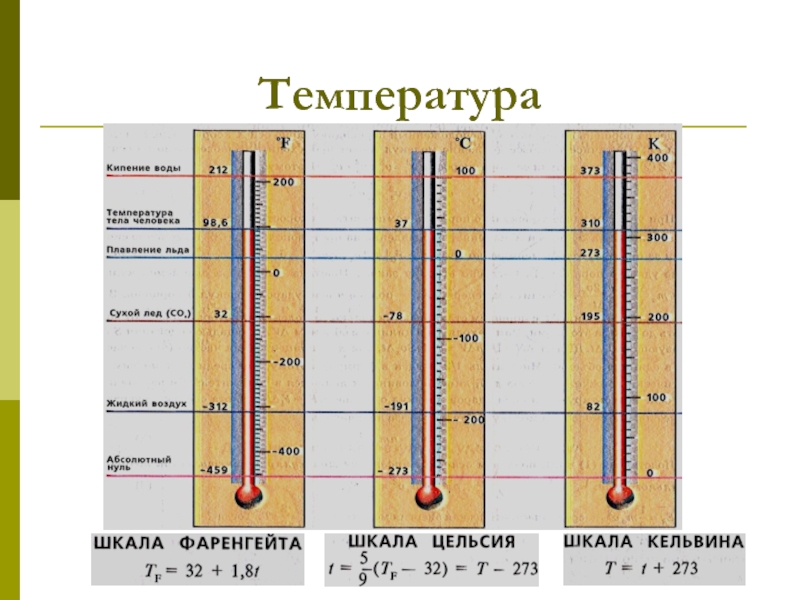
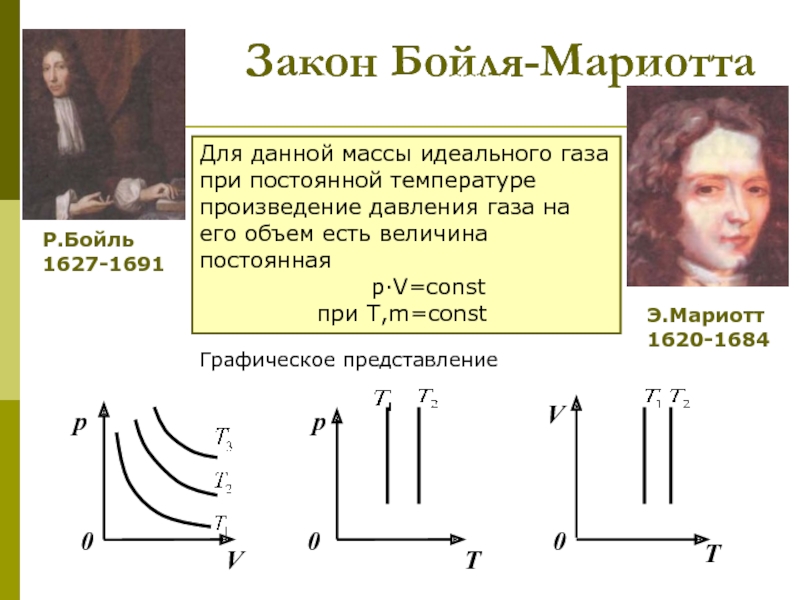
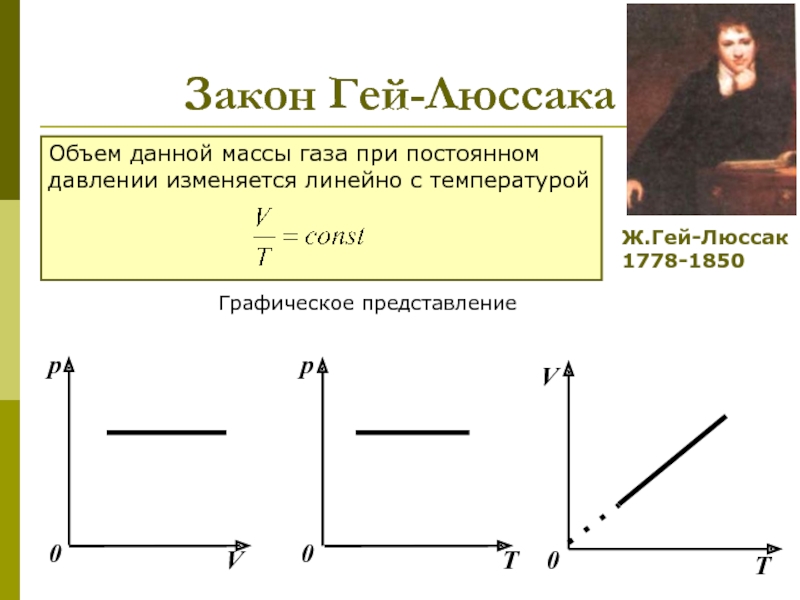
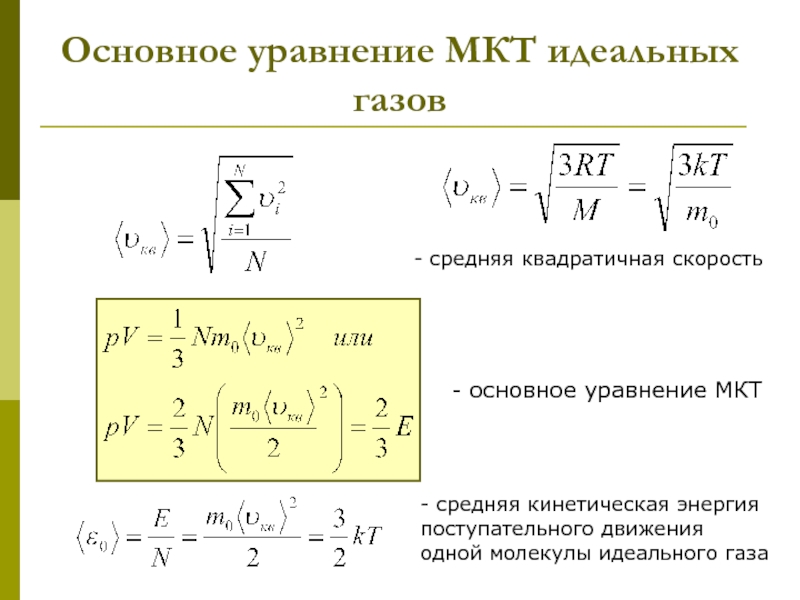
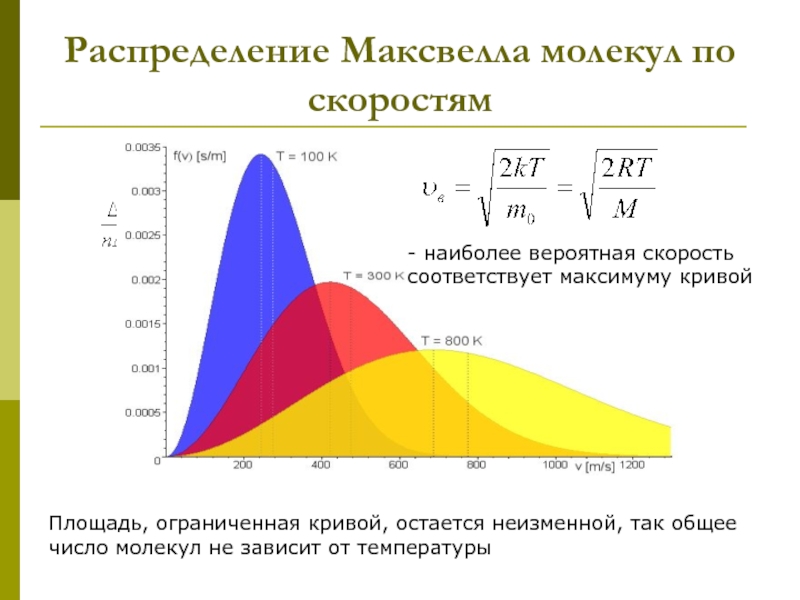
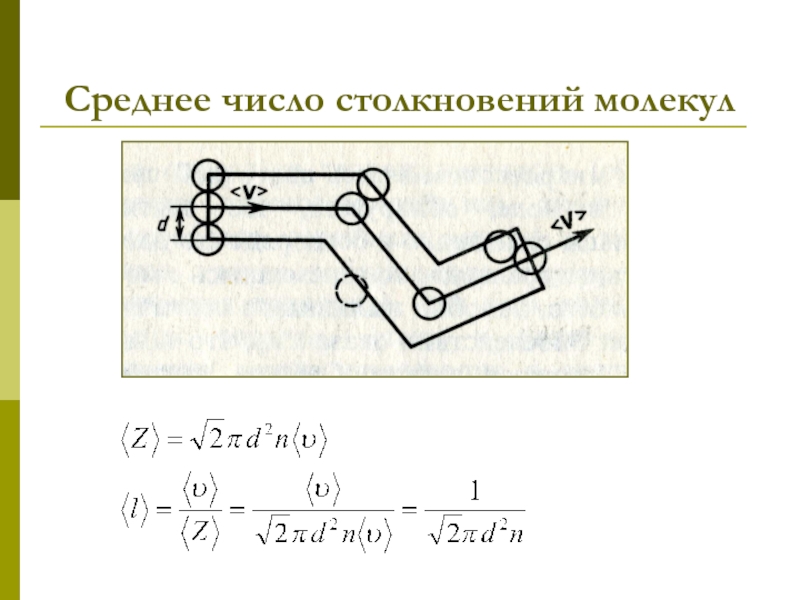
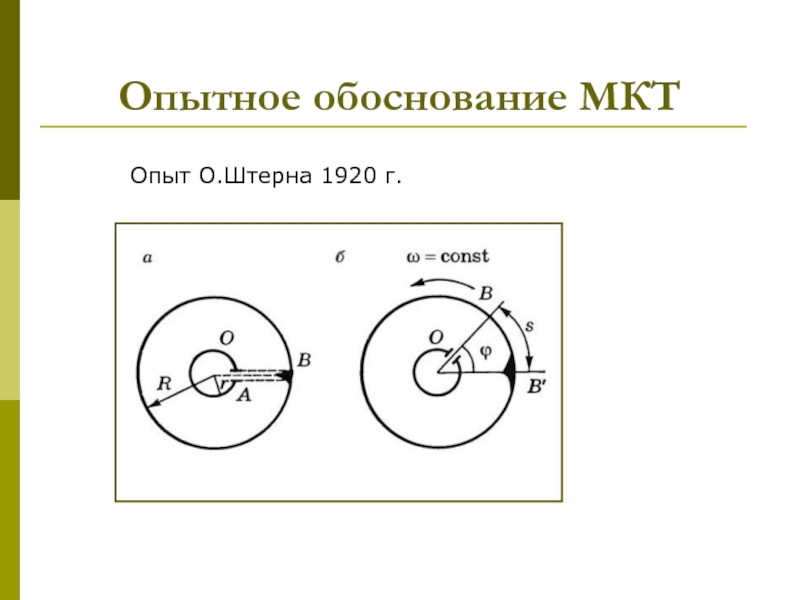
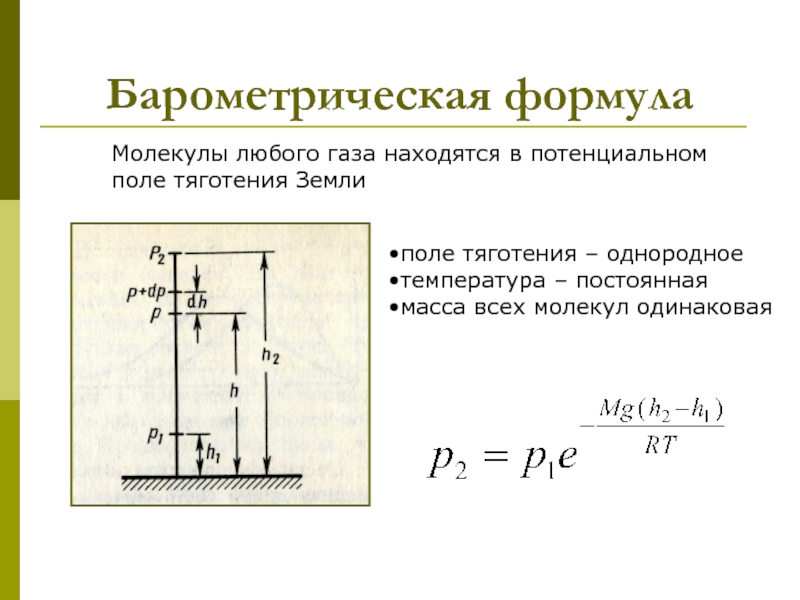
которых изучаются макроскопические процессы в телах, связанные с огромным числом
содержащихся в телах атомов и молекул.Молекула – наименьшая частица данного вещества, сохраняющая его свойства
Атом – наименьшая частица данного химического элемента, сохраняющая его свойства