Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Острая печеночная недостаточность
Содержание
- 1. Острая печеночная недостаточность
- 2. Печень - один из наиболее крупных органов человеческого
- 3. Слайд 3
- 4. Нижняя граница печени у младенца выходит на
- 5. Основные функции печени Печень играет очень
- 6. Слайд 6
- 7. В печени также осуществляется катаболизм белков с
- 8. Роль печени в липидном обмене заключается в
- 9. Печень участвует и в углеводном обмене. В
- 10. Важность роли печени в пигментном обмене также
- 11. Печень участвует в обмене биологически активных веществ,
- 12. Существенна роль печени и в обмене витаминов.
- 13. Печень участвует и в обмене микроэлементов. Здесь
- 14. Печень является одним из основных компонентов функциональной
- 15. Аммиак обезвреживается за счет превращения его в
- 16. Печеночная недостаточностьПод печеночной недостаточностью следует понимать состояние
- 17.
- 18. Острая печеночная недостаточность - симптомокомплекс, основные проявления которого - острое повреждение печени, печеночно-клеточная недостаточность и печеночная энцефалопатия.
- 19. Классификация Классификация Trey и Davidson, 1970 г. Основной признак острой печеночной
- 20. Французская классификация. Острую печеночную недостаточность характеризует быстрое
- 21. Классификация Международной ассоциации по изучению острой печеночной
- 22. Причины печеночной недостаточности у детей
- 23. Слайд 23
- 24. Патогенез При нарушении
- 25. Тяжелые поражения характеризуются некрозами. Некрозы печеночных клеток
- 26. Слайд 26
- 27. Цитолитический синдром представляет собой совокупность всех изменении
- 28. Синдром цитолиза развивается: при отравлении промышленными веществами;
- 29. В развитии синдрома цитолиза выделяют обычно две
- 30. Система окислительного фосфорилирования, имеющая основное значение для
- 31. Дезинтеграция мембран лизосом в связи с нарушением
- 32. БЛАГОДАРЮ ЗА ВНИМАНИЕ!!!
- 33. Скачать презентанцию
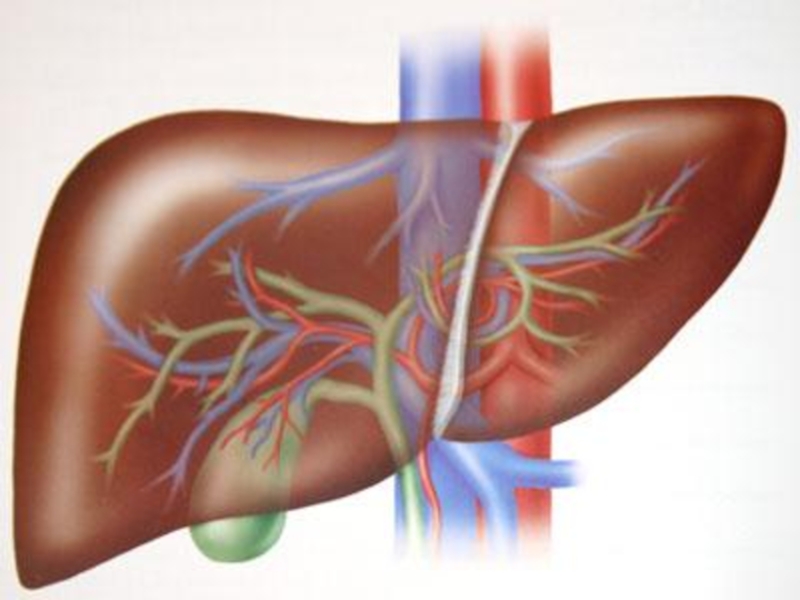
Печень - один из наиболее крупных органов человеческого тела, играющий важную роль в пищеварении и обмене веществ. Относительные размеры и масса печени подвержены значительным колебаниям в зависимости от возраста. Масса печени взрослого
Слайды и текст этой презентации
Слайд 2Печень - один из наиболее крупных органов человеческого тела, играющий важную
роль в пищеварении и обмене веществ.
печени подвержены значительным колебаниям в зависимости от возраста. Масса печени взрослого человека 1300 - 1800 г. Печень новорожденных и детей первого месяца жизни занимает 1/2 или 1/3 (от 5 до 5,5 процентов ) брюшной полости, составляя в среднем 1/18 массы тела, а у взрослых она составляет лишь 1/36 массы тела. Однако уже у трехлетних детей печень имеет такие же соотношения с органами брюшной полости, как и у взрослых. Средняя масса печени при рождении составляет около 135 г.Слайд 4Нижняя граница печени у младенца выходит на 3,5 см из-под
реберной дуги по срединной линии от мечевидного отростка в связи
с короткой грудной клеткой. Верхний край расположен с правой стороны по подмышечной линии между пятым и шестым ребрами. Вертикальный размер печени при рождении - от 5,6 до 5,9 см. Рельеф ее сглажен из-за слабой выраженности углублений, оставляемых прилежащими к печени органами. Левая доля по своим размерам нередко превышает правую или равна ей.Слайд 5
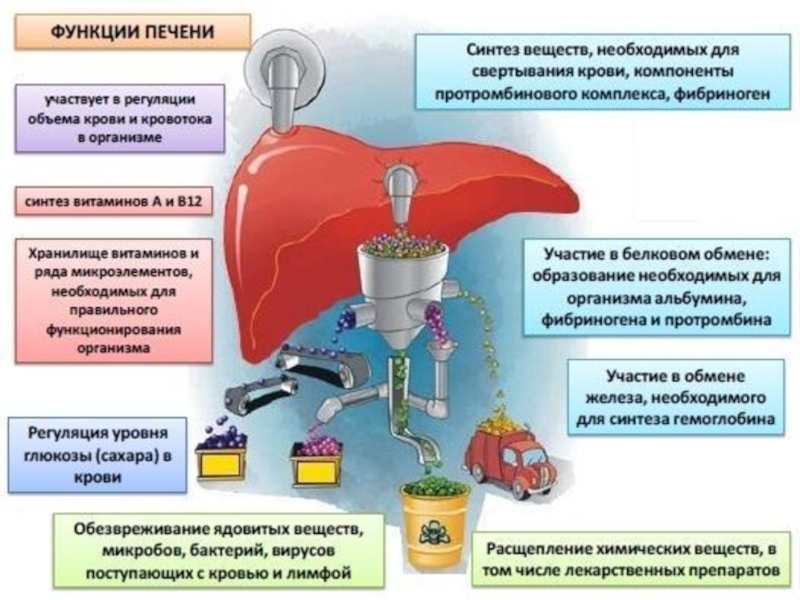
Основные функции печени
Печень играет очень большую роль в белковом обмене.
В ней происходит синтез:
всего альбумина (12-15 г в сутки);
осуществляется
переаминирование и дезаминирование аминокислот с участием ферментов АЛТ, АСТ, глутаматдегидрогеназы;образование мочевины, глютамина, креатина;
В клетках печени синтезируются 75-90% -глобулинов, 50% -глобулинов (-глобулины в печени не синтезируются);
В печени синтезируются компоненты протромбинового комплекса (II, VII, IX, X), зависящие от витамина К, а также другие факторы свертывания (фибриноген, VI, XI. XII, XIII);
Здесь же происходит образование ингибиторов свертывания крови: антитромбина и антиплазмина.
Слайд 7В печени также осуществляется катаболизм белков с участием ферментов катепсинов,
кислой карбоксипептидазы, коллагеназы, дипептидазы;
специфический обмен отдельных аминокислот (90% фенилаланина
превращается в тирозин, из триптофана образуются триптамин, серотонин, хинолиновая кислота; из гистидина - гистамин, из серина - этаноламин, исходный продукт синтеза холина).
Ферменты печени непосредственно отщепляют сероводород от молекул цистеина, катализируют окисление SH-групп серосодержащих аминокислот.
Слайд 8Роль печени в липидном обмене заключается в окислении ацилглицеринов;
образовании
кетоновых тел (ацетоуксусная кислота, -оксимасляная кислота);
синтезе триглицеридов, фосфолипидов, липопротеинов;
синтезе холестерина;
образовании желчных кислот (холевая и хенодезоксихолевая) до 0,4 г/сут.
Печень участвует в расщеплении и всасывании пищевых липидов, так как присутствие желчи необходимо для гидролиза и всасывания жиров в кишечнике. Желчные кислоты находятся в постоянном кишечно-печеночном кругообороте. Через печень и кишечник они проходят до 10 раз в сутки. В гепатоцитах реабсорбированные желчные кислоты заново связываются с глицином и таурином и реэкскретируются в желчь.
Слайд 9Печень участвует и в углеводном обмене.
В ней осуществляется включение
галактозы и фруктозы в метаболизм;
глюконеогенез;
синтез и распад гликогена,
содержание которого в печени составляет 100-300 г; образование глюкуроновой кислоты;
За сутки в печени происходит четырехкратный обмен запасов гликогена.
Слайд 10Важность роли печени в пигментном обмене также трудно переоценить. Она
участвует в:
образовании билирубина;
захвате, конъюгации и экскреции его;
метаболизме
и реэкскреции уробилиногенов. За сутки распадается 1% циркулирующих эритроцитов, высвобождается 7,5 г гемоглобина, образуется до 100-300 мг билирубина. 70-80% билирубина связываемся с глюкуроновой кислотой, а также с глицином, серной и фосфорной кислотами.
Слайд 11Печень участвует в обмене биологически активных веществ, регулируя содержание стероидных
гормонов (глюкокортикоидов, алъдостерона, андрогенов и эстрогенов).
В ней образуются водорастворимые
конъюгаты с глюкуроновой и серной кислотами, происходит ферментативная инактивация, а также образуется специфический связывающий глюкокортикоиды белок – транскортин;инактивируются нестероидные гормоны - инсулин, глюкагон, тиреоидные гормоны, соматотропный, гонадотропный, антидиуретический гормоны.
Кроме того, в печени происходит образование катехоламинов (из фенилаланина в гепатоцитах образуется тирозин, предшественник адреналина, норадреналина, дофамина), их инактивация, а также образование серотонина и гистамина.
Слайд 12Существенна роль печени и в обмене витаминов.
Печень участвует во
всасывании жирорастворимых витаминов (А, Д, Е, К), для чего необходимы
желчные кислоты.В ней осуществляется синтез витамина А из каротина, образуются биологически активные формы витаминов В1 (пиридоксаль-фосфат), фолиевой кислоты (тетрагидрофолиевая кислота), холина (цитидинмонофосфатхолина).
Печень осуществляет депонирование и выведение витаминов А, Д, К, РР, Е, Bl, B2, В12, фолиевой кислоты.
Слайд 13Печень участвует и в обмене микроэлементов.
Здесь находится депо железа
в организме (15 моль/кг ткани у мужчин и 4 моль/кг
у женщин) в виде ферритина (23% железа). При избытке образуется гемосидерин (37% железа). В печени синтезируется трансферрин, транспортирующий железо в кровоток. Кроме того, в печени находится и депо меди, происходит синтез церулоплазмина.Слайд 14Печень является одним из основных компонентов функциональной системы детоксикации.
Именно
в ней в основном происходит биотрансформация ксенобиотиков и эндогенных токсических
субстанций. Печень создает мощный барьер на пути крови, оттекающей от кишечника. В кишечнике под действием ферментов бактерий происходит разложение белка до токсических продуктов: фенола, индола, скатола, кадаверина, путресцина и др. Печень обезвреживает все названные продукты за счет процессов окисления, ацетилирования, метилирования, образования парных соединений с серной и глюкуроновой кислотами.Слайд 15Аммиак обезвреживается за счет превращения его в мочевину. Кроме того,
печень вместе с селезенкой удаляют из протекающей крови и разрушают
до 70-80% микроорганизмов. Купферовские клетки печени обладают не только выраженной фагоцитарной активностью по отношению к микробам, но также обеспечивают очищение крови от эндотоксинов кишечной микрофлоры, комплексов антиген-антитело, продуктов распада тканей.Слайд 16Печеночная недостаточность
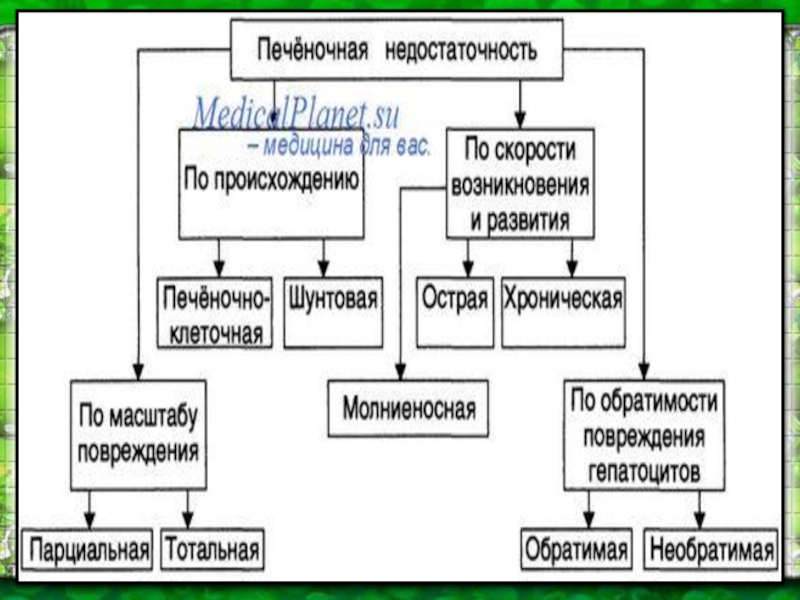
Под печеночной недостаточностью следует понимать состояние организма, при котором
печень не может обеспечить поддержание гомеостаза и потребность организма больного
в обмене веществ, биотрансформации токсинов и биологически активных веществ, то есть печеночная недостаточность – это симптомокомплекс, характеризующийся нарушением одной или многих функций печени вследствие острого или хронического повреждения ее ткани.Слайд 18Острая печеночная недостаточность - симптомокомплекс, основные проявления которого - острое повреждение
печени, печеночно-клеточная недостаточность и печеночная энцефалопатия.
Слайд 19Классификация
Классификация Trey и Davidson, 1970 г. Основной признак острой печеночной недостаточности - развитие
печеночной энцефалопатии в течение 8 недель после появления первых симптомов.
Британская
классификация (Grady О. и соавт.. 1993). Основана на длительности временного промежутка между появлением желтухи и развитием печеночной энцефалопатии:гиперострая печеночная недостаточность (0-7-й день);
острая печеночная недостаточность (8-28-й день);
подострая печеночная недостаточность (29-72-й день);
отсроченная острая печеночная недостаточность (56-182-й день)
Слайд 20Французская классификация. Острую печеночную недостаточность характеризует быстрое начало, удлинение протромбинового
времени или снижение концентрации фактора V на 50% и более,
с проявлениями печеночной энцефалопатии или без них:острая печеночная недостаточность – печеночная энцефалопатия развивается в течение 2 недель после появления желтухи;
подострая печеночная недостаточность - печеночная энцефалопатия развивается между 3-й и 12-й неделями от начала желтухи.
Слайд 21Классификация Международной ассоциации по изучению острой печеночной недостаточности. Для острой печеночной
недостаточности характерно появление печеночной энцефалопатии в течение 4 недель после
появления первых симптомов:гиперострая - в течение 10 дней;
острая - в течение 10 - 30 дней;
без специфических признаков;
подострая печеночная недостаточность (развитие асцита и/или печеночной энцефалопатии спустя 5-24 недели после появления первых симптомов).
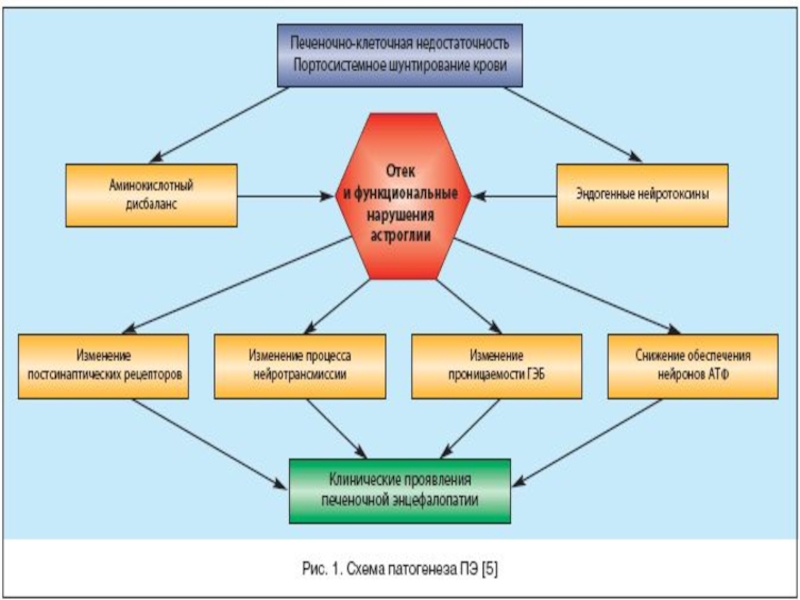
Слайд 24Патогенез
При нарушении белкового и водного
обмена наблюдается увеличение размеров гепатоцитов, появление грубой белковой зернистости в
цитоплазме. При нарушении жирового обмена отмечается заполнение всей клеточной цитоплазмы мелко- или крупнокапельным жиром. Для гипоксии характерно ожирение центров печеночных долек, а при токсемиях, отравлениях — ожирение периферии долек. Изменения углеводного обмена проявляются уменьшением гликогена в печеночной клетке.Слайд 25Тяжелые поражения характеризуются некрозами.
Некрозы печеночных клеток различают в зависимости
от локализации их внутри долек. Центральные некрозы могут быть обусловлены
токсическими факторами, застойным полнокровием, препятствиями току крови по воротной вене и печеночной артерии, аллергическими факторами и пр. Интермедиарные некрозы обусловлены воспалением печеночных долек по периферии. Для массивного некроза печени характерна гибель почти всех печеночных клеток. При токсическом гепатите в печени наблюдается поражение коллагеновых волокон, окружающих лимфатические сосуды. Одновременно в печеночных дольках выявляется мелко- и крупнокапельное ожирение. В первые часы содержание ДНК и РНК увеличивается, а через сутки количество ДНК снижается. Через неделю уменьшается и количество РНК. Развиваются некрозы и фиброз печеночной паренхимы.Слайд 27Цитолитический синдром представляет собой совокупность всех изменении гепатоцитов в их
клиническом, биохимическом и морфологическом проявлении или, по определению Dimitriu и
соавторов, – сложный ансамбль гистологических и гуморальных нарушений в печени, отражающих различную степень повреждения печеночных клеток агрессивными факторами; цитолиз характеризуется прогрессирующим течением, вплоть до некроза клеток.Слайд 28Синдром цитолиза развивается:
при отравлении промышленными веществами;
отмечается при вирусных
гепатитах,
хронических гепатитах и циррозах печени,
может наблюдаться при механической
желтухе, описан при стеатозе печени,
возникает при травматических,
ишемических повреждениях печени,
в случае назначения несбалансированной диеты с дефицитом незаменимых аминокислот,
при перевязке, при воздействии на организм ряда сильных раздражителей (асфиксия, гипоксия, гипотермия, ожоговый шок, судороги, септицемия),
при самых различных патогенных воздействиях на печень (гепатэктомия, ишемизация печени и др.
Слайд 29В развитии синдрома цитолиза выделяют обычно две стадии:
биохимическую или
преморфологическую, носящую обратимый характер,
морфологическую или необратимую.
Основные биохимические
и морфологические проявления синдрома цитолиза носят однотипный характер. Биохимические процессы, лежащие в основе некроза печеночных клеток, сводятся главным образом к нарушению окислительных процессов. В ходе клеточного дыхания происходит образование богатых энергией фосфорных соединений (АТФ), необходимых для жизни клеток.Слайд 30Система окислительного фосфорилирования, имеющая основное значение для жизнедеятельности клеток, находится
и митохондриях гепатоцитов и зависит от концентрации АТФ. При синдроме
цитолиза в митохондриях падает концентрация АТФ и НАД.Прогрессирующее снижение содержания АТФ в митохондриях приводит к нарушениям функции последних по сохранению постоянства электролитов в них.
Следствием этих процессов является нарушение проницаемости клеточных мембран. Внедряющийся из митохондрии кальций тормозит процессы окислительного фосфорилирования.
Длительное нарушение окислительного фосфорилирования приводит к повреждению ряда функций печеночных клеток, требующих расхода энергии; при этом страдает синтез белка, мочевины, гиалуроновой кислоты и др.
Существенную роль в дальнейшем прогрессировании лизиса клетки играют лизосомы.