концентраций исходных веществ (вещество здесь = понятию «молекулярная или ионная
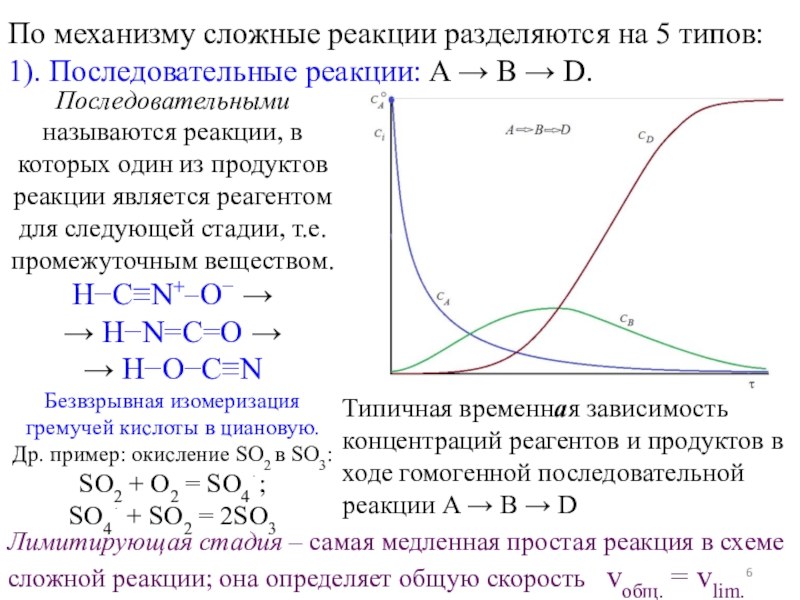
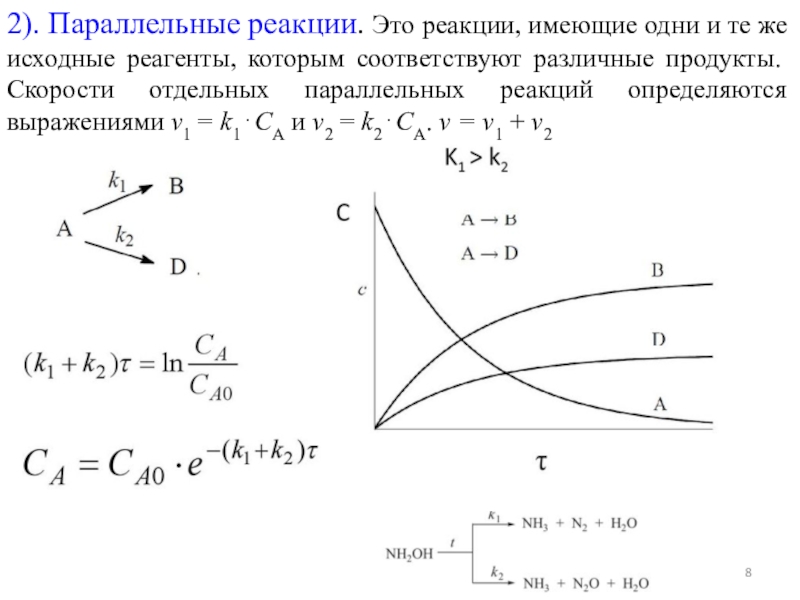
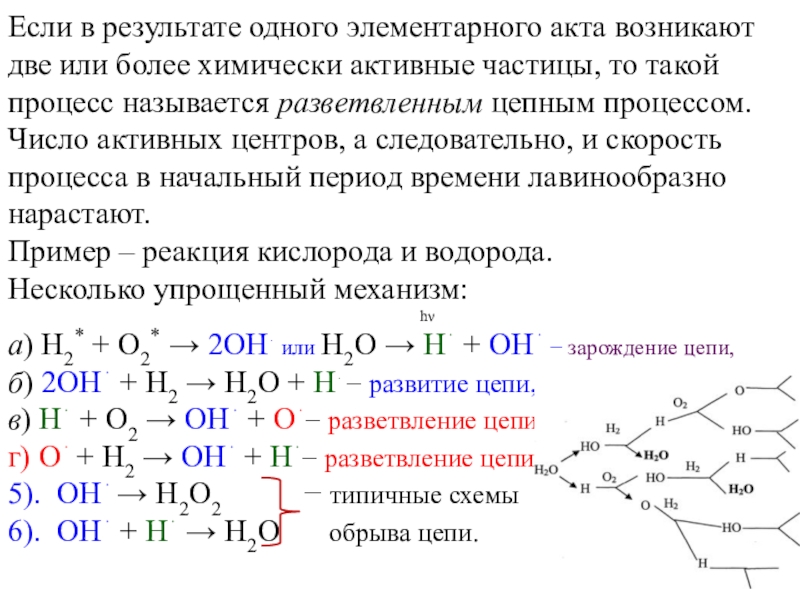
форма»).Простые и сложные реакции
Простые реакции протекают в один элементарный акт.
Молекулярность – это число молекул (исходных веществ), принимающих участие в акте химического превращения.
Мономолекулярная реакция: A B (или A 2B)
v = kCA; или
Тогда
При = 0 Z = CA; тогда ln(CA/ CA) = -k (#)
Окончательно получаем: .