Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Патофизиология воспаления
Содержание
- 1. Патофизиология воспаления
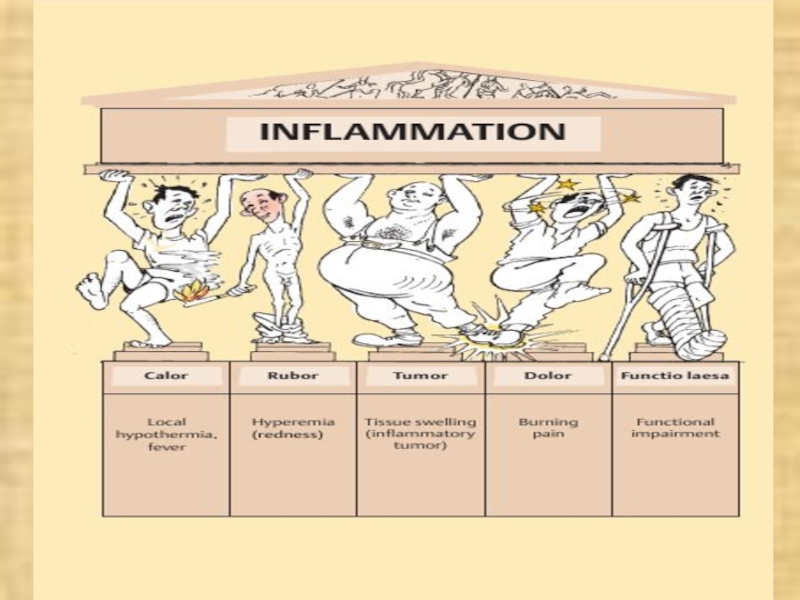
- 2. Термин «воспаление» происходит от латинского слова inflammatio, от греческого слова phlogosis, что условно означает «воспламенение», «жар».
- 3. ВОСПАЛЕНИЕ – это стереотипный, эволюционно сложившийся ответ
- 4. Слайд 4
- 5. Воспаление не местный, а «местнотекущий» процесс, формируемый всем организмом (И.И. Мечников)
- 6. Аутохтонность
- 7. СТАДИИ ВОСПАЛЕНИЯАльтерация (повреждение)Экссудация с расстройством микроциркуляцииПролиферация элементов соединительной ткани
- 8. флогогенный агентальтерацияпролиферацияэкссудация
- 9. СХЕМА ПАТОГЕНЕЗА ВОСПАЛЕНИЯ I. Стадия – Альтерации
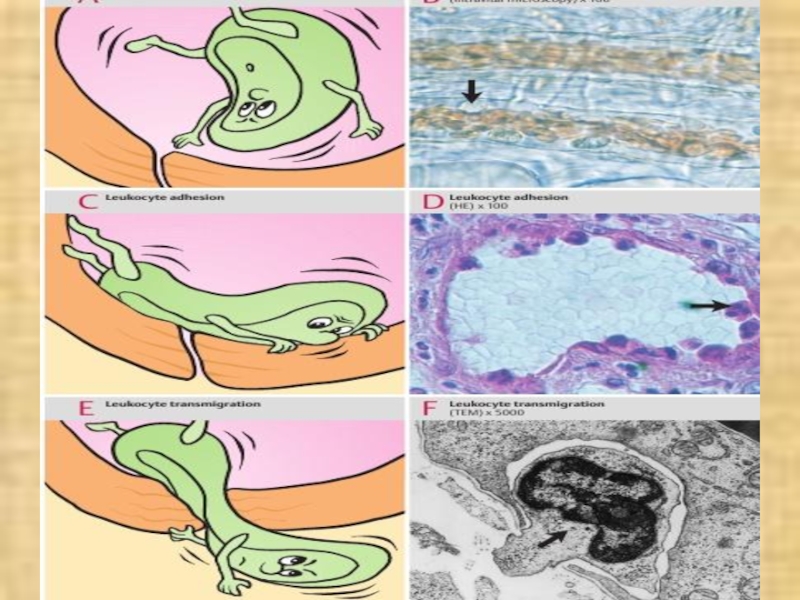
- 10. в) маргинация (margo - край) (краевое стояние)
- 11. Слайд 11
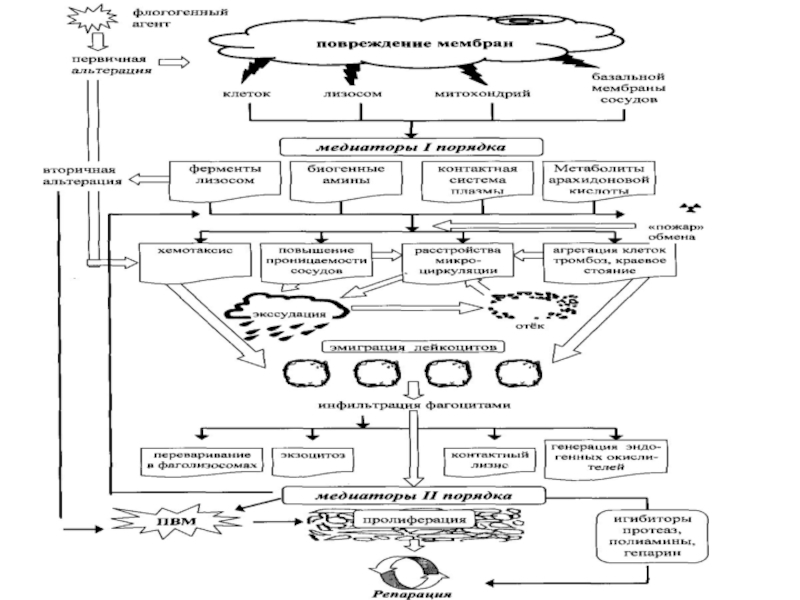
- 12. ппповреждение мембран первичнаяальтерация вторичнаяальтерацияфлогогенный агентклетоклизосоммитохондрий базальной мембраны
- 13. ГУМОРАЛЬНЫЕ И КЛЕТОЧНЫЕ АГЕНТЫ ВТОРИЧНОЙ АЛЬТЕРАЦИИ.Гуморальные агенты:
- 14. катионные антибиотические белки – действуют до развития
- 15. Клеточные агенты (особенно важны при гиперэргических реакциях
- 16. МЕТАБОЛИЧЕСКИЕ ИЗМЕНЕНИЯ В ОЧАГЕ ВОСПАЛЕНИЯУвеличение интенсивности обменных
- 17. Динамика развития воспаления связана с образованием и
- 18. МЕДИАТОРЫ ВОСПАЛЕНИЯ ОБЕСПЕЧИВАЮТ:1. Боль2. Действие на сосуды:
- 19. МЕДИАТОРЫ ВОСПАЛЕНИЯКЛЕТОЧНЫЕ накопленные (имеющиеся, преформированные)система комплементакалликреин-кининовая система
- 20. КОМПЛЕМЕНТКИНИНЫФИБРИНОЛИЗ ФИБРИНО-ОБРАЗОВАНИЕ ВОСПАЛЕНИЕВМКППКXIXIIПРОТЕОЛИЗКОНТАКТ С ПОЛИ-АНИОНАМИ И « - »ЗАРЯЖЕННЫМИ ПОВЕРХНОСТЯМИ
- 21. ппповреждение мембран первичнаяальтерация вторичнаяальтерацияфлогогенный агентклетоклизосоммитохондрий базальной мембраны
- 22. ХЕМОТАКСИС ПОВЫШЕНИЕПРОНИЦАЕМОС- ТИ СОСУДОВРАССТРОЙСТВАМИКРОЦИРКУ-
- 23. СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯI. Кратковременный
- 24. СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯIII. Диффузная
- 25. Слайд 25
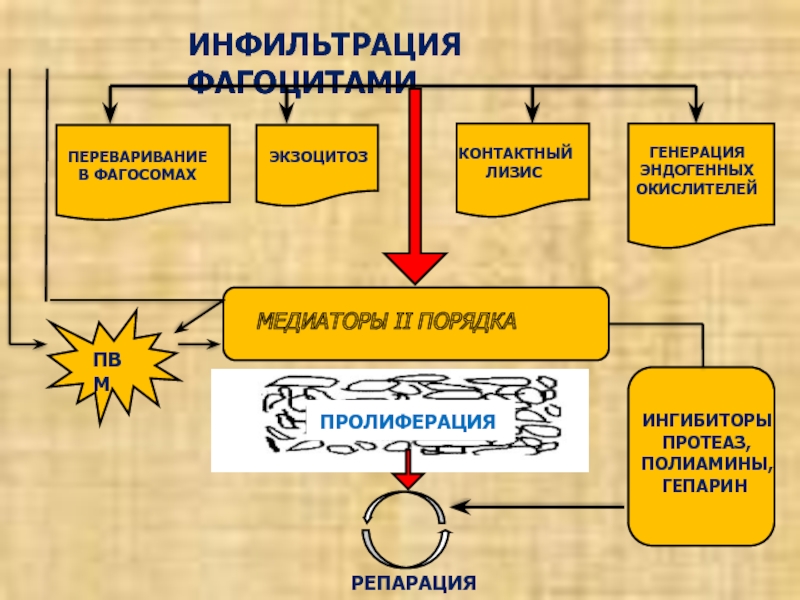
- 26. ИНФИЛЬТРАЦИЯ ФАГОЦИТАМИЭКЗОЦИТОЗКОНТАКТНЫЙ ЛИЗИС ГЕНЕРАЦИЯ
- 27. Слайд 27
- 28. В процессе развития человечества были предложены следующие
- 29. Сосудистые теории Генле (1846), Брокса (1849) и
- 30. Нервно-трофическая теория Самуэля (1873) и более известная
- 31. РАЗЛИЧНЫЕ ВИДЫ (ТИПЫ) СОСУДИСТОЙ ПРОНИЦАЕМОСТИ ПРИ ВОСПАЛЕНИИ
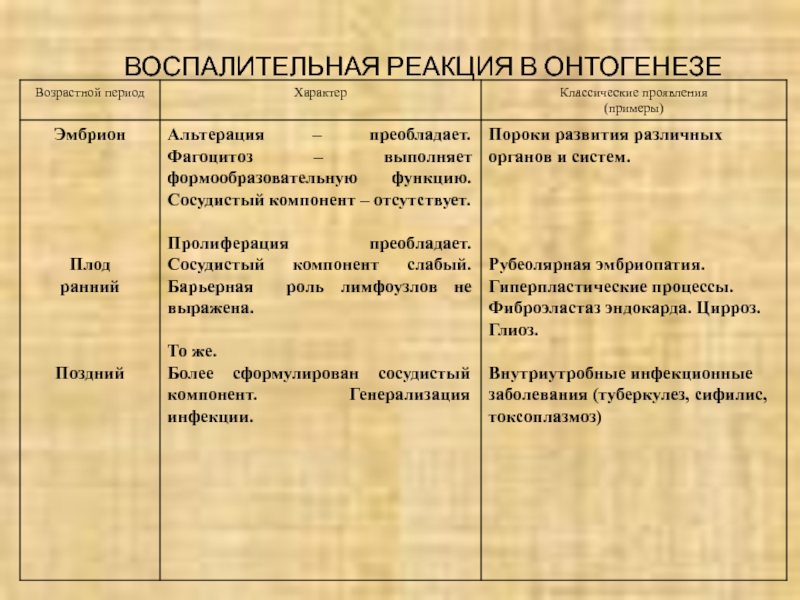
- 32. ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕ
- 33. Слайд 33
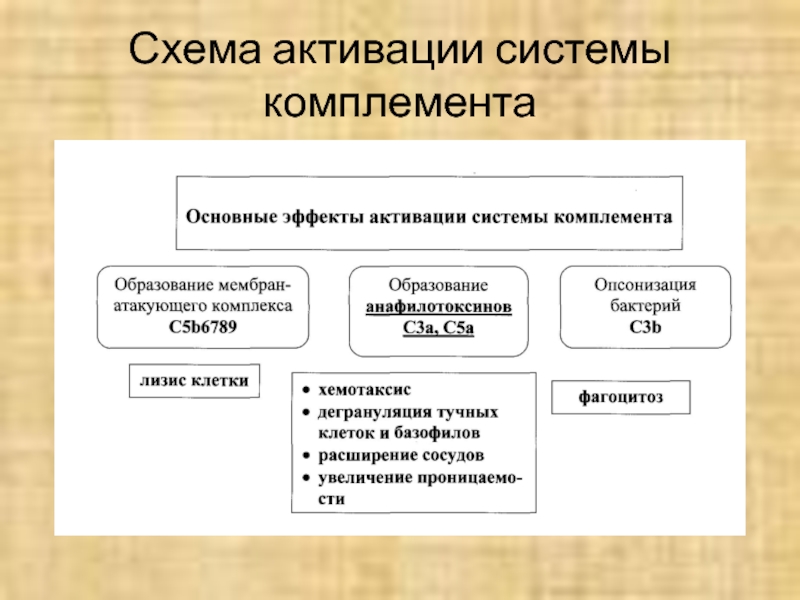
- 34. Схема активации системы комплемента
- 35. Слайд 35
- 36. ПАТОФИЗИОЛОГИЯ ВОСПАЛЕНИЯ II
- 37. Слайд 37
- 38. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВОСПАЛЕНИЯI. Отграничение (изолирование) воспалительного очага
- 39. Три основные положения. Определяющие ответ организма как
- 40. ІІ. При значительных нарушениях местного гомеостаза и(или)
- 41. Согласно второму положению - любое повреждение, сопровождающееся
- 42. ОТВЕТ ОСТРОЙ ФАЗЫ (ООФ)ООФ – ПРЕДСТАВЛЯЕТ СОБОЙ
- 43. ООФ формируется немедленно, вслед за повреждением и тесно связан с механизмами и участниками местного очага воспаления
- 44. Клетки, участники воспаления:лейкоциты, эндотелиоциты, клетки соединительной ткани
- 45. Цель ООФ Представить информацию (сигнализировать) об агрессии
- 46. СХЕМА ОТВЕТА ОСТРОЙ ФАЗЫ
- 47. Начальные, общие, неспецифические признаки (симптомы) ООФ (воспаление,
- 48. БЕЛКИ ОСТРОЙ ФАЗЫс-реактивный белокамилоид А и Рα1-кислый
- 49. ПО ВРЕМЕНИ И СТЕПЕНИ РЕАГИРОВАНИЯ НА
- 50. СВОЙСТВА(функции) БЕЛКОВ ОСТРОЙ ФАЗЫ АНТИОКСИДАНТНЫЕ церулоплазмин,
- 51. Лихорадка — эволюционно сформированная типовая преимущественно защитно-приспособительная
- 52. Механизмы действия пирогенов (на примере ИЛ-1)МакрофагПолиморфно-ядерные лейкоцитыЛимфоцитЛипополисахариды
- 53. Гипертермия – ПРОЯВЛЕНИЯ:высокая температура телаобезвоживание и обессоливание
- 54. ІІІ. При чрезмерном воздействии патогена, его чрезвычайной
- 55. Синдром системного воспалительного ответа – в 10%
- 56. СХЕМА ОТВЕТА ОСТРОЙ ФАЗЫ
- 57. ССВО → синдром полиорганной недостаточности (СПОН) –
- 58. Особенности поддержания температурного гомеостаза у детейШироко распространено
- 59. В течение первых недель после рождения
- 60. Недрожательный термогенез – его большая интенсивность
- 61. Дрожь у новорожденных появляется только при предельных
- 62. Бурая окраска – обильное кровоснабжение + большое
- 63. В надпочечнике ребенка до 3-4 месяцев
- 64. Следовательно, механизм температурной адаптации у данных детей
- 65. Сложность задач объясняется следующим:1. С точки зрения
- 66. 2. Изолирующая прослойка жира поверхностного слоя тела
- 67. Это создает большие проблемы с терморегуляцией. Таким
- 68. Клетки белой крови новорожденных выделяют эндогенные пирогены
- 69. Можно сказать, что лихорадка для детей этой
- 70. Исходы острого экссудативно-деструктивного воспаления (ЭДВ)Выздоровление:полное неполное (образование
- 71. ПРИЧИНЫ (условия) формирования хронического экссудативно-деструктивного воспаления
- 72. Всё это способствуют продолжению альтерации и экссудации
- 73. Мононуклеарно-инфильтративное воспаление (МИВ)-первичное хроническое воспалениеМИВ имеет первоначально
- 74. ПРИЧИНЫ ДЛИТЕЛЬНОГО ТЕЧЕНИЯ МИВ (мононуклеарно-инфильтративного воспаления)Продолжительный жизненный
- 75. Характеристика (особенности МИВ)В очаге повреждения отмечается накопление
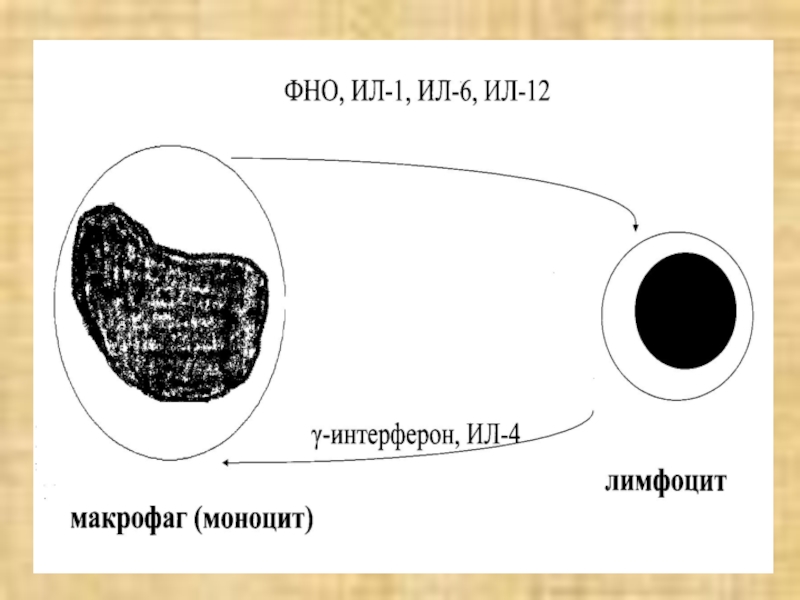
- 76. 3. Макрофаги пролиферируют в очаге воспаления.Цитокины, синтезируемые
- 77. Слайд 77
- 78. 4. Кроме того, данные цитокины способствуют:преобразованию макрофагов
- 79. 7. Длительное присутствие в очаге воспаления сенсибилизированных
- 80. В результате этого, при МИВ наблюдаются:полости ,
- 81. ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕЭмбрион Альтерация – преобладает.
- 82. ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕНоворожденный начальный период грудного
- 83. Положительное значение лихорадкиСпособствует усилению обмена веществ, накоплению
- 84. Отрицательное значение лихорадкиГлубокие нарушения функции всех органов
- 85. Неинфекционные лихорадки у детей1. Молочная лихорадка –
- 86. Абсолюные показания лечения лихорадкиТемпература – 40 при
- 87. Относительные показания Температура – 39-40 Возраст до 5 летНеврологические острые заболевания
- 88. Патогенез лихорадкиВторичные пирогены: ИЛ-1, ФНОα, ИЛ-6, ИЛ-8
- 89. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Термин «воспаление» происходит от латинского слова inflammatio, от греческого слова
phlogosis, что условно означает «воспламенение», «жар».
Слайд 3
ВОСПАЛЕНИЕ – это стереотипный, эволюционно сложившийся ответ организма как целого,
развивающийся в виде типового патологического процесса на
любое повреждение и
проявляющийся в виде поэтапных изменений микроциркуляции, системы крови, стромы органов/тканей, направленных на
локализацию, разведение и уничтожение агента, вызвавшего воспаление и
на восстановление поврежденных тканей
Слайд 5
Воспаление не местный,
а «местнотекущий» процесс,
формируемый всем организмом
(И.И.
Мечников)
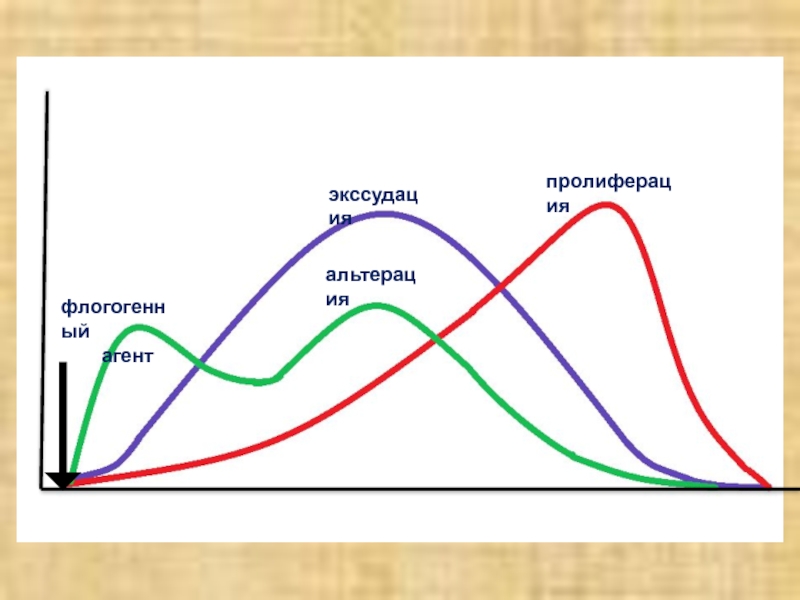
Слайд 7СТАДИИ ВОСПАЛЕНИЯ
Альтерация (повреждение)
Экссудация с расстройством микроциркуляции
Пролиферация элементов соединительной ткани
Слайд 9СХЕМА ПАТОГЕНЕЗА ВОСПАЛЕНИЯ
I. Стадия – Альтерации (повреждение)
а) первичная;
б) вторичная.
II. Стадия – Экссудации (с
расстройством микроциркуляции и эмиграции лейкоцитов)а) сосудистые реакции;
б) собственно экссудация;
Слайд 10
в) маргинация (margo - край) (краевое стояние) и эмиграция лейкоцитов;
г)
внесосудистые процессы: 1 – хемотаксис лейкоцитов; 2 – фагоцитоз.
III.
Стадия – пролиферацииа) действие ПВМ;
б) активация фибробластов;
в) фиброплазия, ангиогенез;
г) репарация.
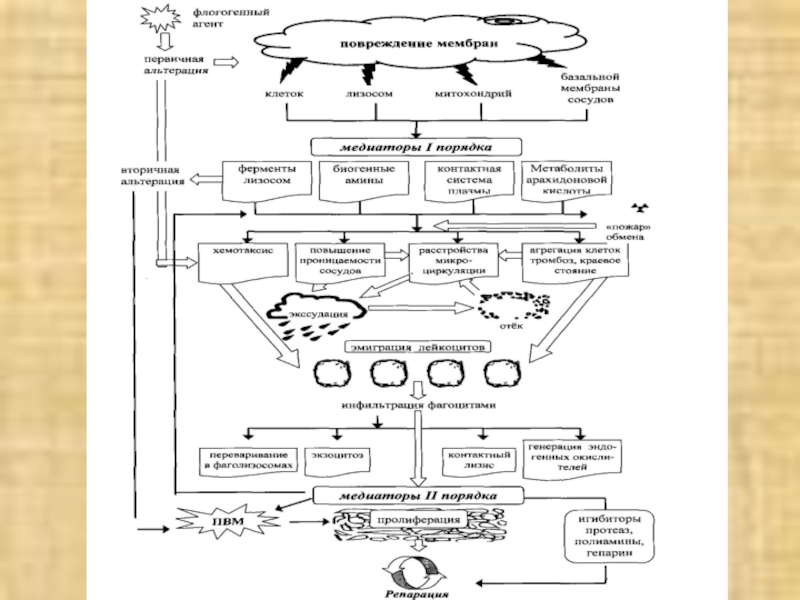
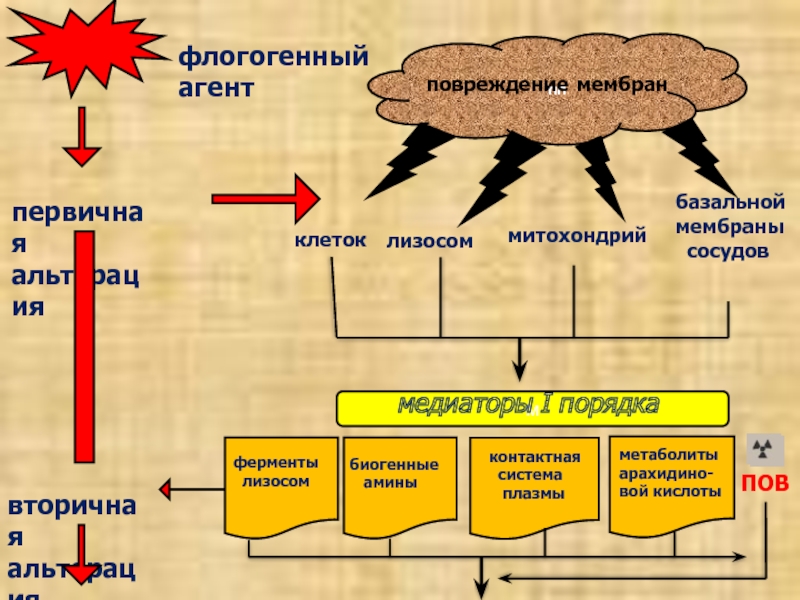
Слайд 12
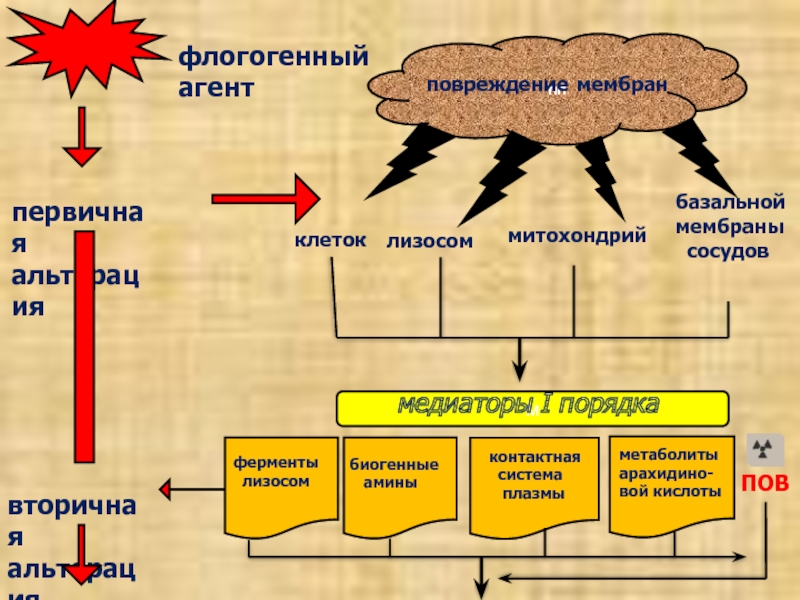
пп
повреждение мембран
первичная
альтерация
вторичная
альтерация
флогогенный агент
клеток
лизосом
митохондрий
базальной
мембраны
сосудов
м
медиаторы
I порядка
биогенные
амины
контактная
система
плазмы
метаболиты
арахидино-
вой кислоты
ПОВ
ферменты
лизосом
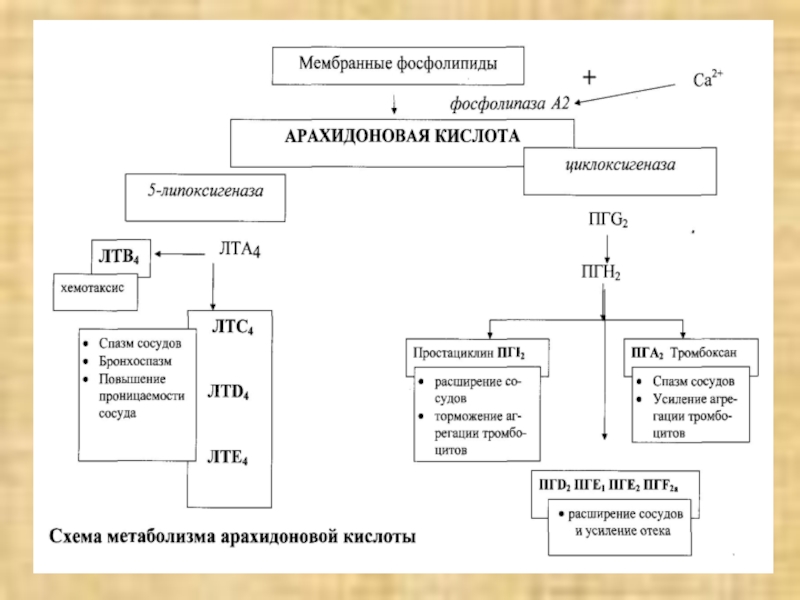
Слайд 13ГУМОРАЛЬНЫЕ И КЛЕТОЧНЫЕ АГЕНТЫ ВТОРИЧНОЙ АЛЬТЕРАЦИИ.
Гуморальные агенты:
активные формы кислорода;
оксид
азота – выделяется макрофагами и эндотелиальными клетками (мощный неселективный цитотоксический
эффект);конечный продукт активации системы комплемента (С5-С9 – мембранно-пробойный эффект);
гидролитические ферменты лизосом;
фактор некроза опухоли (ФНОα и β);
Слайд 14
катионные антибиотические белки – действуют до развития ацидоза (ранняя стадия
бактерицидного и цитостатического эффекта).
К ним относятся
дефинзины, а также азуроцидин и катепсин G. Присутствуют, в основном, в нейтрофилах;
эозинофильные цитотоксические белки (катионный белок эозинофилов и главный основный белок эозинофилов);
лактоферрин – связывает железо в нейтральных и кислых средах
Слайд 15
Клеточные агенты (особенно важны при гиперэргических реакциях замедленного типа):
нейтрофильный и
макрофагальный фагоцитоз;
клеточно-опосредованная цитотоксичность (антителозависимая и антителонезависимая)
Слайд 16МЕТАБОЛИЧЕСКИЕ ИЗМЕНЕНИЯ В ОЧАГЕ ВОСПАЛЕНИЯ
Увеличение интенсивности обменных процессов (2-3 часа
– «пожар» обмена)
Нарушение обмена веществ с формированием:
а)
ацидоза;б) гиперионии;
в) гиперосмии;
г) гиперонкии.
Слайд 17
Динамика развития воспаления связана с образованием и высвобождением его медиаторов.
Медиаторы
воспаления – это химические вещества, регулирующие функции клеток в воспалительном
процессе.Медиаторы воспаления – «моторы» воспаления.
Основной продуцент медиаторов – система мононуклеарных фагоцитов (макрофаг).
Он синтезирует более 50 БАВ (циркулирующий гепатоцит).
Слайд 18МЕДИАТОРЫ ВОСПАЛЕНИЯ ОБЕСПЕЧИВАЮТ:
1. Боль
2. Действие на сосуды:
а) изменения тонуса сосудов,
б) изменение проницаемости сосудов
3. Микротромбоз; фибринолиз
4. Хемотаксис лейкоцитов
5. Активацию фагоцитов
6. Стимуляцию пролиферации
7. Активацию секреторной функции фагоцитов
8. Регуляцию функции иммунной системы
9. Инактивацию клеток (медиаторов) и разрешение воспаления
10. Перестройку нейрогуморальной регуляции и обмена веществ
Слайд 19
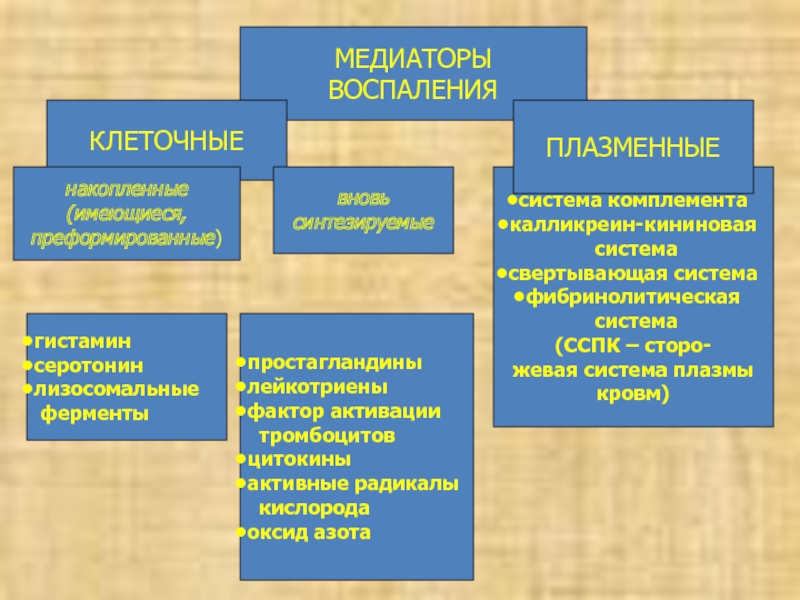
МЕДИАТОРЫ ВОСПАЛЕНИЯ
КЛЕТОЧНЫЕ
накопленные
(имеющиеся,
преформированные)
система комплемента
калликреин-кининовая
система
свертывающая система
фибринолитическая
система
(ССПК – сторо-
жевая система плазмы
кровм)
ПЛАЗМЕННЫЕ
вновь
синтезируемые
гистамин
серотонин
лизосомальные
ферменты
простагландины
лейкотриены
фактор активации
тромбоцитов
цитокины
активные радикалы
кислорода
оксид азота
Слайд 20
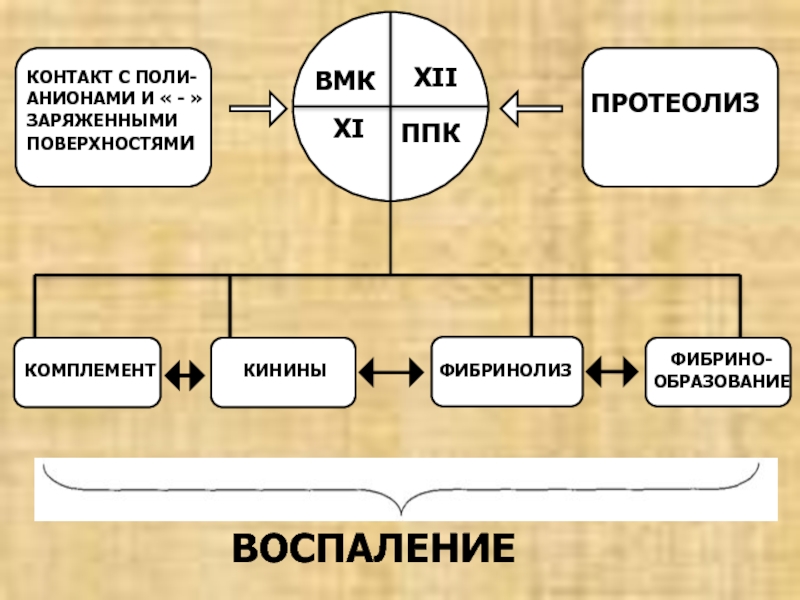
КОМПЛЕМЕНТ
КИНИНЫ
ФИБРИНОЛИЗ
ФИБРИНО-
ОБРАЗОВАНИЕ
ВОСПАЛЕНИЕ
ВМК
ППК
XI
XII
ПРОТЕОЛИЗ
КОНТАКТ С ПОЛИ-
АНИОНАМИ И « - »
ЗАРЯЖЕННЫМИ
ПОВЕРХНОСТЯМИ
Слайд 21
пп
повреждение мембран
первичная
альтерация
вторичная
альтерация
флогогенный агент
клеток
лизосом
митохондрий
базальной
мембраны
сосудов
м
медиаторы
I порядка
биогенные
амины
контактная
система
плазмы
метаболиты
арахидино-
вой кислоты
ПОВ
ферменты
лизосом
Слайд 22
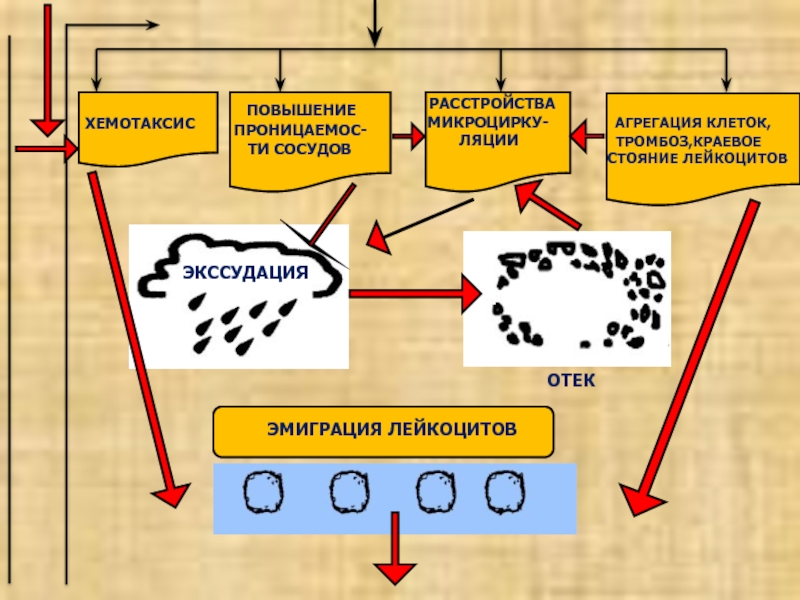
ХЕМОТАКСИС
ПОВЫШЕНИЕ
ПРОНИЦАЕМОС-
ТИ СОСУДОВ
РАССТРОЙСТВА
МИКРОЦИРКУ-
ЛЯЦИИ
АГРЕГАЦИЯ
КЛЕТОК,
ТРОМБОЗ,КРАЕВОЕ
СТОЯНИЕ ЛЕЙКОЦИТОВ
ЭКССУДАЦИЯ
ОТЕК
ЭМИГРАЦИЯ ЛЕЙКОЦИТОВ
Слайд 23СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯ
I. Кратковременный спазм артериол
Нейрогенный механизм
(вазоконстрикция – катехоламины↑)
II. Артериальная гиперемия
Нейрогенный механизм (активация вазодилятаторов)
Гуморальный механизм
(медиаторы воспаления - вазодилятаторы↑)Физико-химический механизм (ацидоз, К+↑ и др.)
↑↑↑ Доставка к тканям О2, энергетических и пластических субстратов, фагоцитов, БАВ (обеспечение эффективности процессов обезвреживания флогогенных факторов и продуктов поврежденных клеток)
Слайд 24СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯ
III. Диффузная «капиллярная» гиперемия (смешанная
гиперемия, воспалительная дилатация капилляров)
Дестабилизация лизосом → высвобождение гидролаз → разрушение
адвентиции сосудов микроциркуляцииВыше названные эффекты (II)
IV. Венозная гиперемия
↓↓↓ Отток крови из очага воспаления:
паралич сосудов
внутрисосудистые препятствия кровотоку (адгезия лейкоцитов, вязкость крови ↑, сладж)
сдавление сосудов экссудатом
↓↓↓ Отток крови из очага воспаления → его локализация – «защитный вал»
V. Престаз, стаз
Следствие длительно действующего выше перечисленных (IV) механизмов
Зона некроза (центр очага воспаления) капиллярно-трофическая недостаточность → гипоксия → некроз
Слайд 26ИНФИЛЬТРАЦИЯ ФАГОЦИТАМИ
ЭКЗОЦИТОЗ
КОНТАКТНЫЙ
ЛИЗИС
ГЕНЕРАЦИЯ
ЭНДОГЕННЫХ
ОКИСЛИТЕЛЕЙ
МЕДИАТОРЫ II
ПОРЯДКА
ПРОЛИФЕРАЦИЯ
ПВМ
ИНГИБИТОРЫ
ПРОТЕАЗ,
ПОЛИАМИНЫ,
ГЕПАРИНРЕПАРАЦИЯ
ПЕРЕВАРИВАНИЕ В ФАГОСОМАХ
Слайд 28
В процессе развития человечества были предложены следующие различные теории происхождения,
сущности и значения воспаления
Защитная теория Гиппократа (IV век до н.э.):
воспаление обеспечивает уменьшение распространения вредного агента по организмТеория Джона Гунтера (XVIII век) рассматривала воспаление как обязательную реакцию организма на повреждение, при помощи которой поврежденная часть тела восстанавливает свои функции.
Нутритивная теория Рудольфа Вирхова (1858): при воспалении отмечают избыточное питание поврежденных тканей, не только клеток, но и межклеточных структур, приводящее к их гипертрофии и пролиферации.
Слайд 29
Сосудистые теории Генле (1846), Брокса (1849) и более известная теория
Юлиуса Конгейма (1867) демонстративно показали динамически развивающиеся при воспалении расстройства
местного кровообращения, реакций сосудов, экссудации и эмиграции лейкоцитов.Биологическая (эволюционная, фагоцитарная) теория ИМ. Мечникова (1892), свидетельствующая о том, что в ответ на то или иное повреждение тканей у организмов, находящихся на различных уровнях эволюционного развития обязательно, хотя и в разной степени, формируется реакция как кровяных, так и тканевых 'микро- и макрофагов.
Слайд 30
Нервно-трофическая теория Самуэля (1873) и более известная
нервно-сосудистая (вазомоторная) теория Г.
Риккера (1924), согласно которой первичным в развитии воспаления считается нарушение
функций сосудисто-двигательных нервов.Физико-химическая (молекулярная) теория Г. Шаде (1923), согласно которой в очаге воспаления всегда развиваются ацидоз, осмотическая гипертензия, повышение онкотического давления и т.д.
Биохимическая (медиаторная) теория В. Менкина (1948), установив шая наличие и разную роль в развитии воспаления флогогенных ФАВ (лейкотаксина, экссудина, фактора лейкоцитоза, пирексина и др.).
Иммунологическая теория XX века, рассматривающая воспаление как обязательную реакцию иммунной системы.
Динамическая теория А. Поликара (первая половина XX века), вскрывшая динамику первичных, вторичных, васкулярных, плазматических, клеточных, нагноительных и восстановительных изменений в воспалительном очаге.
Слайд 31РАЗЛИЧНЫЕ ВИДЫ (ТИПЫ) СОСУДИСТОЙ ПРОНИЦАЕМОСТИ ПРИ ВОСПАЛЕНИИ
I тип –
ранняя преходящая фаза – развивается до максимума в течение 5-10
мин. после повреждения и через 30 мин. снижается. Основная роль принадлежит гистамину – сокращение эндотелиальных клеток венул диаметром до 100 мкм. Вспомогательное значение имеют – брадикинин, лейкотриены, простагландины.II тип – отсроченная, поздняя продленная – начинается через 1-2-3 часа, достигая пика через 4-6 часов (особенно характерна для солнечных ожогов). Длительность не менее 24 часов. При ГЗТ латентный период от 4-6 часов до 6-8 суток. Проницаемость нарушается в венулах и капиллярах. Обеспечивается полипептидными медиаторами (кинины) и цитокинами ИЛ-1, ФНО, γ-интерферон и др. Основа патогенеза – трансцитоз и активация клеточного цитоскелета, повреждение клеточного цемента.
III тип – раннее стойкое повышение проницаемости – при значительной альтерации (тяжелый ожог, инфекция эндотелиотропными возбудителями) сосудистая проницаемость растет в течение первых 30-45 мин. до максимума, держится несколько часов. Медленно снижается в течение нескольких суток. Затрагиваются артериолы, капилляры и венулы. Отмечается некроз, слущивание эпителия, разрыв базальных мембран. В основе развития – действие протеолитических ферментов (гидролаз), лейкотриенов (С4, D4, Е4).
Слайд 38БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВОСПАЛЕНИЯ
I. Отграничение (изолирование) воспалительного очага от остального организма.
Осуществляется путем:
замедления и/или остановки крово- и лимфотока в тканях, прилежащих
к месту очага повреждения;создания вокруг очага лейкоцитарного вала и соединительнотканной капсулы (при хроническом воспалении);
создание в зоне поражения гиперосмии и гиперонкии.
II. Формирование неблагоприятных условий для жизнедеятельности патогенной микрофлоры и ее уничтожение, а так же элюминация собственных, погибших клеток (продуктов их некроза). Достигается следующим образом:
развитием в зоне очага ацидоза, гиперосмии и гиперонкии;
активацией фагоцитоза;
созданием в зоне очага высоких концентраций свободно-радикальных образований, гидролитических ферментов и др. бактериоцидных соединений;
реализацией эффекторных механизмов иммунитета (АТ, АЗКЦ).
III. Восстановление погибших тканей путем пролиферации и регенерации: происходит в основном за счет ангиогенеза, размножения фибробластов и продукцией ими коллагеновых и эластических волокон с формированием рубца.
Слайд 39Три основные положения. Определяющие ответ организма как целого на любое
повреждение
(в том числе и воспаление):
І. Если в очаге происходят
незначительные структурно-функциональные нарушения – местные защитные механизмы справляются самостоятельно - человек практически здоровСлайд 40
ІІ. При значительных нарушениях местного гомеостаза и(или) несостоятельности местных защитных
механизмов возникают
изменения в функционировании ряда органов и систем организма,
что получило название - ответ острой фазы (ООФ) и стресс;Слайд 41
Согласно второму положению - любое повреждение, сопровождающееся заметным нарушением местного
гомеостаза, вызывает и
ряд сложных системных реакций организма,
направленных в
конечном счетена активацию защитных и
регуляторных систем организма.
Слайд 42ОТВЕТ ОСТРОЙ ФАЗЫ (ООФ)
ООФ – ПРЕДСТАВЛЯЕТ СОБОЙ КОМПЛЕКС МЕСТНЫХ И
СИСТЕМНЫХ РЕАКЦИЙ (ИЗМЕНЕНИЙ) ОРГАНИЗМА
ОПОСРЕДУЕМЫХ РАЗЛИЧНЫМИ МЕДИАТОРАМИ
И НАПРАВЛЕННЫХ,
С
ОДНОЙ СТОРОНЫ, НА НЕКРОЗ ПОВРЕЖДЕННЫХ КЛЕТОК, А
С ДРУГОЙ –
НА РЕПАРАТИВНЫЕ ПРОЦЕССЫ
Слайд 43
ООФ формируется немедленно,
вслед за повреждением
и тесно связан с
механизмами
и участниками местного очага воспаления
Слайд 44Клетки, участники воспаления:
лейкоциты, эндотелиоциты, клетки соединительной ткани и др.
выделяют медиаторы
воспаления → цитокины →
это регуляторные клеточные пептиды (сигнальные молекулы)
предназначенные для
обмена информацией между различными клетками органов и тканейСлайд 45Цель ООФ
Представить информацию (сигнализировать) об агрессии (повреждении) другим органам
и системам организма;
Интенсифицировать использование энергии для сдерживания масштабов альтерации;
Создать неблагоприятные
условия для существования флогогенного агентаПотенцировать действие местных и системных механизмов защиты
Слайд 46
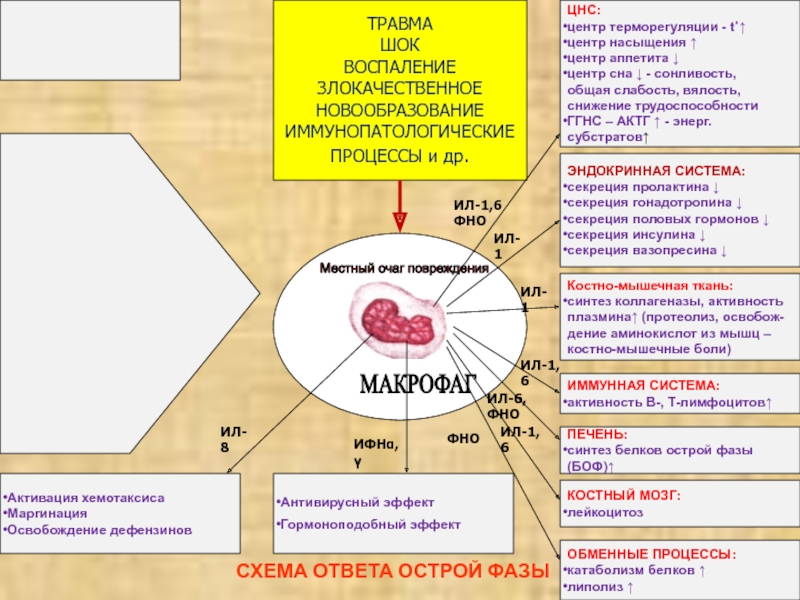
СХЕМА ОТВЕТА ОСТРОЙ ФАЗЫ
МАКРОФАГ
Местный очаг повреждения
ТРАВМА
ШОК
ВОСПАЛЕНИЕ
ЗЛОКАЧЕСТВЕННОЕ
НОВООБРАЗОВАНИЕ
ИММУНОПАТОЛОГИЧЕСКИЕ
ПРОЦЕССЫ
и др. ЦНС:
центр терморегуляции - t˚↑
центр насыщения ↑
центр аппетита ↓
центр сна ↓ - сонливость,
общая слабость, вялость,
снижение трудоспособности
ГГНС – АКТГ ↑ - энерг.субстратов↑
ЭНДОКРИННАЯ СИСТЕМА:
секреция пролактина ↓
секреция гонадотропина ↓
секреция половых гормонов ↓
секреция инсулина ↓
секреция вазопресина ↓
Костно-мышечная ткань:
синтез коллагеназы, активность
плазмина↑ (протеолиз, освобож-
дение аминокислот из мышц –
костно-мышечные боли)
ИММУННАЯ СИСТЕМА:
активность В-, Т-лимфоцитов↑
ПЕЧЕНЬ:
синтез белков острой фазы (БОФ)↑
КОСТНЫЙ МОЗГ:
лейкоцитоз
ОБМЕННЫЕ ПРОЦЕССЫ:
катаболизм белков ↑
липолиз ↑
Антивирусный эффект
Гормоноподобный эффект
ИЛ-8
ИФНα,γ
ИЛ-1,6 ФНО
ИЛ-1
ИЛ-1
ИЛ-1,6
ФНО
ИЛ-1,6
ИЛ-6, ФНО
Активация хемотаксиса
Маргинация
Освобождение дефензинов
Слайд 47Начальные, общие, неспецифические признаки (симптомы) ООФ (воспаление, травмы, злокачественные опухоли,
инфекционные процессы и др.)
Общая слабость, разбитость, вялость,снижение трудоспособности
Сонливость, заторможенность
Костно-мышечные, суставные
болиГипо- и анорексия, явления диспепсии
Лихорадка
Лейкоцитоз
СОЭ ↑
Слайд 48БЕЛКИ ОСТРОЙ ФАЗЫ
с-реактивный белок
амилоид А и Р
α1-кислый гликопротеин
α2-макроглобулин
гаптоглобин
церулоплазмин
антигемофильный глобулин
компоненты комплемента
ингибиторы
протеаз
орозомукоид
ферритин
лактоферрин из нейтрофилов
плазминоген
антитромбин III
антикоагулянтные белки S и С
Слайд 49ПО ВРЕМЕНИ И СТЕПЕНИ РЕАГИРОВАНИЯ НА ПОВРЕЖДЕНИЕ БЕЛКИ ОСТРОЙ ФАЗЫ
ПОДРАЗДЕЛЯЮТСЯ НА ТРИ ОСНОВНЫЕ ГРУППЫ:
Очень сильные – их содержание при
ООФ увеличивается в 20-1000 раз и это наблюдается через 6-10 часов – сюда относят С-РБ, сывороточный амилоид А и др.Сильные – содержание их увеличивается в 2-5 раза – время ответа 10-24 часа – к ним относят α-1-антихимотрипсин, α-1-ингибитор протеаз, орозомукоид, гаптоглобин, фибриноген и др.
Слабые – их содержание увеличивается на 30-60% - время ответа 48-72 часа – к ним относят С3, С4, церуллоплазмин и др.
Слайд 50СВОЙСТВА(функции)
БЕЛКОВ ОСТРОЙ ФАЗЫ
АНТИОКСИДАНТНЫЕ
церулоплазмин, амилоид, СРБ, α2-макроглобулин
АНТИМИКРОБНЫЕ
СРБ, лактоферрин,
факторы комплемента
РЕГУЛЯЦИЯ ГЕМОСТАЗА
Факторы коагуляции и антикоагуляции
ОГРАНИЧЕНИЕ ДОСТУПНОСТИ ЖЕЛЕЗА
Гаптоглобин, лактоферрин
Слайд 51
Лихорадка — эволюционно сформированная типовая преимущественно защитно-приспособительная реакция
на пирогены,
характеризующаяся повышением температуры тела
вследствии
временной активной перестройки аппарата теплорегуляции
на более высокий уровень функционирования.
Слайд 52
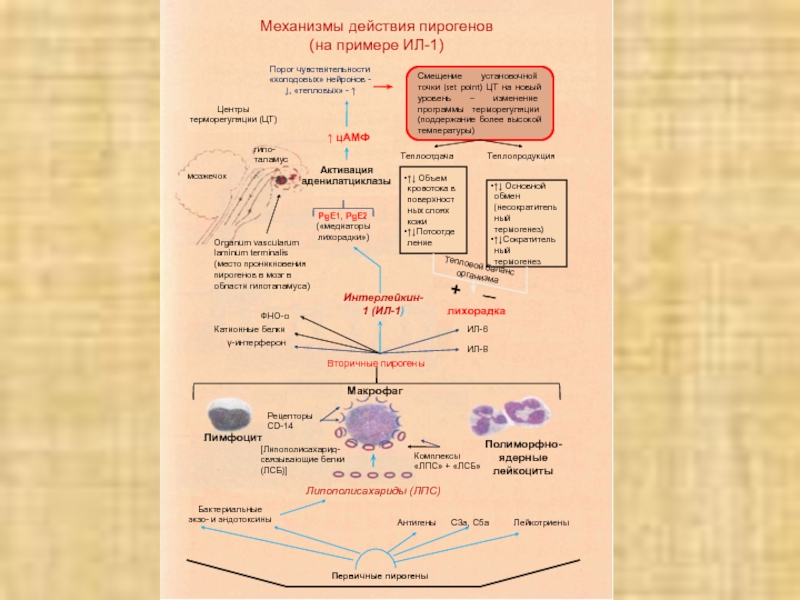
Механизмы действия пирогенов (на примере ИЛ-1)
Макрофаг
Полиморфно-ядерные лейкоциты
Лимфоцит
Липополисахариды (ЛПС)
мозжечок
гипо- таламус
Смещение установочной
точки (set point) ЦТ на новый уровень – изменение программы
терморегуляции (поддержание более высокой температуры)Порог чувствительности «холодовых» нейронов - ↓, «тепловых» - ↑
Центры терморегуляции (ЦТ)
Теплоотдача
Теплопродукция
↑↓ Объем кровотока в поверхностных слоях кожи
↑↓Потоотделение
↑↓ Основной обмен(несократительный термогенез)
↑↓Сократительный термогенез
лихорадка
Вторичные пирогены
Первичные пирогены
Лейкотриены
С3а, С5а
Антигены
Бактериальные экзо- и эндотоксины
Рецепторы CD-14
Комплексы «ЛПС» + «ЛСБ»
Organum vascularum laminum terminalis (место проникновения пирогенов в мозг в области гипоталамуса)
ИЛ-6
ИЛ-8
ФНО-α
Катионные белки
γ-интерферон
[Липополисахарид-связывающие белки (ЛСБ)]
Интерлейкин-1 (ИЛ-1)
PgE1, PgE2 («медиаторы лихорадки»)
Активация аденилатциклазы
↑ цАМФ
─
+
Тепловой баланс организма
Слайд 53Гипертермия –
ПРОЯВЛЕНИЯ:
высокая температура тела
обезвоживание и обессоливание
нарушение микроциркуляции
(следствие сгущения крови)
гипоксия
это результат декомпенсации или поломки механизмов терморегуляции
при стойкой недостаточности теплоотдачи по отношению к теплопродукции
Слайд 54
ІІІ. При чрезмерном воздействии патогена, его чрезвычайной силе (особенно на
фоне недостаточности механизмов защиты)
этиологический фактор,
медиаторы воспаления,
продукты разрушенных
клеток преодолевают местные противовоспалительные барьеры и в большом количестве
проникают в общий кровоток.
Возникает синдром системного воспалительного ответа – ССВО (SIRS) – Systemic Inflammatory Response Syndrome
Слайд 55
Синдром системного воспалительного ответа – в 10% наблюдений - обширная
травма, значительная кровопотеря, тяжелые, обширные ожоги, массивный распад злокачественных новообразований
и др.90% - результат инфекционного процесса (сепсис)
Слайд 56
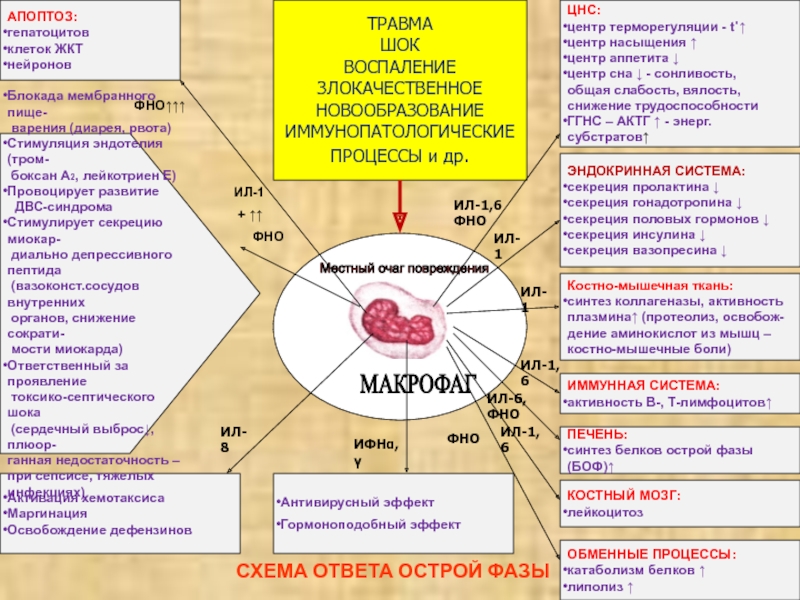
СХЕМА ОТВЕТА ОСТРОЙ ФАЗЫ
МАКРОФАГ
Местный очаг повреждения
ТРАВМА
ШОК
ВОСПАЛЕНИЕ
ЗЛОКАЧЕСТВЕННОЕ
НОВООБРАЗОВАНИЕ
ИММУНОПАТОЛОГИЧЕСКИЕ
ПРОЦЕССЫ
и др. ЦНС:
центр терморегуляции - t˚↑
центр насыщения ↑
центр аппетита ↓
центр сна ↓ - сонливость,
общая слабость, вялость,
снижение трудоспособности
ГГНС – АКТГ ↑ - энерг.субстратов↑
ЭНДОКРИННАЯ СИСТЕМА:
секреция пролактина ↓
секреция гонадотропина ↓
секреция половых гормонов ↓
секреция инсулина ↓
секреция вазопресина ↓
Костно-мышечная ткань:
синтез коллагеназы, активность
плазмина↑ (протеолиз, освобож-
дение аминокислот из мышц –
костно-мышечные боли)
ИММУННАЯ СИСТЕМА:
активность В-, Т-лимфоцитов↑
ПЕЧЕНЬ:
синтез белков острой фазы (БОФ)↑
КОСТНЫЙ МОЗГ:
лейкоцитоз
ОБМЕННЫЕ ПРОЦЕССЫ:
катаболизм белков ↑
липолиз ↑
Антивирусный эффект
Гормоноподобный эффект
Активация хемотаксиса
Маргинация
Освобождение дефензинов
АПОПТОЗ:
гепатоцитов
клеток ЖКТ
нейронов
Блокада мембранного пище-
варения (диарея, рвота)
Стимуляция эндотелия (тром-
боксан А2, лейкотриен Е)
Провоцирует развитие
ДВС-синдрома
Стимулирует секрецию миокар-
диально депрессивного пептида
(вазоконст.сосудов внутренних
органов, снижение сократи-
мости миокарда)
Ответственный за проявление
токсико-септического шока
(сердечный выброс↓, плюор-
ганная недостаточность –
при сепсисе, тяжелых
инфекциях)
ФНО↑↑↑
ИЛ-1
+ ↑↑
ФНО
ИЛ-8
ИФНα,γ
ИЛ-1,6 ФНО
ИЛ-1
ИЛ-1
ИЛ-1,6
ФНО
ИЛ-1,6
ИЛ-6, ФНО
Слайд 57
ССВО →
синдром полиорганной недостаточности (СПОН) –
нарушения микроциркуляции,
острый
респираторный дистресс-синдром,
печеночная и почечная недостаточность,
нарушения функции С-С-С
Слайд 58Особенности поддержания температурного гомеостаза у детей
Широко распространено мнение – лихорадка
у доношенных, а особенно у недоношенных несовершенна (как защита) из-за
еще недостаточной зрелости центра терморегуляции (одна из мотивировок – отсутствие дрожи).Но это не так! Выработка тепла (эндогенного) у них может повышаться без дрожи на 100-200% и более (в сравнении с нормой)
Слайд 59
В течение первых недель после рождения температура тела ребенка
поддерживается за счет:
большей интенсивности недрожательного термогенеза
Термогенеза в клетках бурой
жировой тканиСлайд 60
Недрожательный термогенез – его большая интенсивность объясняется высокой, постоянной
тонической мышечной активностью, что повышает порог дрожательного рефлекса
Слайд 61
Дрожь у новорожденных появляется только при предельных переохлаждениях
Наиболее мощным источником
эндогенного тепла в этом периоде является термогенз бурой жировой ткани:
межлопаточная
областьза грудиной
вдоль аорты и крупных кровеносных сосудов
позвоночник
щеки младенца (комочки Биша)
Слайд 62
Бурая окраска – обильное кровоснабжение + большое количество митохондрий (железа↑↑↑)
Клетки
бурого жира содержат белок (термогенин) – активатор нефосфорилирующего окисления,
на
поверхности много норадреналовых рецепторовУ новорожденных, в бурой жировой ткани вдоль позвоночника отмечены параоартальные ганглии (орган Цукеркандля) синтезирующие норадреналин
Слайд 63
В надпочечнике ребенка до 3-4 месяцев жизни преобладает синтез
норадреналина
Отсюда, из органа Цукеркандля и надпочечника выделяется большое количество
норадреналина → термогенина →
залповый липолиз →
термогенез ↑↑
Слайд 64
Следовательно, механизм температурной адаптации у данных детей довольно таки мощный,
но,
задачи, стоящие перед ними, особенно при недоношенности,
существенно сложнее, чем
у взрослых, отсюда и видимость их несостоятельности
Слайд 65
Сложность задач объясняется следующим:
1. С точки зрения технологии терморегуляции, малый
размер новорожденного является недостатком.
Соотношение между поверхностью и объемом тела
ребенка (даже у доношенного) в три раза больше, чем у взрослых.Т.е. поверхность значительно преобладает над массой
Слайд 66
2. Изолирующая прослойка жира поверхностного слоя тела значительно тоньше, по
сравнению со старшими возрастными группами.
Поэтому, у новорожденных,
даже максимальное сужение сосудов (что весьма затруднительно) не может ограничить потерю эндогенного тепла во внешнюю среду3. Ограничены запасы бурого и белого жира (у недоношенных не более 2%, а у доношенных до 8% от массы тела)
Слайд 67
Это создает большие проблемы с терморегуляцией.
Таким образом,
для того, чтобы
решить выше перечисленные проблемы, т.е. приблизится к взрослым,
организм доношенного ребенка
должет увеличить выработку тепла в 4-5 раз больше на единицу массы тела,а недоношенного (при массе 1-1,5 кг) в 10 раз!!
Слайд 68
Клетки белой крови новорожденных выделяют эндогенные пирогены (ИЛ-1,6, ФНО) и
отвечают на них истинной лихорадкой,
но как отмечено выше, механизмы
температурного гомеостаза в раннем возрасте отличаются своеобразием (термогенез бурой ткани, несократительный термогенез).У взрослых температура повышается при лихорадке в основном за счет ограничения теплоотдачи
Слайд 69
Можно сказать, что лихорадка для детей этой возрастной группы более
расточительное мероприятие, чем для взрослых
Отсюда:
данные дети быстрее худеют, и буквально
через несколько часов могут казаться осунувшимися (комочки Биша↓↓↓)высокая интенсивность липолиза создает угрозу развития кетоацидоза
аритмий
фебрильных судорог
рвоты
лечение лихорадки должно быть более агрессивным!
Слайд 70Исходы острого экссудативно-деструктивного воспаления (ЭДВ)
Выздоровление:
полное
неполное (образование рубцов)
2. Формирование синдрома
системного воспалительного ответа – ССВО
3. Переход в хроническую форму (вторичное
хроническое воспаление) Слайд 71ПРИЧИНЫ
(условия) формирования хронического экссудативно-деструктивного воспаления (ХЭДВ)
I. Факторы, снижающие реактивность
организма:
Гипо- и авитоминозы, другие формы голодания;
Сахарный диабет;
Злокачественные опухоли;
Повторные стрессы;
Врожденные и
приобретенные иммунодефициты;Старение соединительной ткани;
Врожденное или приобретенное снижение адгезивных свойств нейтрофильных лейкоцитов;
Нарушение миграции фагоцитов в очаг воспаления;
Рефрактерность к хемотоксину;
Подавление микроцидных функций лейкоцитов.
II. Персистенция флогогенного возбудителя в тканях (бруцеллы или патогенный агент неметаболизируется – кристаллы кремния при силикозе).
Слайд 72
Всё это способствуют продолжению альтерации и экссудации на фоне развернувшихся
процессов пролиферации
Сочетание волнообразных альтеративно-экссудативных явлений и фиброплазии (явление пролиферации)
и определяет специфику хронического воспаления(ХЭДВ)Таким образом – хроническое воспаление может протекать как череда острых явлений на фоне репарации ткани
(«Острое воспаление в ходе хронического», «Подострое воспаление»)
Слайд 73Мононуклеарно-инфильтративное воспаление (МИВ)-первичное хроническое воспаление
МИВ имеет первоначально хронический тип и
лежит в основе множества заболеваний:
от ревматоидного артрита и туберкулеза, до
пневмокониозов и атеросклерозаОно базируется на мононуклеарных инфильтрациях:
диффузных или очаговых скоплениях моноцитов (макрофагов), Т-, В-лимфоцитов и фибробластов
Слайд 74ПРИЧИНЫ ДЛИТЕЛЬНОГО ТЕЧЕНИЯ МИВ
(мононуклеарно-инфильтративного воспаления)
Продолжительный жизненный цикл макрофагов.
Постоянная стимуляция макрофагов
лимфоцитами, ИК, эндотоксинами и др.
Поддержание достаточной интенсивности моноцитопоэза → формирование
предшественников макрофагов.Привлечение в очаг нейтрофилов → деструкция матрикса соединительной ткани → накопление новых продуктов с хемотаксической активностью: результат → в очаг идут новые клетки, те же макрофаги.
Функциональная неполноценность и дефицит Тх, Тс.
Стойкая активность эндотелия посткапиллярных венул в очаге.
Слайд 75Характеристика (особенности МИВ)
В очаге повреждения отмечается накопление (инфильтрация) и длительное
функционирование макрофагов и лимфоцитов (аутоиммунная патология)
Накоплению макрофагов в очаге воспаления
способствуют факторы ингибирующие их миграцию:окисленные липиды
MIF – синтезируемый Т-клетками
Слайд 76
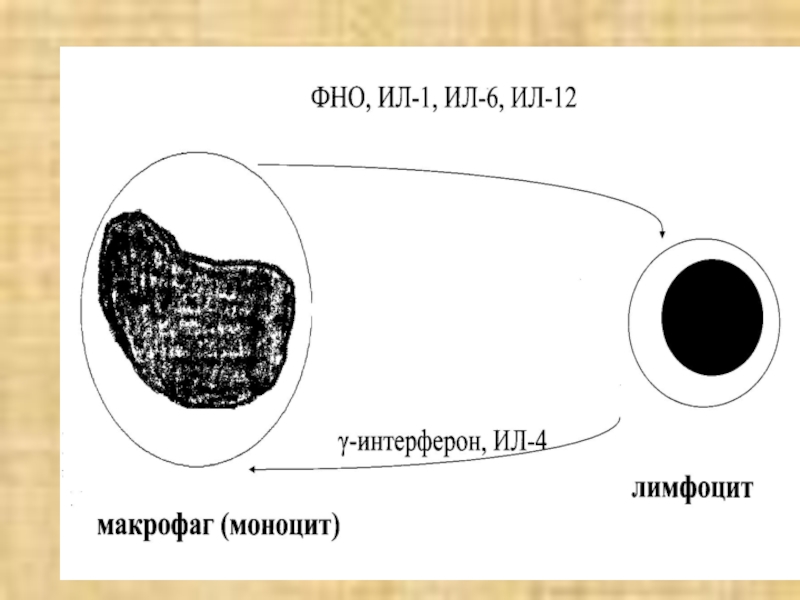
3. Макрофаги пролиферируют в очаге воспаления.
Цитокины, синтезируемые при макрофагально-лимфоцитарной инфильтрации
взаимно активируют эти два вида клеток
лимфоциты → γ-интерферон, ИЛ-4
активируют макрофагимакрофаги → ФНОα, ИЛ-1,6 активируют лимфоциты и др. элементы
Формируется порочный круг, поддерживающий воспаление
Слайд 78
4. Кроме того, данные цитокины способствуют:
преобразованию макрофагов в эпителиоидные клетки
и
их слиянию в гигантские, многоядерные клетки → клетки Пирогова-Лангханса
5. Макрофаги
«примадонны хронического воспаления» (Котран, кумар, Шён, Роббине) 6. Макрофаги при хроническом воспалении, в основном, осуществляют фагоцитоз:
иммунный
неиммунный – при неатигенном этиологическом факторе (тальк)
Слайд 79
7. Длительное присутствие в очаге воспаления сенсибилизированных лимфоцитов позволяет им:
претерпеть
клональную пролиферацию (т.е. создать эффекторный клон)
мигрировать в очаг
и оказывать эффекторное
воздействие в очаге воспаления8. Происходит изменение структуры органов вследствие неполной регенерации, фиброплазии и некроза.
Слайд 80
В результате этого, при МИВ наблюдаются:
полости , окруженные пиогенными капсулами-
абсцессы
рубцы
нарушения органной микроархитектуры
При поверхностном расположении воспалительного очага возможно формирование язвы:
кратерообразного
дефекта, проникающего в подслизистый слой или под эпидермиси представляющего собой очаг воспаления с проявлениями фиброплазии и регенерации по краям,
вплоть до очень грубых (каллезных) структурных изменений (каллеозная язва)
Слайд 81ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕ
Эмбрион
Альтерация – преобладает. Фагоцитоз – выполняет
формообразовательную функцию. Сосудистый компонент – отсутствует.
Пороки развития различных органов
и систем.Плод
ранний
Пролиферация преобладает. Сосудистый компонент слабый. Барьерная роль лимфоузлов не выражена.
Рубеолярная эмбриопатия.
Гиперпластические процессы. Фиброэластаз эндокарда. Цирроз. Глиоз.
Поздний
То же.
Более сформулирован сосудистый компонент. Генерализация инфекции.
Внутриутробные инфекционные заболевания (туберкулез, сифилис, токсоплазмоз)
Слайд 82ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕ
Новорожденный начальный период грудного
Специфическое морфологическое оформление
инфекции.
Недостаточность сосудистого компонента – альтеративно-дегенеративный тип воспаления.
Незавершенный фагоцитоз.
Генерализация процесса
вследствие размножения микробов в лимфоузлах, недостаточности пролиферативных явлений, неполноценности фибробластного вала. Пиодермия
Пневмония
Сепсис
Флебит
Флегмона новорожденных
Остальные периоды
Все фазы воспалительной реакции
Завершенный фагоцитоз.
Локализованный характер.
Высокая барьерная роль лимфоузлов.
В воспалении участвуют антитела.
Возможна аутоиммунная этиология воспаления.
Абсцесс
Ангина
Панкреатит
Ревматоидный артрит
Бронхиальная астма.
Слайд 83Положительное значение лихорадки
Способствует усилению обмена веществ, накоплению энергетических ресурсов за
счет усиления окислительного фосфорилирования – т.е. стимулирует метаболизм
Повышает функциональную активность
органов и клеток, в частности, усиливает процессы окислительно-фосфорилирования в печени → ее дезинтоксикационная функция↑, усиливается фагоцитарная активность клеток.Увеличивается активность факторов врожденного иммунитета: фагоцитоз, комплемент, лизоцим, α-интерферон
Увеличивается специфическая защита: продукция антител, γ-интерферон, т.е. активируются иммунные реакции
Губительно действует на микробы и вирусы, препятствует их размножению
Является одной из причин развития общего адаптационного синдрома
Слайд 84Отрицательное значение лихорадки
Глубокие нарушения функции всех органов и систем
Доставляет больному
страдания
Неблагоприятно влияет на процессы метаболизма (метаболический ацидоз, усиление гликолиза, накопление
кетоновых тел и т.д.), увеличение потребности в жидкости, может развиться дыхательный ацидозНеблагоприятно влияет на ЦНС – галлюцинации, бред, судороги, эпилептические припадки
Неблагоприятно влияет на сердце и легкие (в связи с усиленной функцией): тахикардия → ↑МОС → ↑АД → метаболические нарушения в сердце → ↓АД → брадикардия → уменьшение МОС
Угнетает моторику ЖКТ
Может нарушать рост и развитие плода и ребенка
При длительной температурной реакции снижается активность иммунного ответа
Слайд 85Неинфекционные лихорадки у детей
1. Молочная лихорадка – в материнском молоке
(особенно молозиве) много лейкоцитов
При застое молока, даже без мастита –
освобождение эндогенных пирогенов2. Транзиторная гипертермия новорожденных.
Это пограничное состояние. Связанное с неонатальной адаптацией к внеутробной жизни.
Проявляется на 3-5 день жизни, температура до 38,5-39,5
Патогенез:
гиперосмолярная дегидратация и родовой стресс
возможно и влияние экзогенных пирогенов (заселение кишечника микробной флорой – E.coli)
Слайд 86Абсолюные показания лечения лихорадки
Температура – 40 при наличии:
Возраст от 6
мес до 3 лет
Моложе 6 лет + судороги
Заболевания сердца
и легкихОстрые неврологические заболевания
Сепсис, шок
Слайд 87Относительные показания
Температура – 39-40
Возраст до 5 лет
Неврологические острые
заболевания
Слайд 88Патогенез лихорадки
Вторичные пирогены: ИЛ-1, ФНОα, ИЛ-6, ИЛ-8
Нейроны ППОГ
Активация аденилатциклазной
системы
Подавление фосфодиэстеразы (ПГЕ2)
↑ цАМФ в нейронах
↓ чувствительности к тепловым сигналам
↑
чувствительности к холодовым сигналам Смещение уровня установочной точки