Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Переходные элементы
Содержание
- 1. Переходные элементы
- 2. Побочная подгруппа IV группы ПС
- 3. Простые веществаПолучение сложное, MO2 + 2C +
- 4. Свойства простых веществM+ H2 = MH2 (при
- 5. Свойства простых веществM + O2 (или 2S)
- 6. (комплексообразование)M + 6HF = H2[MF6] + 3H2
- 7. Оксиды М4+MO2 – бесцветные, тугоплавкие, не растворимые
- 8. «Кислоты» и «соли» М4+CaO + TiO2 =
- 9. Поведение в водных р-рах M4+TiO2 + H2SO4
- 10. Побочная подгруппа V группы ПС
- 11. Свойства Nb и Ta очень похожи, сильно
- 12. Содержание в земной коре и минералыV –
- 13. Открытие элементовV – в 1801 г. мексиканец
- 14. Простые веществаПолучение сложное, проблема разделения Nb и
- 15. Известный "автомобильный король" Генри Форд сказал: "Если
- 16. Простые веществаХимически инертные2V + 12HF = 2H[VF6]
- 17. ВАНАДИЙ2+ VO
- 18. Кислородные соединения V5+V2O5 + H2O = 2HVO3
- 19. Побочная подгруппа VI группы ПС
- 20. Убывание кислотных свойств (H2CrO4 и H2MoO4)Элементы
- 21. Содержание в земной коре и минералыCr –
- 22. Открытие элементовCr – в 1797 г. француз
- 23. Cr Mo WУменьшение активности металла:Cr + 2HCl = CrCl2
- 24. Получение Cr Выплавка феррохрома:FeCr2O4 + 4C = Fe
- 25. Получение Mo 1 стадия – окислительный обжиг молибденита: 2
- 26. Получение W 1 стадия – окислительное плавление шеелита
- 27. Простые веществаТвердые, тяжелые, тугоплавкие металлыW – самый тугоплавкий металлСr – самый твердый металл
- 28. Свойства простых веществ: Cr 1) Cr +
- 29. Свойства простых веществ: Cr 6) 2Cr +
- 30. Свойства простых веществ: Mo, W1) Растворение металлов:а)
- 31. Кислотно-основные свойcтва оксидов и гидроксидов CrCrO Cr(OH)2
- 32. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3
- 33. Кислородные соединения M6+CrO3 – темно-красный, разлагается выше
- 34. Кислородные соединения M6+Способы получения оксидов М6+:K2Cr2O7 +
- 35. H2CrO4: Ka1= 10–1, Ka2= 10–7H2Cr2O7: Ka2= 10–2Гидролиз
- 36. Слайд 36
- 37. Соединения Cr6+ гораздо более сильные окислители, чем
- 38. Продукт восстановления зависит от pH раствора:Cr2O72– +
- 39. Cr3+ Cr6+Сильные окислители:2Cr3+ + 3S2O82– +
- 40. Na15[MoVI126MoV28O462H14(H2O)70] ~400H2O
- 41. Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– А. Мюллер, 2002
- 42. ПрименениеCr – коррозионностойкие стали, покрытия, инструментыMo – жаропрочные стали, нагревателиW – нити накаливания, радиодетали
- 43. Побочная подгруппа VII группы ПС
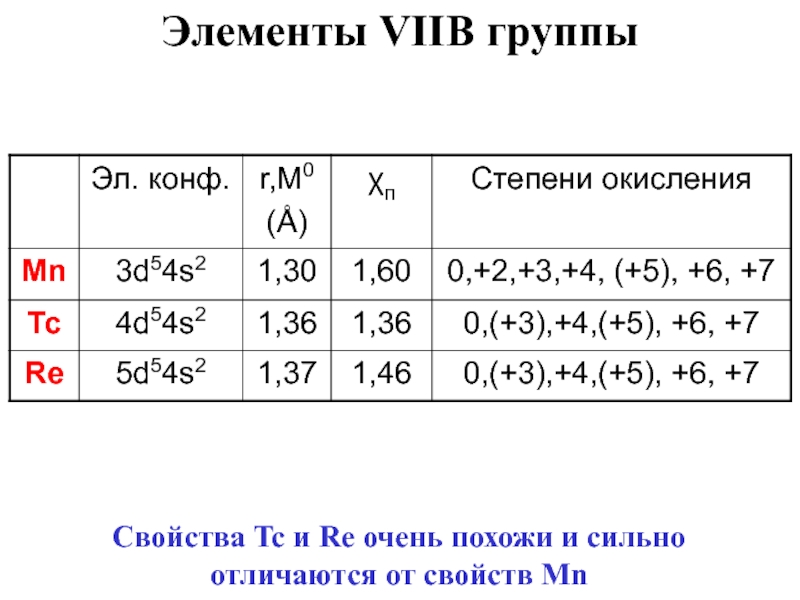
- 44. Свойства Tc и Re очень похожи и сильно отличаются от свойств MnЭлементы VIIB группы
- 45. Содержание в земной коре и минералыMn
- 46. Tc – первый искусственный элемент, 98Tc: t1/2
- 47. Открытие элементовMn – в 1774 г. шведы
- 48. Получение простых веществДешевый методMnO2 + Fe2O3 +
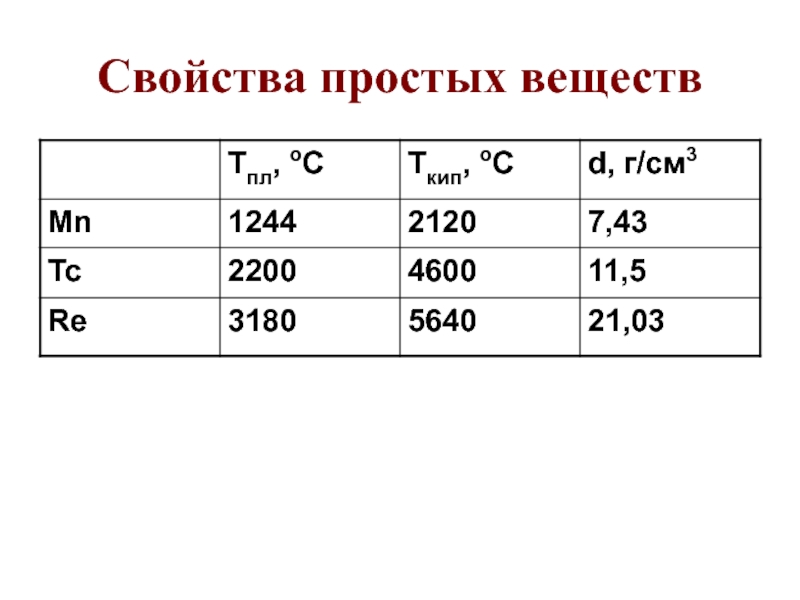
- 49. Свойства простых веществ
- 50. Хим. cвойства простых веществПоложение в ряду напряж.
- 51. Реакции при нагревании3Mn + 2O2 = Mn3O4
- 52. Кислородные соединения M7+M2О7 + Н2О = 2НMО4
- 53. Соли M7+2KMnO4 = K2MnO4 + MnO2 +
- 54. KMnO4 как окислительКонпропорционирование3MnSO4 + 2KMnO4 + 2H2O = 5MnO2↓ + K2SO4 + 2H2SO4
- 55. Получение KMnO4 Две стадии:1) Щелочное плавление пиролюзита:3MnO2
- 56. Кислородные соединения Mn6+MnO3 и H2MnO4 – не
- 57. Кислородные соединения Mn6+ Манганаты – сильные окислители, особенно
- 58. Кислородные соединения Mn4+MnO2 – важнейшее соединениеСвойства окислителя
- 59. Кислородные соединения Mn4+Слабовыраженные амфотерные свойстваMnO2 + 4HF
- 60. Кислородные соединения Mn2+MnO – серо-зеленый, не растворим
- 61. Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O –
- 62. ПрименениеMn – марганцовые стали (твердость, износоустойчивость). МикроудобренияTc – радиодиагностикаRe – сплавы (жаропрочность, кислотоустойчивость), катализатор гидрирования
- 63. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Переходные элементы
21 апреля в 1620 состоится контрольная работа по теме:
«Химия непереходных элементов».
Слайд 3Простые вещества
Получение сложное,
MO2 + 2C + 2Cl2 = MCl4
+ 2CO
MCl4 + 2Mg = M + 2MgCl2 (900 oC,
Ar)проблема разделения Zr и Hf
Сплавы, покрытия, конструкционные материалы
Слайд 4Свойства простых веществ
M+ H2 = MH2 (при выс. Т)
-
устойчивы
M + C = MC (при выс. Т)
Сплав HfC·4TiC самое
тугоплавкое в-во
(т. пл. 3990 ºС) 2Ti + N2 = 2TiN ( >1100 ºС)
Слайд 5Свойства простых веществ
M + O2 (или 2S) = MO2 (или
MS2) (при нагревании порошков)
Ti + 2Г = TiГ4
(Г =
F (150 oC), Cl (300 oC), Br (360 oC), I (550 oC))2Ti + 6HCl = 2TiCl3 + 3H2 (при нагревании)
M + 6HF = H2[MF6] + 2H2 (комплексообразование)
M + 5H2SO4конц. = H2[M(SO4)2] + 2SO2 + 4H2O
Ti + 4HNO3конц. + (n–2)H2O = TiO2.nH2O↓() + 4NO2
-титановые кислоты, нерастворимы в кислотах и щелочах
Ti + 2NaOHконц. + H2O = Na2TiO3 + 2H2
Слайд 6(комплексообразование)
M + 6HF = H2[MF6] + 3H2
M + 4CH3COOH
+ 6F– = [MF6]2– + 4CH3COO– + 2H2
M + 5H2SO4
конц. = H2[M(SO4)3] + 2SO2 + 4H2O3M + 4HNO3 + 18HF = 3H2[MF6] + 4NO + 8H2O
Свойства простых веществ (Zr и Hf)
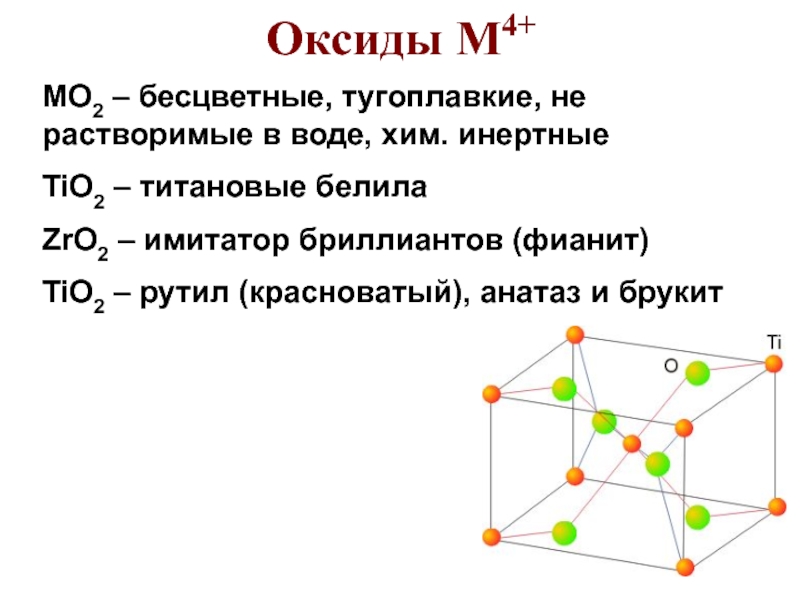
Слайд 7Оксиды М4+
MO2 – бесцветные, тугоплавкие, не растворимые в воде, хим.
инертные
TiO2 – титановые белила
ZrO2 – имитатор бриллиантов (фианит)
TiO2 – рутил
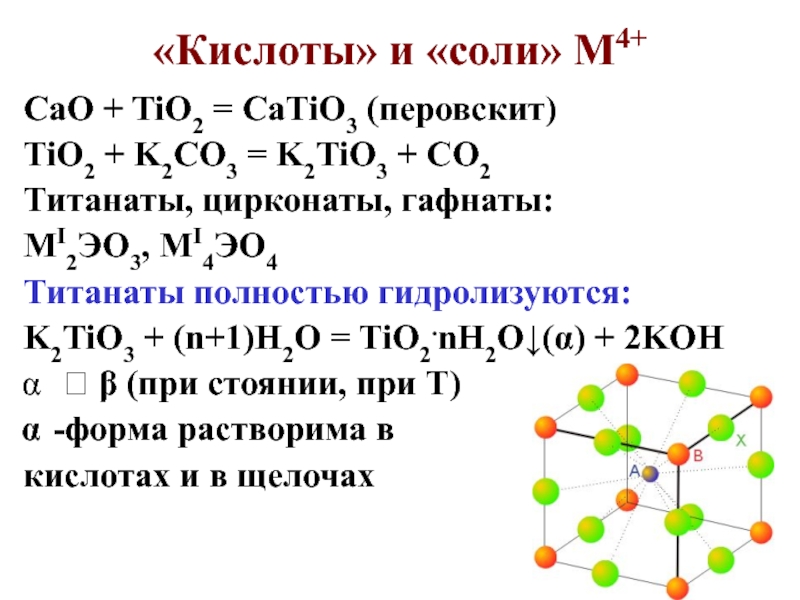
(красноватый), анатаз и брукитСлайд 8«Кислоты» и «соли» М4+
CaO + TiO2 = CaTiO3 (перовскит)
TiO2 +
K2CO3 = K2TiO3 + CO2
Титанаты, цирконаты, гафнаты:
MI2ЭО3, MI4ЭO4
Титанаты полностью
гидролизуются:K2TiO3 + (n+1)H2O = TiO2.nH2O↓() + 2KOH
(при стоянии, при Т)
-форма растворима в
кислотах и в щелочах
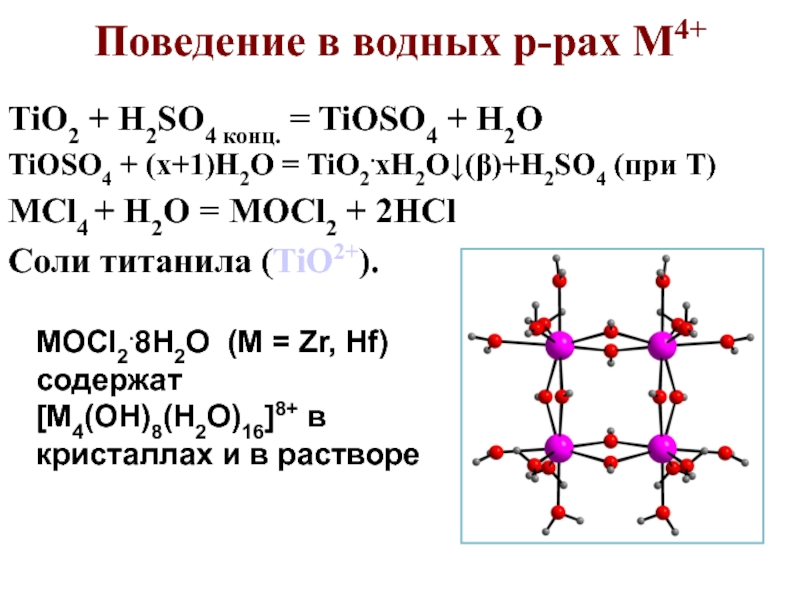
Слайд 9Поведение в водных р-рах M4+
TiO2 + H2SO4 конц. = TiOSO4
+ H2O
TiOSO4 + (x+1)H2O = TiO2.xH2O↓()+H2SO4 (при Т)
МCl4 + H2O
= MOCl2 + 2HClСоли титанила (TiO2+).
MOCl2.8H2O (M = Zr, Hf) содержат [M4(OH)8(H2O)16]8+ в кристаллах и в растворе
Слайд 11Свойства Nb и Ta очень похожи, сильно отличаются от свойств
V.
В ряду V–Nb–Ta стабилизируются высшие степени окисления.
Элементы VB группы
Слайд 12Содержание в земной коре и минералы
V – 20 место, рассеян,
VS2.V2S5 – патронит.
Добывают из железных руд.
Nb – 34 место,
рассеян и редкий, M(NbO3)2 (M = Mn, Fe) – колумбит.Ta – 52 место, рассеян и редкий, M(TaO3)2 (M = Mn, Fe) – танталит.
Слайд 13Открытие элементов
V – в 1801 г. мексиканец Дель Рио, затем
в
1830 г. швед Сефстрём. «Ванадис» – древне-исландская богиня красоты.
Nb
– 1801 г. англичанин Хатчет в минерале колумбит и название колумбий; 1844 г. – немец Розе переименовал в «ниобий» от греческого «Ниобея» – дочь Тантала.
Ta – 1802 г. швед Экеберг, по имени греческого полубога Тантала.
Слайд 14Простые вещества
Получение сложное, проблема разделения Nb и Ta
M2O5 + 5Ca
= 5CaO + 2M
V – стали, танковая броня
Nb, Ta –
химическая
аппаратураTa – костная и пластическая хирургия
Слайд 15Известный "автомобильный король" Генри Форд сказал: "Если бы не было
ванадия" - не было бы автомобиля". Незначительная добавка (0,2 %)
ванадия к обычной стали сообщает ей целый ряд ценных свойств: увеличивается ее упругость, прочность на истирание и сопротивление разрыву, что особенно важно для таких ответственных частей автомобиля, как рессоры, оси, валы, шестерни. Из ванадиевой стали изготовляют самые важные детали автомобильных моторов, цилиндры высокого давления, тормозные колодки. Если бы не ванадиевая сталь, автомобиль весил бы в два раза больше, в два раза увеличился бы расход горючего, износ покрышек, сократился срок службы дорожного покрытия.Слайд 16Простые вещества
Химически инертные
2V + 12HF = 2H[VF6] + 5H2
V +
6HNO3 конц. = [VO2]NO3 + 5NO2 + 3H2O
3V +
5HNO3 + 3HCl = 3[VO2]Cl + 5NO + 4H2ONb,Ta + царская водка = нет реакции
Nb + 5HNO3 + 7HF = H2[NbF7] + 5NO2 + 5H2O
[TaF8]3–
4M + 12KOHрасплав + 5O2 = 4K3MO4 + 6H2O
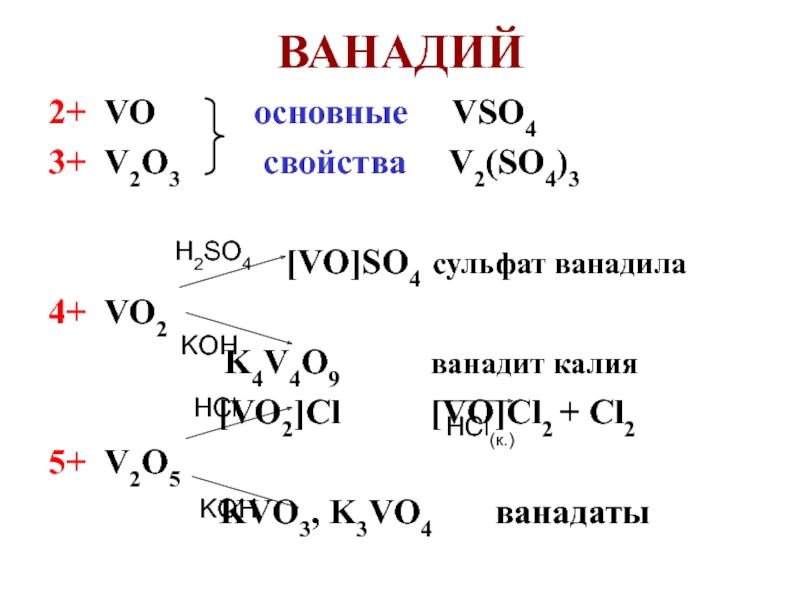
Слайд 17ВАНАДИЙ
2+ VO основные
VSO4
3+ V2O3 свойства
V2(SO4)3[VO]SO4 сульфат ванадила
4+ VO2
K4V4O9 ванадит калия
[VO2]Cl [VO]Cl2 + Cl2
5+ V2O5
KVO3, K3VO4 ванадаты
H2SO4
KOH
HCl
KOH
HCl(к.)
Слайд 18Кислородные соединения V5+
V2O5 + H2O = 2HVO3 (V2O5·xH2O↓)
(равновесие влево)
V2O5 +
2NaOH = 2NaVO3 + H2O (медленно в растворе, быстро в
расплаве), Na3VO42HVO3 + 2HXконц. = 2[VO2]X + 2H2O
X = ½SO42–, NO3–
Катализаторы на основе V2O5, заменили платину при производстве серной кислоты
Слайд 20 Убывание кислотных свойств (H2CrO4 и H2MoO4)
Элементы VIB группы
rMo ≈ rW как следствие лантаноидного сжатия
Склонность к проявлению
высшей СО растет Cвойства Mo и W очень похожи и сильно
отличаются от свойств Cr
Слайд 21Содержание в земной коре и минералы
Cr – 20 место. Хромит
или хромистый железняк (FeCr2O4 = FeO·Cr2O3), крокоит (PbCrO4).
Mo – 37
место. Молибденит (MoS2),
вульфенит (PbMoO4),
повеллит (СаМоО4),
молибдит (Fe(MoO4)3·nH2O).
W – 39 место. Шеелит (CaWO4), вольфрамит ((Fe,Mn)WO4).
Слайд 22Открытие элементов
Cr – в 1797 г. француз Воклен. От греческого
«хрома» – «цвет» (из-за разнообразие окрасок в соединениях).
Mo – в
1817 г. швед Берцелиус. От греческого «молюбдос» – «свинец» (из-за внешнего сходства молибденита (MoS2) со свинцовым блеском (PbS)). W – в 1781 г. швед Шееле. От немецкого «Wolf Rahm» – «волчья пена» (вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков – «пожирает олово как волк овцу»).
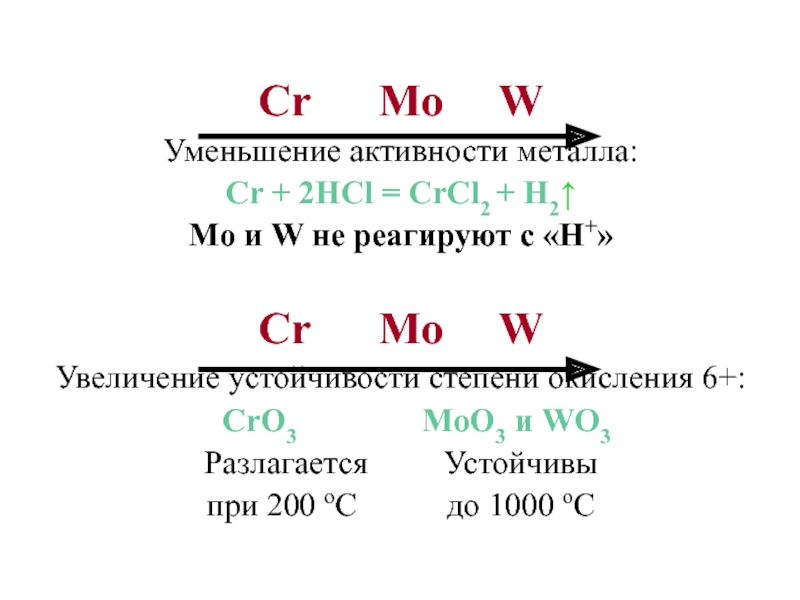
Слайд 23Cr Mo W
Уменьшение активности металла:
Cr + 2HCl = CrCl2 + H2
Mo
и W не реагируют с «H+»
Cr Mo W
Увеличение устойчивости степени окисления 6+:
CrO3
MoO3 и WO3Разлагается Устойчивы
при 200 оС до 1000 оС
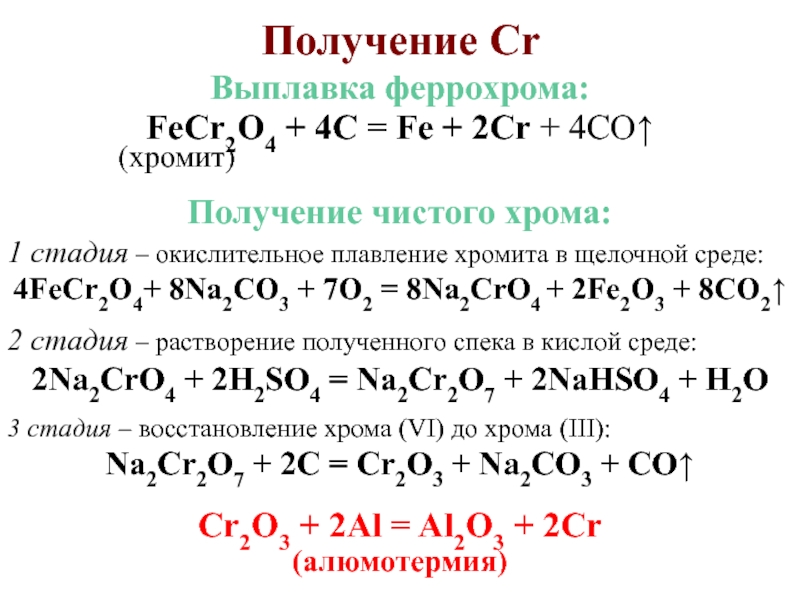
Слайд 24Получение Cr
Выплавка феррохрома:
FeCr2O4 + 4C = Fe + 2Cr +
4CO
(хромит)
Получение чистого хрома:
1 стадия – окислительное
плавление хромита в щелочной среде:4FeCr2O4+ 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2
2 стадия – растворение полученного спека в кислой среде:
2Na2CrO4 + 2H2SO4 = Na2Cr2O7 + 2NaHSO4 + H2O
3 стадия – восстановление хрома (VI) до хрома (III):
Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO
Cr2O3 + 2Al = Al2O3 + 2Cr
(алюмотермия)
Слайд 25Получение Mo
1 стадия – окислительный обжиг молибденита:
2 стадия – выщелачивание
раствором аммиака:
7MoO3 + 6NH3 + 3H2O = (NH4)6Mo7O24
парамолибдат аммония
3 стадия – нейтрализация раствора до рН = 2–3:
(NH4)6Mo7O24 + 6HCl + 4H2O = 7H2MoO4 + 6NH4Cl
молибденовая кислота
4 стадия – термолиз молибденовой кислоты при 450-500 ºС:
H2MoO4 MoO3 + H2O
MoO3 – порошок бледно-зеленого цвета
5 стадия – восстановление оксида MoO3 водородом:
MoO3 + 3H2 Mo + 3H2O
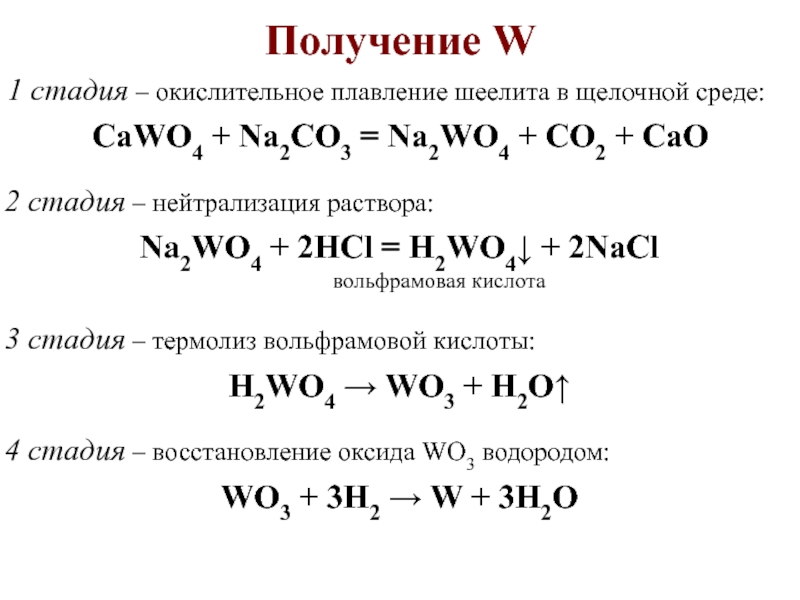
Слайд 26Получение W
1 стадия – окислительное плавление шеелита в щелочной среде:
2
стадия – нейтрализация раствора:
CaWO4 + Na2CO3 = Na2WO4 + CO2
+ CaONa2WO4 + 2HCl = H2WO4 + 2NaCl
вольфрамовая кислота
3 стадия – термолиз вольфрамовой кислоты:
H2WO4 WO3 + H2O
4 стадия – восстановление оксида WO3 водородом:
WO3 + 3H2 W + 3H2O
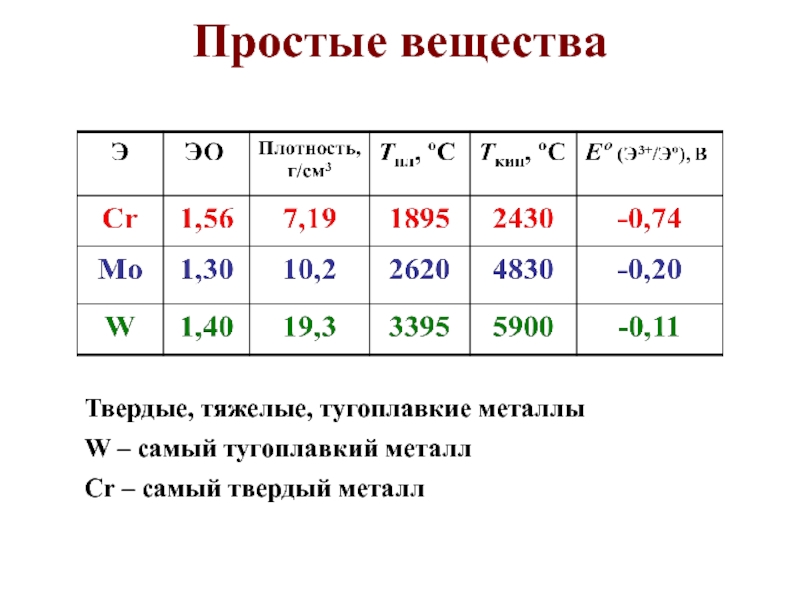
Слайд 27Простые вещества
Твердые, тяжелые, тугоплавкие металлы
W – самый тугоплавкий металл
Сr –
самый твердый металл
Слайд 28Свойства простых веществ: Cr
1) Cr + 2HCl = CrCl2
+ H2
Реакция в атмосфере Ar, голубой [Cr(H2O)6]2+
2) 2Cr + 6HCl
+ O2 = 2CrCl3 + H2 + 2H2OРеакция на воздухе, зеленый [Cr(H2O)6]3+
3) 2Cr + 6H2SO4(конц.) = Cr2(SO4)3 + 3SO2 +6H2O
Концентрированная H2SO4 – окислитель. Растворим и в разбавленной серной кислоте.
Но:
4) Конц. HNO3 пассивирует поверхность
5) Щелочи пассивируют поверхность
Слайд 29Свойства простых веществ: Cr
6) 2Cr + 3H2O = Cr2O3
+3H2
7) 2Cr + 3/2O2 = Cr2O3
8) Cr + HCl(газ)
= CrCl2 (безводный) + H2Чистый безводный CrCl2 бесцветный.
9) 2Cr + 3Cl2 = 2CrCl3 (безводный)
Безводный CrCl3 фиолетовый, CrCl3.6H2O – темно-зеленый.
Реакции 6–9 идут при нагревании!
Слайд 30Свойства простых веществ: Mo, W
1) Растворение металлов:
а) W + 8HF
+ 2HNO3 = H2[WF8] + 2NO +4H2O
HNO3 –
окислитель, HF – источник лигандовб) Окислительная щелочная плавка:
Mо + 3NaNO3 + Na2CO3 = Na2MоO4 + 3NaNO2 + CO2
2) Реакции при нагревании:
а) 2W + 3O2 = 2WO3
б) Mo +2S = MoS2
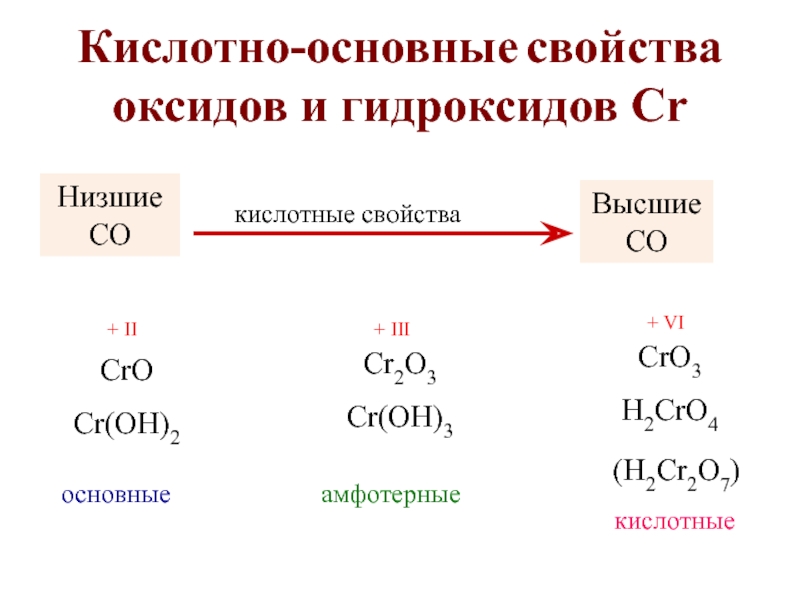
Слайд 31Кислотно-основные свойcтва оксидов и гидроксидов Cr
CrO
Cr(OH)2
основные
Cr2O3
Cr(OH)3
CrO3
H2CrO4
амфотерные
кислотные
Низшие СО
Высшие СО
кислотные свойства
(H2Cr2O7)
+ II
+ III
+ VI
Слайд 32Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O
Cr(OH)3 + NaOH =
Na[Cr(OH)4]
тетрагидроксохромит натрия
хромит натрия
(соль несуществующей хромистой кислоты)
СrO3 – кислотный оксид
CrO3 +
KOH = K2CrO4 + H2Oхромат калия
при сплавлении
Cr2O3 – очень стабилен, зеленый пигмент в красках.
Не реагирует с водой, кислотами и р-рами щелочей.
Слайд 33Кислородные соединения M6+
CrO3 – темно-красный, разлагается выше 200 оС,
растворим в воде:
- термическое разложение:
4CrO3 = 2Cr2O3 + 3O2 - взаимодействие с водой: CrO3 + H2O = H2CrO4
MoO3 (бесцветный), WO3 (желтый) – устойчивы до 800 оС, не растворимы в воде.
Слайд 34Кислородные соединения M6+
Способы получения оксидов М6+:
K2Cr2O7 + 2H2SO4 конц.= 2CrO3↓
+ 2KHSO4 +H2O
2M + 3O2 = 2MO3 (M = Mo,
W), но 4Cr +3O2 = 2Cr2O3!(NH4)2MO4 = MO3 + H2O + 2NH3 (M = Mo, W),
но (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O!
Слайд 35H2CrO4: Ka1= 10–1, Ka2= 10–7
H2Cr2O7: Ka2= 10–2
Гидролиз солей:
CrO42– – хромат
ион, устойчив в щелочной среде (желтый)
Cr2O72– – дихромат ион,
устойчив в кислой среде (оранжевый)Cr2O72– + H2O = 2CrO42– + 2H+
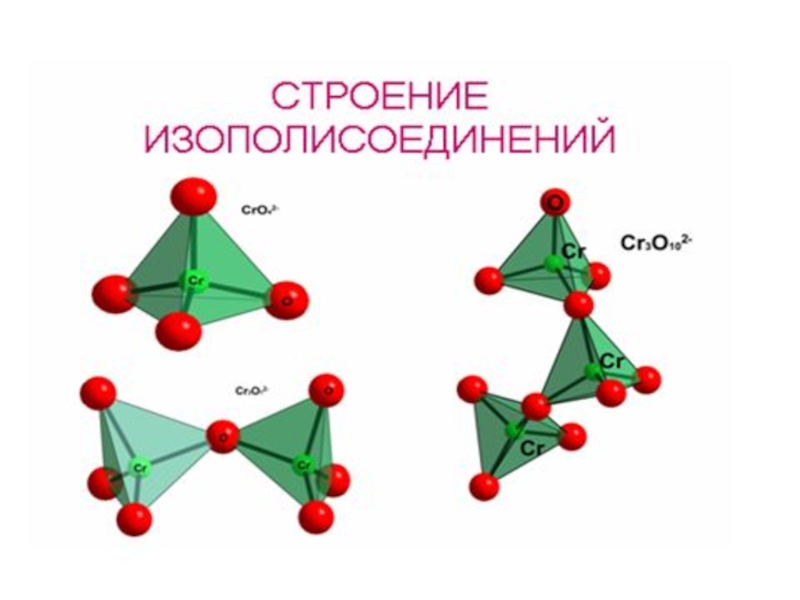
Кислородные соединения Cr6+
[H+] H2CrO4, H2Cr2O7, H2Cr3O10, H2Cr4O13
изополисоединения
Cr2O72– + 2OH– ↔ 2CrO42– + H2O
процесс полимеризации
процесс деполимеризации
Слайд 37Соединения Cr6+ гораздо более сильные окислители, чем соединения Mo6+ и
W6+
4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2O
(NH4)2Cr2O7 =
Cr2O3 + N2 + 4H2OK2Cr2O7 + 14HClконц = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
Кислородные соединения Cr6+
Слайд 38Продукт восстановления зависит от pH раствора:
Cr2O72– + 3SO32– + 8H+
= 2Cr3+ + 3SO42– + 4H2O
2CrO42– + 3SO32– + 5H2O
= 2Cr(OH)3 + 3SO42– + 4OH– 2CrO42– + 3Sn2+ + 10OH– + 8H2O = 2[Cr(OH)4]– + 3[Sn(OH)6]2–
Кислородные соединения Cr6+
Слайд 39Cr3+ Cr6+
Сильные окислители:
2Cr3+ + 3S2O82– + 7H2O = Cr2O72–
+ 6SO42– + 14H+
2Cr3+ + 3Br2 + 16OH– = 2CrO42–
+ 6Br– + 8H2OСлайд 42Применение
Cr – коррозионностойкие стали, покрытия, инструменты
Mo – жаропрочные стали, нагреватели
W
– нити накаливания, радиодетали
Слайд 45Содержание в земной коре
и минералы
Mn – 15 место.
Пиролюзит –
рис. слева (MnO2.xH2O); браунит (Mn2O3); манганит (MnO(OH)); гаусманнит (Mn3O4 =
MnIIMnIII2O4);родохрозит – рис. справа (MnCO3).
Слайд 46Tc – первый искусственный элемент,
98Tc: t1/2 = 4,2.106 лет.
Re
– 81 место, ОЧЕНЬ редкий и рассеянный!!!
Джезказганит (CuReS4);
рениит (ReS2) –
на Камчатке и Курилах обычно примесь в молибдените MoS2;таркианит ((Cu,Fe)(Re,Mo)4S8)
Содержание в земной коре
и минералы
Слайд 47Открытие элементов
Mn – в 1774 г. шведы Шееле и Ган.
Мангановый камень (пиролюзит) ремесленники добавляли в стекло
Tc – в 1871
г. Д.И. Менделеев предсказал существование экамарганца; итальянцы Сегре и Перрье получили в 1936 г.98Mo + 2D = 99Tc + 1n
Re – в 1925 г. немцы супруги Ноддак.
По имени Рейнской провинции.
Слайд 48Получение простых веществ
Дешевый метод
MnO2 + Fe2O3 + 5C = Mn
+ 2Fe + 5CO
Дорогой метод – алюмотермия (из пиролюзита)
3MnO2.xH2O =
Mn3O4 + O2 +3xH2O3Mn3O4 + 8Al = 9Mn + 4Al2O3
Получение технеция и рения
2NH4TcO4 = 2TcO2 + 4H2O + N2;
TcO2 + 2H2 = Tc + 2H2O;
2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O (1000 oC)
Слайд 50Хим. cвойства простых веществ
Положение в ряду напряж. металлов
….Mg Mn Zn…H Cu Tc
Re…Mn +2HCl = MnCl2 + H2 E0 0
Mn + 4HNO3(конц.) = Mn(NO3)2 +2NO2 +2H2O
4Re + 4KOH + 7O2 = 4KReO4 + 2H2O (расплав)
Re + 7HNO3(конц.) = HReO4 + 7NO2 + 3H2O
2Re + 7H2O2 = 2HReO4 + 6H2O
Слайд 51Реакции при нагревании
3Mn + 2O2 = Mn3O4 (MnIIMnIII2O4)
3Mn + N2
= Mn3N2 (1200oC)
Mn + Cl2 = MnCl2
Mn + F2 =
MnF2 (и MnF3)4Re + 7O2 = 2Re2O7 (летучий оксид)
2Re + 5Cl2 = 2ReCl5
Re + 2S = ReS2
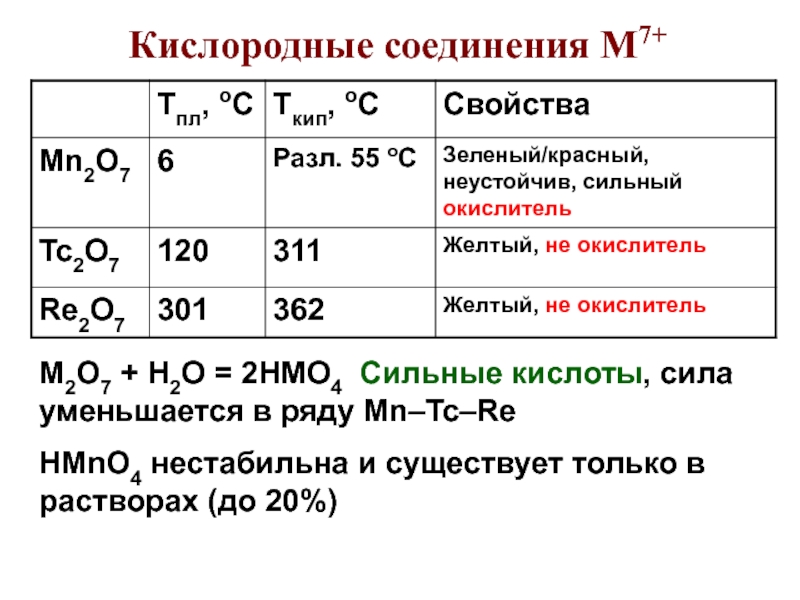
Слайд 52Кислородные соединения M7+
M2О7 + Н2О = 2НMО4 Сильные кислоты, сила
уменьшается в ряду Mn–Tc–Re
HMnO4 нестабильна и существует только в растворах
(до 20%) Слайд 53Соли M7+
2KMnO4 = K2MnO4 + MnO2 + O2↑ (разложение при
нагр.)
2MnO4– + 5H2S + 6H+ = 2Mn2+ + 5S +
8H2O (ОВР)2ReO4– + 7H2S +2H+ = Re2S7↓ + 8H2O (нет ОВР)
Слайд 55Получение KMnO4
Две стадии:
1) Щелочное плавление пиролюзита:
3MnO2 + KClO3 +
6KOH = 3K2MnO4 + KCl + 3H2O
2) Окисление до перманганата
: Cl2, O3, PbO2, (NH4)2S2O8, KBiO3, XeF4
Экономично электрохимическое окисление:
КАТОД: 2H2O + 2e = H2 + 2OH–
АНОД: MnO42– – e = MnO4–
2K2MnO4 + 2H2O = 2KMnO4 +2KOH +H2↑
Слайд 56Кислородные соединения Mn6+
MnO3 и H2MnO4 – не известны
Соли – манганаты
(зеленый цвет)
Манганаты склонны диспропорционировать, особенно в кислой среде
3MnO42– +
4H+ = 2MnO4– + MnO2↓ + 2H2O(пропускание CO2)
Слайд 57Кислородные соединения Mn6+
Манганаты – сильные окислители, особенно в кислой среде,
где восстанавливаются до Mn2+; в щелочной среде восстанавливаются до MnO2
Окисление
органики6K2MnO4 +C2H5OH + H2O = 6MnO2↓+ 2K2CO3 + 8KOH
Слайд 58Кислородные соединения Mn4+
MnO2 – важнейшее соединение
Свойства окислителя (при нагревании):
MnO2 +
4HClконц = MnCl2 + Cl2↑ + 2H2O
2MnO2 + 2H2SO4 =
2MnSO4 + O2↑ +2H2OОкисление до манганатов:
(сплавление)
3MnO2 + KClO3 + 3K2CO3 = 3K2MnO4 + KCl + 3CO2
(KNO3)
Слайд 59Кислородные соединения Mn4+
Слабовыраженные амфотерные свойства
MnO2 + 4HF = MnF4 +
2H2O
MnO2 + CaO = CaMnO3 (метаманганат (IV))
CaMnO3 + CaO =
Ca2MnO4 (ортоманганат (IV))Слайд 60Кислородные соединения Mn2+
MnO – серо-зеленый, не растворим в воде
MnCO3 =
MnO + CO2 (при нагревании)
MnCO3 встречается в природе в виде
минерала (розовые кристаллы) родохрозита (марганцевый шпат). MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
Mn(OH)2 – белый, окисляется на воздухе, легко растворим в кислотах, растворим в крепких щелочах
Mn(OH)2 + H2SO4 = MnSO4 + 2H2O
Mn(OH)2 + KOH = K[Mn(OH)3]
Слайд 61Соли Mn2+
Водорастворимые соли:
MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O –
в водных растворах
[Mn(H2O)6]2+
Нерастворимые соли:
MnCO3, MnS, MnC2O4
MnCl2 + (NH4)2S = MnS↓ + 2NH4Cl
MnS
– темный, при стоянии зеленыйПРMnS = 10–10, но легко растворим в кислотах, поэтому не осаждается H2S




![Переходные элементы (комплексообразование)M + 6HF = H2[MF6] + 3H2 M + 4CH3COOH + (комплексообразование)M + 6HF = H2[MF6] + 3H2 M + 4CH3COOH + 6F– = [MF6]2– + 4CH3COO– +](/img/thumbs/d10ed772a8d62735d6f466b269c97ccd-800x.jpg)





![Переходные элементы Простые веществаХимически инертные2V + 12HF = 2H[VF6] + 5H2V + 6HNO3 Простые веществаХимически инертные2V + 12HF = 2H[VF6] + 5H2V + 6HNO3 конц. = [VO2]NO3 + 5NO2 +](/img/thumbs/8dfc83a82870eaf89e062d4ff7f54c70-800x.jpg)





![Переходные элементы Свойства простых веществ: Cr 1) Cr + 2HCl = CrCl2 + Свойства простых веществ: Cr 1) Cr + 2HCl = CrCl2 + H2Реакция в атмосфере Ar, голубой [Cr(H2O)6]2+2)](/img/thumbs/e052e9da51975f833dd675f4a35a84f9-800x.jpg)

![Переходные элементы Свойства простых веществ: Mo, W1) Растворение металлов:а) W + 8HF + Свойства простых веществ: Mo, W1) Растворение металлов:а) W + 8HF + 2HNO3 = H2[WF8] + 2NO +4H2O](/img/thumbs/442fd9b1cac7bebe5e36534161a4dc2f-800x.jpg)
![Переходные элементы Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияхромит натрия (соль несуществующей хромистой кислоты)СrO3](/img/thumbs/477f5af01f1da1a19b73a88df1d7cfcb-800x.jpg)






![Переходные элементы Na15[MoVI126MoV28O462H14(H2O)70] ~400H2O A. Müller, 19963.6 nmГигантское колесо- Mo154 Na15[MoVI126MoV28O462H14(H2O)70] ~400H2O A. Müller, 19963.6 nmГигантское колесо-](/img/thumbs/63a0fb0cadfccb83a837ca6cb87455aa-800x.jpg)
![Переходные элементы Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– А. Мюллер, 2002 Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– А. Мюллер, 2002](/img/thumbs/147c80f1ec485e1fbbd6e5e22a9a1d96-800x.jpg)















![Переходные элементы Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных растворах [Mn(H2O)6]2+Нерастворимые соли:MnCO3, Соли Mn2+Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных растворах [Mn(H2O)6]2+Нерастворимые соли:MnCO3, MnS, MnC2O4MnCl2 + (NH4)2S](/img/thumbs/fa2e77c0251f69b39d939a31856b86b1-800x.jpg)