Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон и периодическая система элементов Д.И. Менделеева
Содержание
- 1. Периодический закон и периодическая система элементов Д.И. Менделеева
- 2. Периодическая таблица химических элементов Периоды - горизонтальные ряды
- 3. Группы - вертикальные столбцы элементов с одинаковым числом
- 4. Сопоставление разных таблицКороткопериодная «школьная» таблица. Элементы подгруппы
- 5. Основные понятия теории строения атомовЭнергетический уровень. Количество
- 6. Основные понятия теории строения атомовs орбиталиp подуровниВсего
- 7. Принцип заполнения электронных орбиталейнеспаренный электронспаренные электроныПравило Хунда:
- 8. Радиус атома с заполнением орбиталей в периоде
- 9. Поскольку окислительно – восстановительные свойства атомов оказывают
- 10. Восстановительные свойства атомов (способность терять электроны при
- 11. Электроотрицательность в периоде увеличивается с возрастанием заряда
- 12. О.С. Габриелян, И.Г. Остроумов Химия. Выпускной экзамен
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Периодическая таблица
химических элементов
Периоды - горизонтальные ряды химических элементов, всего
7 периодов. Периоды делятся на малые (I,II,III) и большие (IV,V,VI),
VII-незаконченный. (upd: Закончен. Атом с порядковым номером 118 назван в честь российского ученого Юрия Цолаковича Оганесяна – оганесон)Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
Слайд 3 Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем
электронном уровне, равным номеру группы.
Различают главные (А) и побочные
подгруппы (Б). Элементы главных подгрупп размещаются слева в ячейке (например: Be, Mg). Элементы побочных размещаются справа (например: Zn, Cd)Деление на главные и побочные подгруппы встречается в короткопериодных таблицах. В длиннопериодных такого деления нет. См. следующий слайд для сравнения этих таблиц
Периодическая таблица
химических элементов
Слайд 4Сопоставление разных таблиц
Короткопериодная «школьная» таблица. Элементы подгруппы Б окрашены синим.
Групп при этом VIII
Длиннопериодная таблица. Нет деления на А и
Б. 10 синих + 6 желтых + 2 розовых элемента 4-7 периодов из «школьной» таблички выстроились в одну линию и теперь групп XVIIIVs
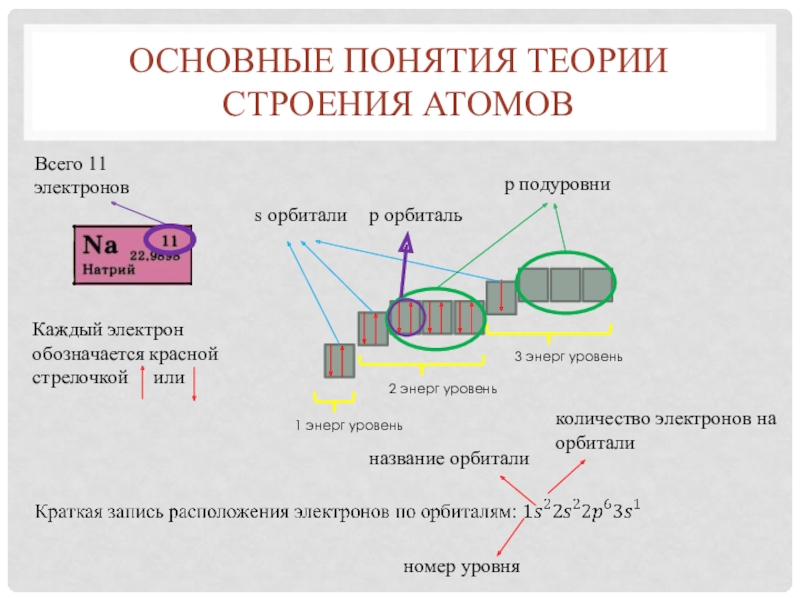
Слайд 5Основные понятия теории строения атомов
Энергетический уровень. Количество уровней соответствует номеру
периода элемента.
Орбиталь. Количество занятых орбиталей на последнем энергетическом уровне
соответствует номеру группы элемента следующим образом: IА,IIА – s орбиталь IIIA-VIIIA – p орбиталь. IБ-VIIIБ – d орбиталь (хотя правильнее говорить не орбиталь, а орбитальное число) 3 уровня
1 уровень
Слайд 6Основные понятия теории строения атомов
s орбитали
p подуровни
Всего 11 электронов
Каждый электрон
обозначается красной стрелочкой или
номер уровня
название орбитали
количество электронов
на орбиталиp орбиталь
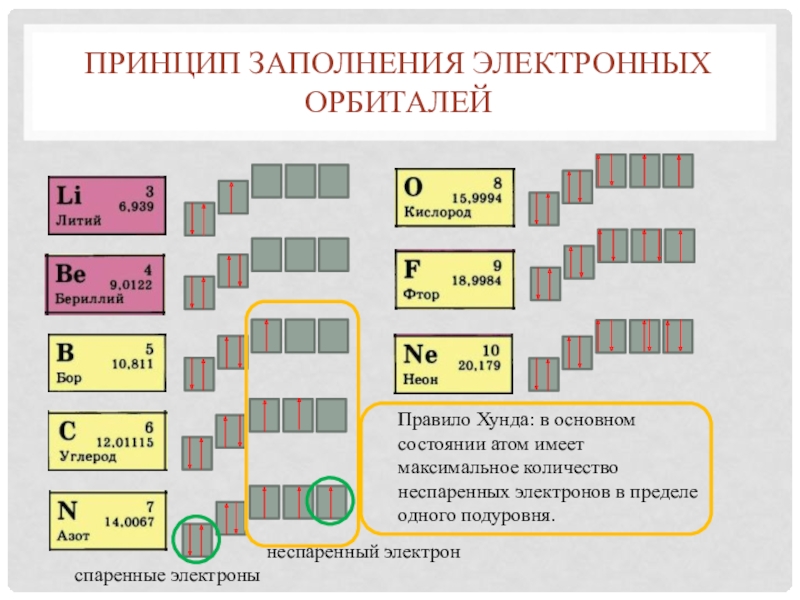
Слайд 7Принцип заполнения электронных орбиталей
неспаренный электрон
спаренные электроны
Правило Хунда: в основном состоянии
атом имеет максимальное количество неспаренных электронов в пределе одного подуровня.
Слайд 8Радиус атома с заполнением орбиталей в периоде уменьшается (движение слева
направо по таблице).
Радиус атома с увеличением количества энергетических уровней
в группе увеличивается (движение сверху вниз по таблице) Радиус иона с увеличением его заряда уменьшается. (картинки справа анион серы S с зарядом -2, нейтральный атом серы S c зарядом 0 и катион серы S с зарядом +6)
Изменение радиуса атома в периоде
Слайд 9 Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства
простых веществ и их соединений, то металлические свойства простых веществ
элементов главных подгрупп возрастают, в периодах – убывают, а неметаллические – соответственно, наоборот – в главных подгруппах убывают, а в периодах – возрастают.Окислительно-восстановительные
свойства
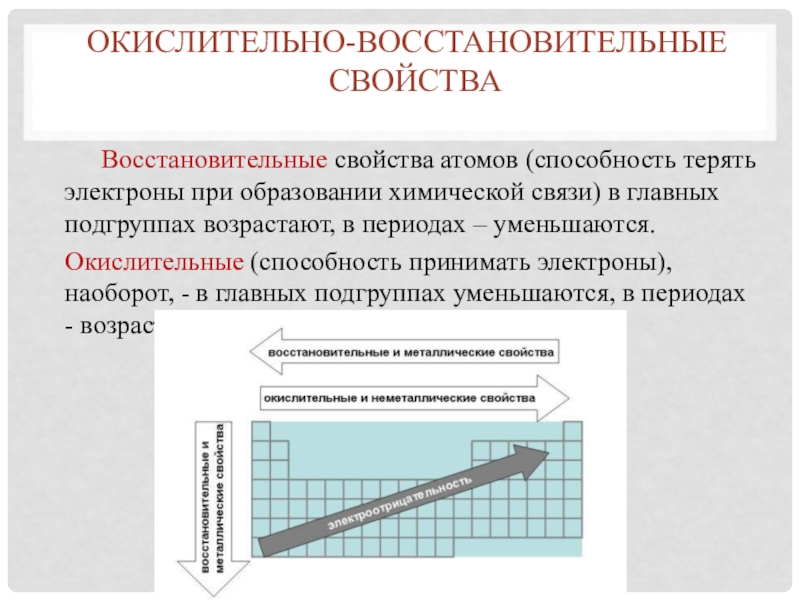
Слайд 10 Восстановительные свойства атомов (способность терять электроны при образовании химической связи)
в главных подгруппах возрастают, в периодах – уменьшаются.
Окислительные (способность
принимать электроны), наоборот, - в главных подгруппах уменьшаются, в периодах - возрастают Окислительно-восстановительные
свойства
Слайд 11 Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента,
то есть слева направо. В группе с увеличением числа электронных
слоев электроотрицательность уменьшается, то есть сверху вниз. Значит самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).Электроотрицательность