Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон. Периодическая система. Периодичность изменения свойств
Содержание
- 1. Периодический закон. Периодическая система. Периодичность изменения свойств
- 2. Периодический законсвойства химических элементов и образуемых ими соединений находятся в периодической зависимости от зарядов ядер атомов.
- 3. Периодическая система -единственная классификация элементов согласно закономерностям
- 4. Периодическая таблицаПринципиальный подход к построению таблиц :
- 5. Автограф полной таблицы элементов Д.И. Менделеева,
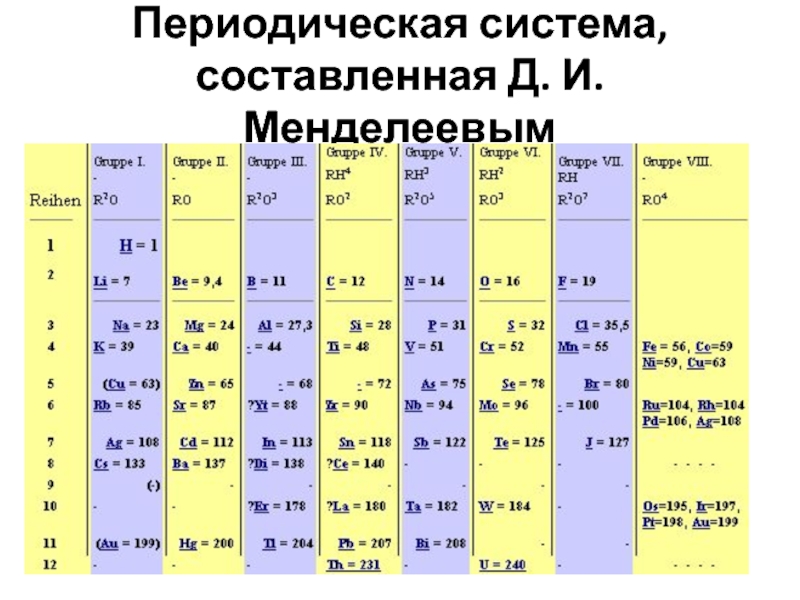
- 6. Периодическая система, составленная Д. И. Менделеевым
- 7. Слайд 7
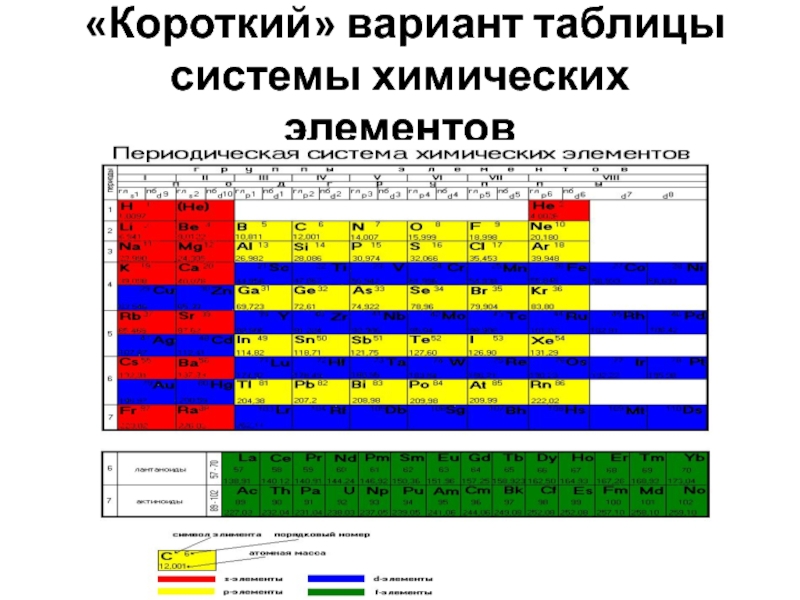
- 8. «Короткий» вариант таблицы системы химических элементов
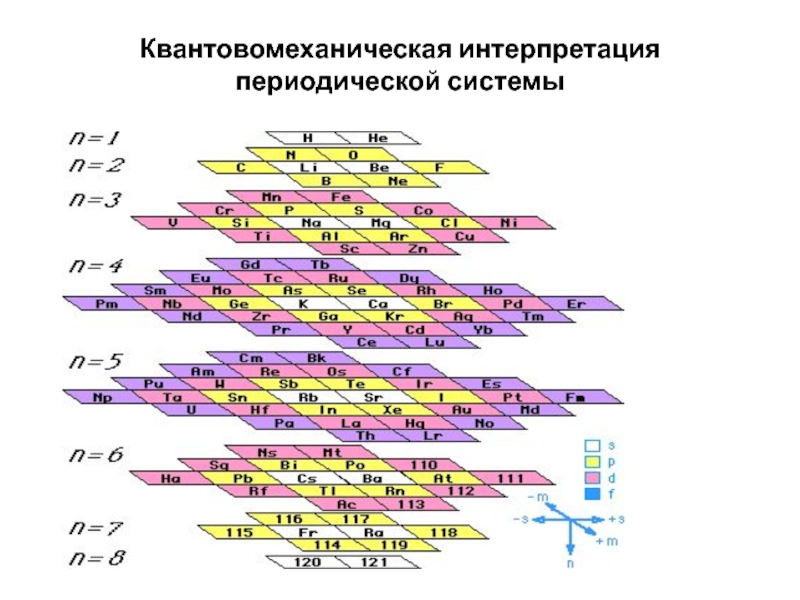
- 9. Квантовомеханическая интерпретация периодической системы
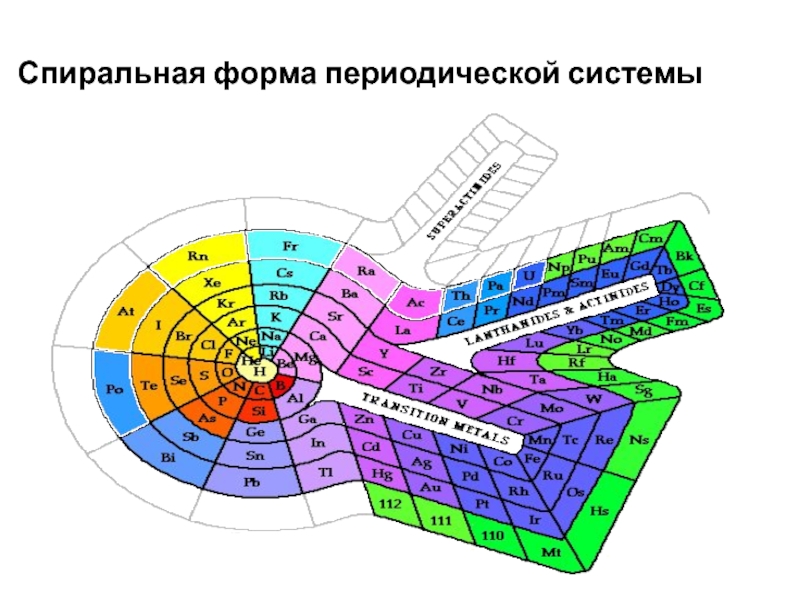
- 10. Спиральная форма периодической системы
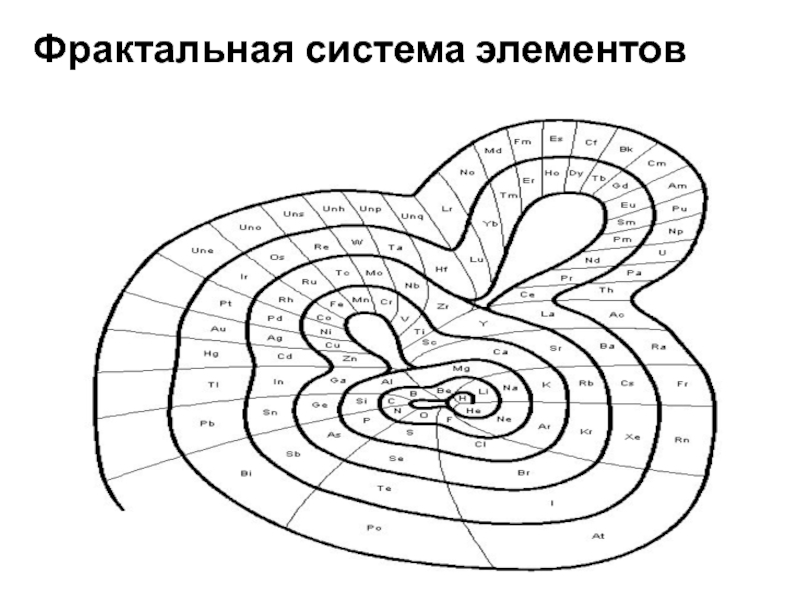
- 11. Фрактальная система элементов
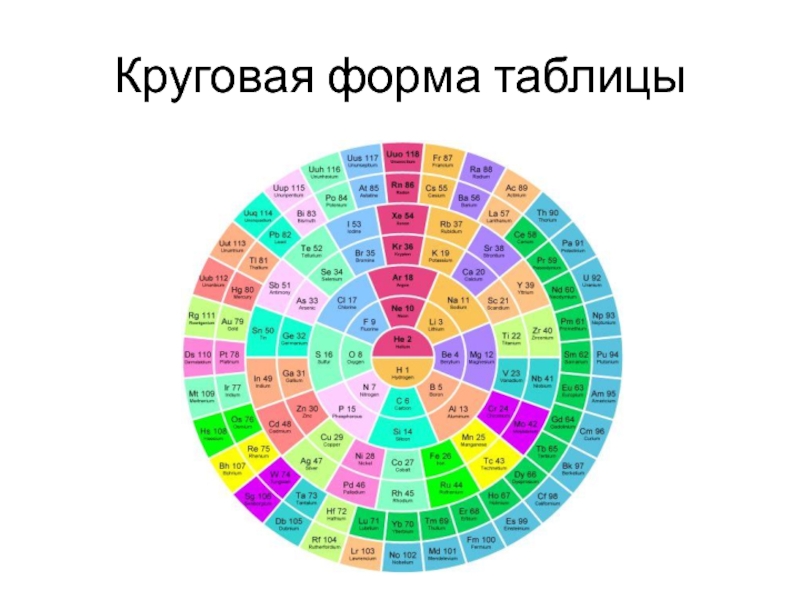
- 12. Круговая форма таблицы
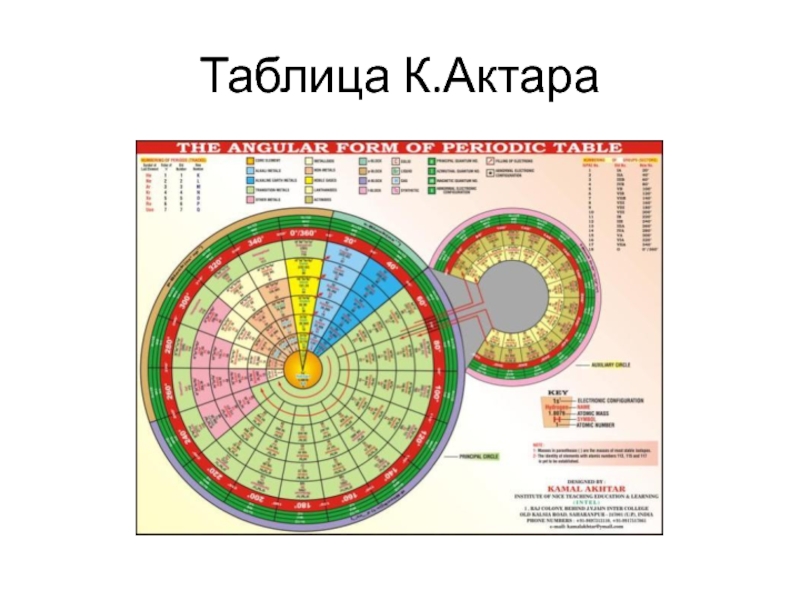
- 13. Таблица К.Актара
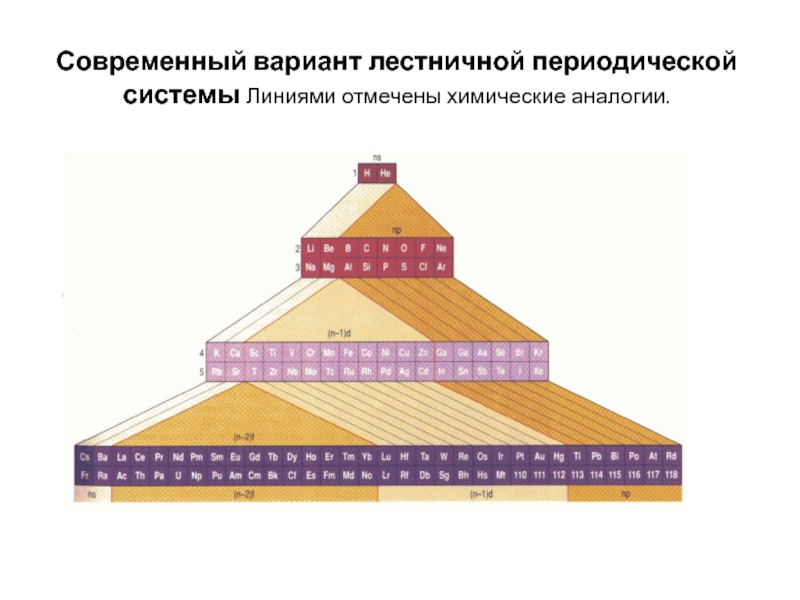
- 14. Современный вариант лестничной периодической системы Линиями отмечены химические аналогии.
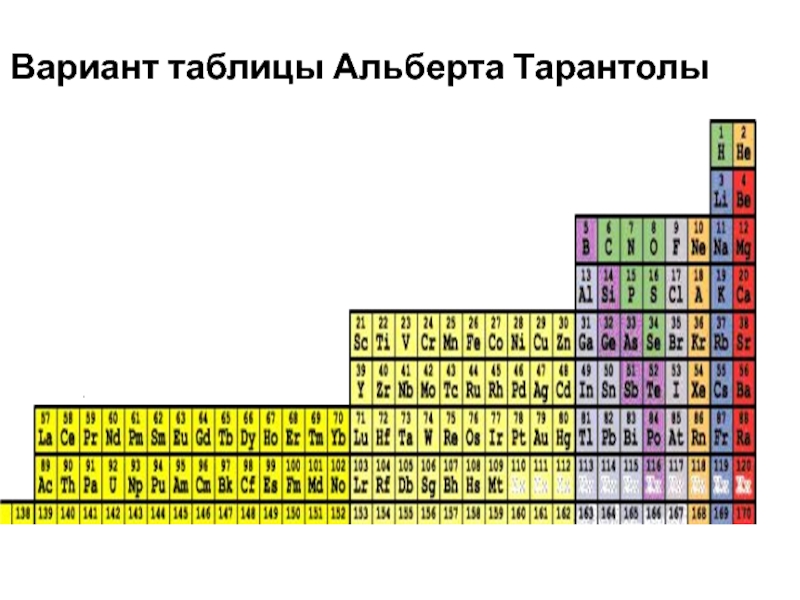
- 15. Вариант таблицы Альберта Тарантолы
- 16. Периодическая таблицаВ 2008 г. в Японии вышла
- 17. периодичность свойств химических элементов заряд ядраструктура внешней (предвнешней) электронной оболочкиразмеры атомаэнергия ионизацииэнергия сродства к электронуэлектроотрицательность
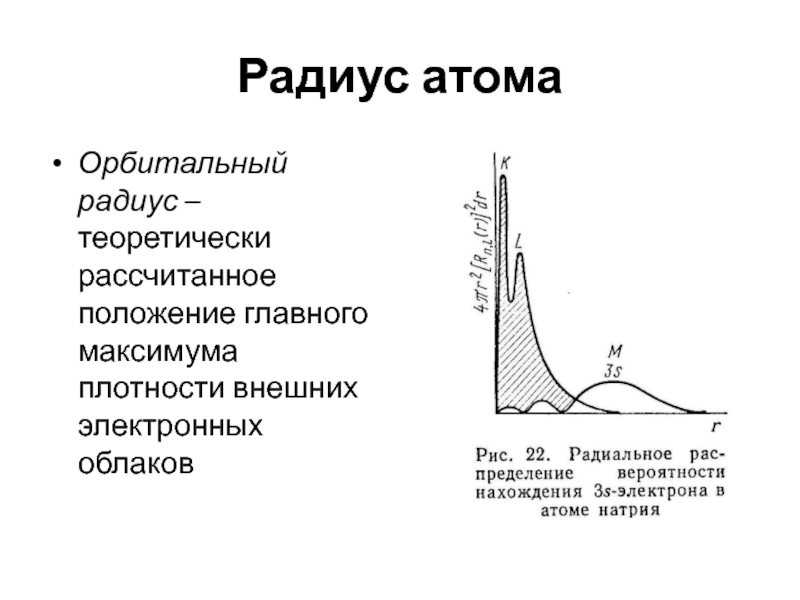
- 18. Радиус атомаОрбитальный радиус – теоретически рассчитанное положение главного максимума плотности внешних электронных облаков
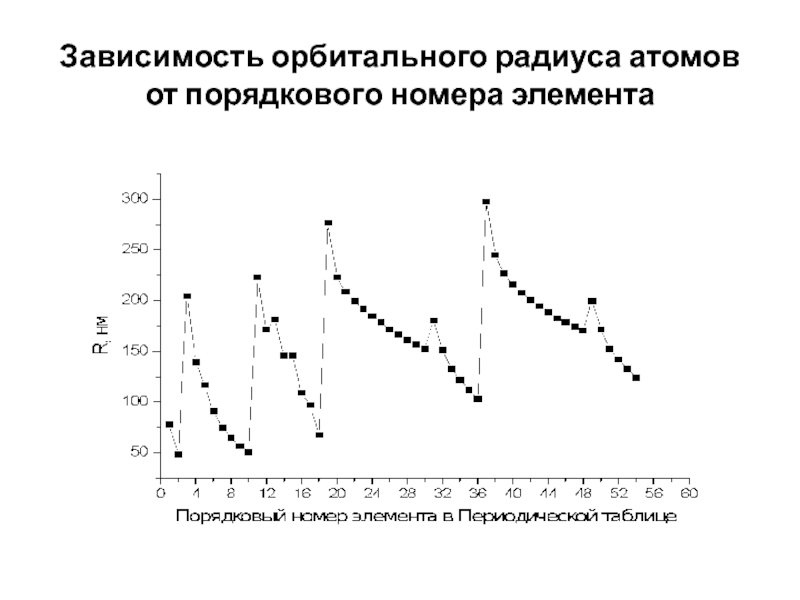
- 19. Зависимость орбитального радиуса атомов от порядкового номера элемента
- 20. Эффективный радиус атомаковалентныйметаллическийионныйВан-дер-Ваальсовский
- 21. Ковалентный радиус равен половине межъядерного расстояния в
- 22. Металлический радиус Равен половине расстояния между центрами
- 23. Для золота Auорбитальный радиус атома – 0,119
- 24. Ионные радиусы эффективные радиусы, рассчитанные для кристаллов с преимущественно ионным типом связи.
- 25. Ван-дер-Ваальсовский радиус Рассчитывается из межъядерных расстояний в кристаллах благородных газов или из межмолекулярных расстояний
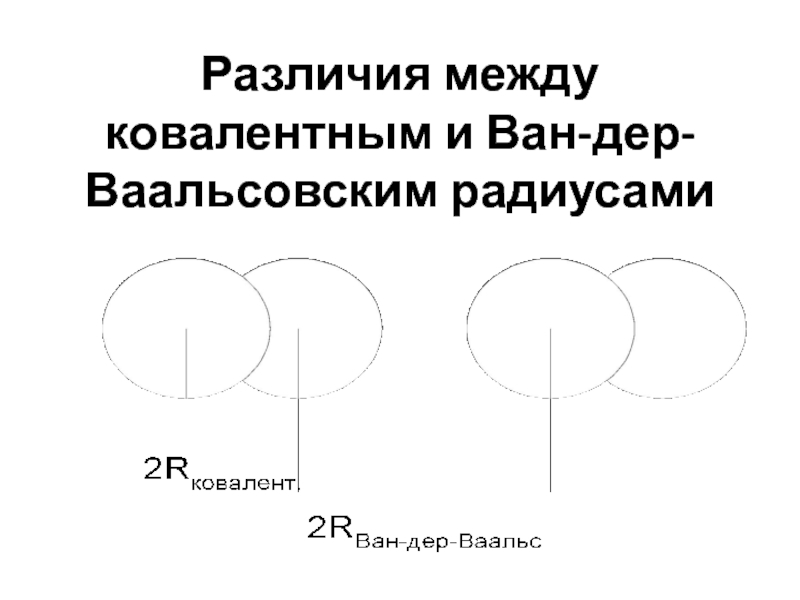
- 26. Различия между ковалентным и Ван-дер-Ваальсовским радиусами
- 27. ЭНЕРГИЯ ИОНИЗАЦИИ Энергия ионизации – энергия, необходимая
- 28. Величина энергии ионизации определяется:эффективным зарядом ядра; радиусом
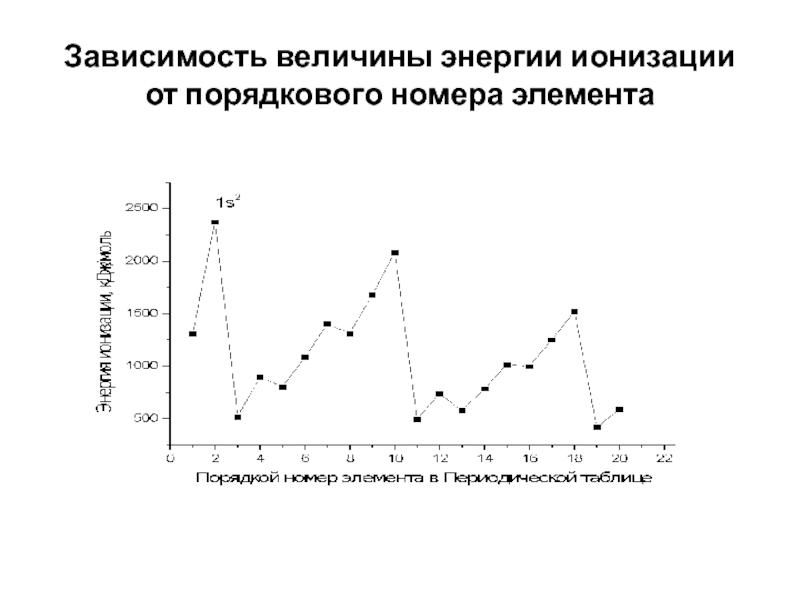
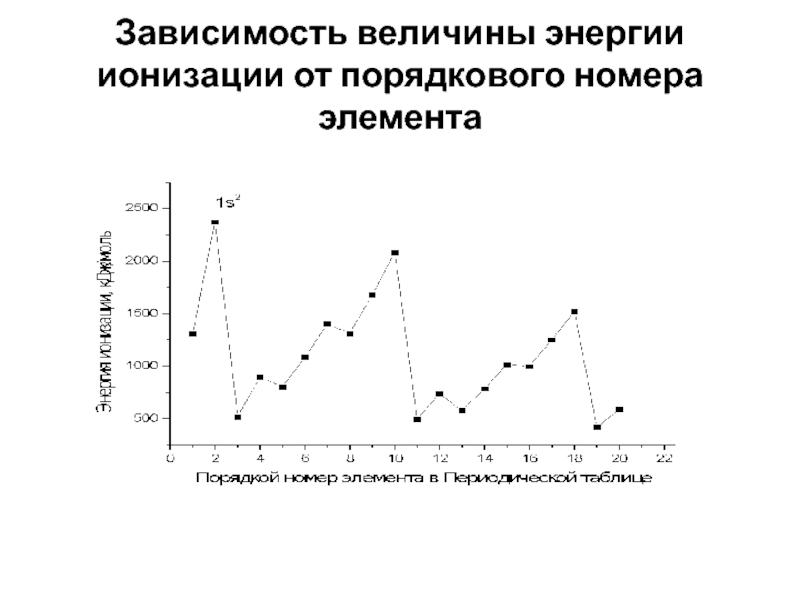
- 29. Зависимость величины энергии ионизации от порядкового номера элемента
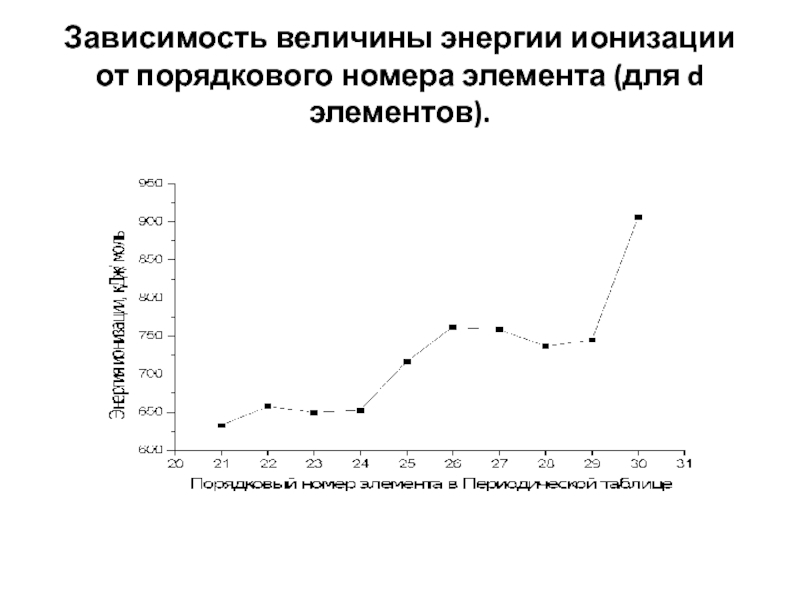
- 30. Зависимость величины энергии ионизации от порядкового номера элемента (для dэлементов).
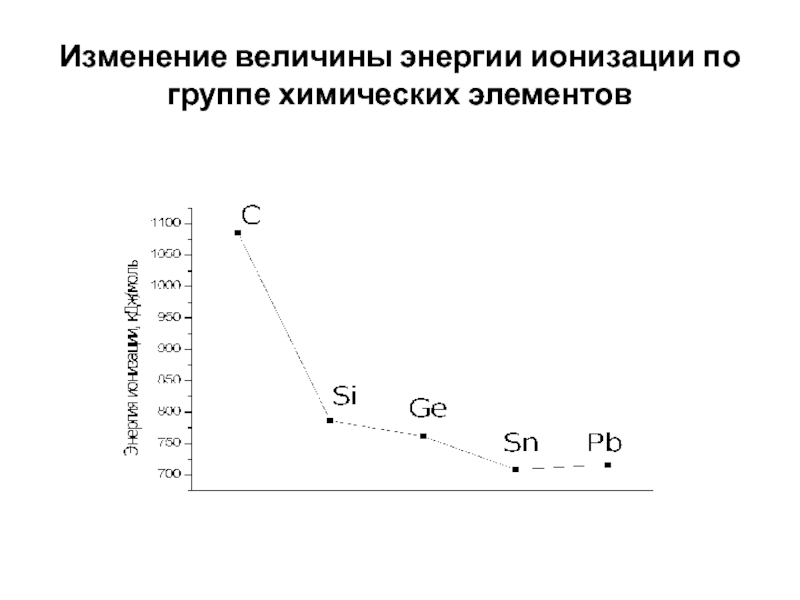
- 31. Изменение величины энергии ионизации по группе химических элементов
- 32. ЭНЕРГИЯ СРОДСТВА К ЭЛЕКТРОНУ Сродством к
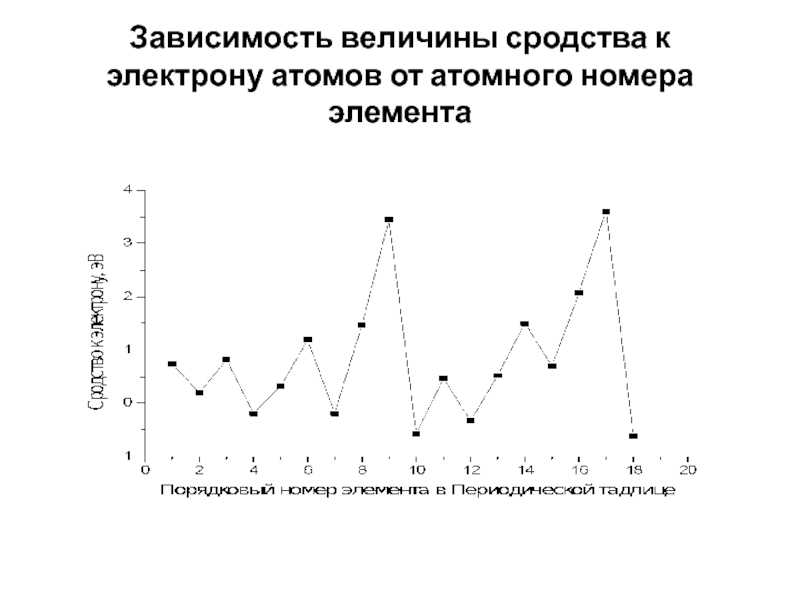
- 33. Зависимость величины сродства к электрону атомов от атомного номера элемента
- 34. Сродство к электрону для молекулPtF6
- 35. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ характеристика (условная величина) способности атома в
- 36. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬПо Малликену: χ =1/2(Еиониз+Еср-ва к электрону).По шкале
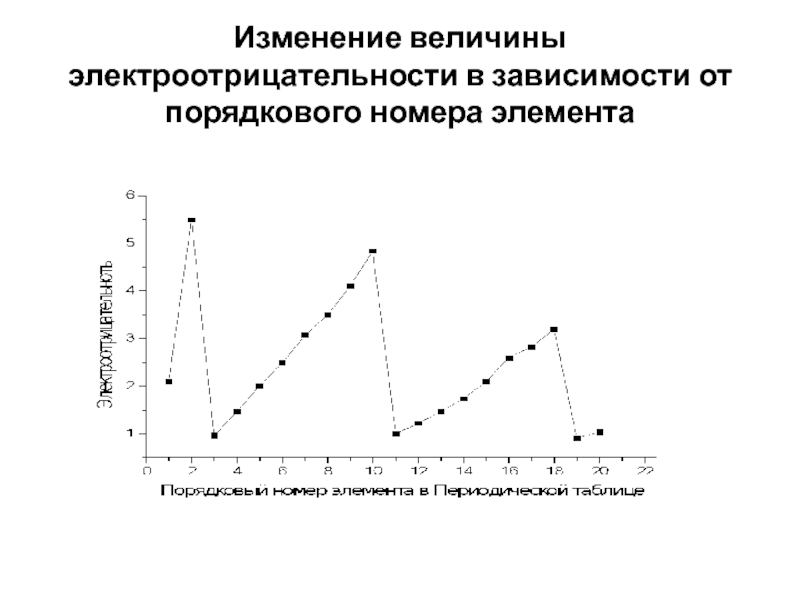
- 37. Изменение величины электроотрицательности в зависимости от порядкового номера элемента
- 38. Внутренняя периодичность немонотонное изменение свойств химических элементов по периоду
- 39. Зависимость величины энергии ионизации от порядкового номера элемента
- 40. В периодах (с увеличением порядкового номера):
- 41. В группах (с увеличением порядкового номера):
- 42. Вторичная периодичностьнемонотонное изменение свойств химических элементов по
- 43. Диагональная периодичностьLi - Mg (реакции с азотом
- 44. Диагональная периодичностьОсобенно часто диагональное сходство элементов проявляется
- 45. «Звездная» периодичность («геохимическая звезда»)
- 46. ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В
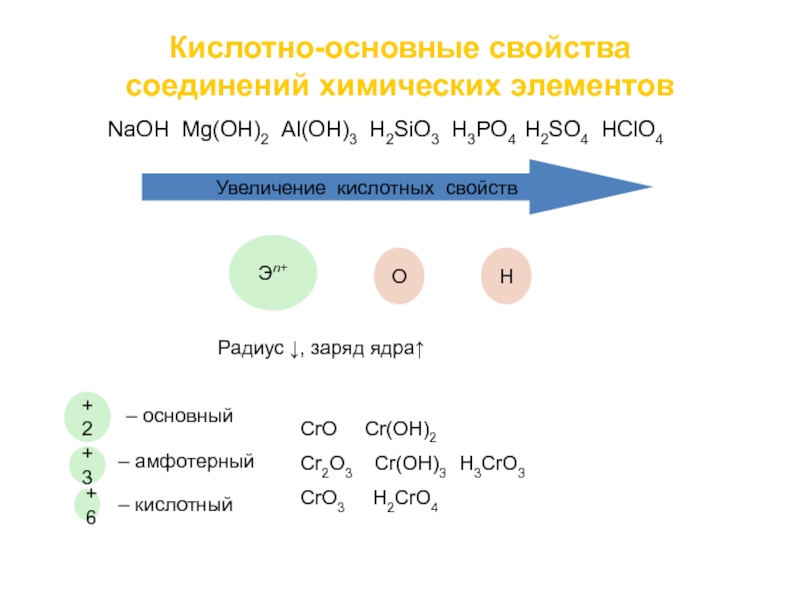
- 47. Увеличение кислотных свойствЭn+ОН Радиус , заряд ядраNaOН
- 48. В периодах (с увеличением порядкового номера):
- 49. ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ГРУППАХЭлементы
- 50. В группах А (с увеличением порядкового
- 51. ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ГРУППАХСходство
- 52. ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ В ЗАВИСИМОСТИ ОТ СТЕПЕНИ ОКИСЛЕНИЯ ЭЛЕМЕНТА
- 53. Границы периодической системы «Будущее не грозит периодическому закону разрушением, а только надстройки и развитие обещает»(Д.И.Менделеев, 1905 г.)
- 54. Верхняя граница периодической системы наличие электронов
- 55. Проблема синтеза трансурановых элементов: наличие электронов
- 56. Нижняя граница периодической системыНьютоний – Д.И. МенделеевПротон – супруги Кюри
- 57. Нижняя граница периодической системы Позитроний (Ps)
- 58. Нижняя граница периодической системыМюоний (Mu) μ⁺ мезон
- 59. Нижняя граница периодической системы Мезоатомы (нет
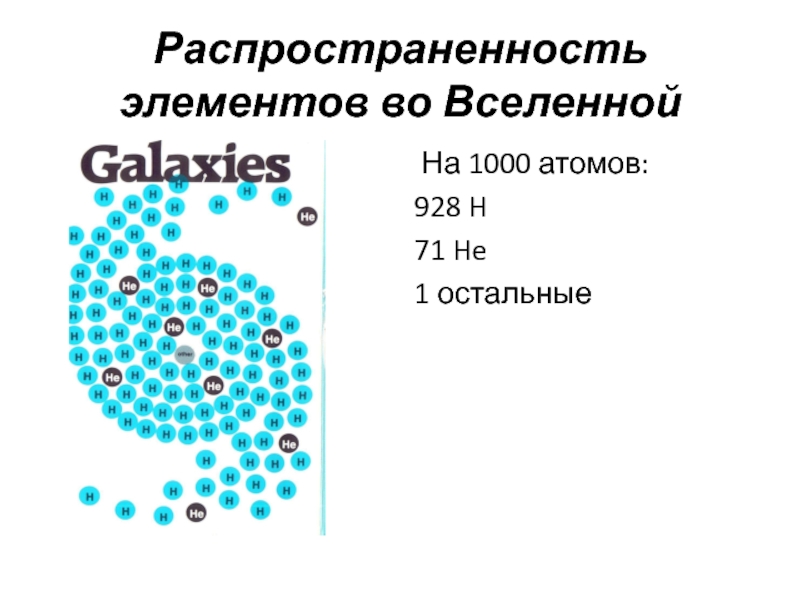
- 60. Распространенность элементов во Вселенной На 1000 атомов:928 H71 He1 остальные
- 61. Распространенность элементов в земной кореКларк элемента –
- 62. Химические элементы в организме человекаНа 1000 атомов:632 H256 O95 C13 N2 P
- 63. Скачать презентанцию
Периодический законсвойства химических элементов и образуемых ими соединений находятся в периодической зависимости от зарядов ядер атомов.
Слайды и текст этой презентации
Слайд 1Периодический закон. Периодическая система. Периодичность изменения свойств химических элементов
Слайд 2Периодический закон
свойства химических элементов и образуемых ими соединений находятся в
периодической зависимости от зарядов ядер атомов.
Слайд 3Периодическая система -
единственная классификация элементов согласно закономерностям строения электронных оболочек
их атомов;
период - последовательный ряд элементов, в атомах которых
происходит заполнение электронами одинакового числа электронных слоев; группа –объединяет элементы, имеющие одинаковое строение внешних электронных оболочек атомов.
Слайд 4Периодическая таблица
Принципиальный подход к построению таблиц : элементы располагаются в
порядке возрастания заряда ядер их атомов.
Периодических таблиц известно более
500. Слайд 5Автограф полной таблицы элементов Д.И. Менделеева, переписанной набело для отправки
в типографию 17 февраля 1869 г.
Листок с «Опытом системы элементов»
Д.И. Менделеева отпечатан. На французском языке для рассылки иностранным ученымПериодическая таблица,
составленная Д. И. Менделеевым
Слайд 16Периодическая таблица
В 2008 г. в Японии вышла книга под названием
Периодическая таблица: Изучение основ химии при помощи "мoэ", героинями которого
являются 118 девочек-элементов.Слайд 17
периодичность свойств химических элементов
заряд ядра
структура внешней (предвнешней) электронной оболочки
размеры атома
энергия
ионизации
энергия сродства к электрону
электроотрицательность
Слайд 18Радиус атома
Орбитальный радиус – теоретически рассчитанное положение главного максимума плотности
внешних электронных облаков
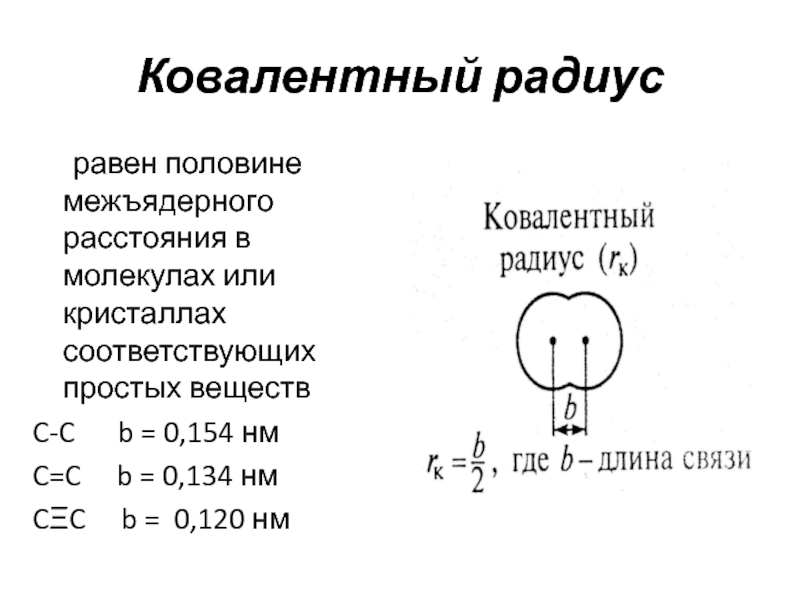
Слайд 21Ковалентный радиус
равен половине межъядерного расстояния в молекулах или кристаллах
соответствующих простых веществ
C-C b = 0,154 нм
C=C
b = 0,134 нмCΞC b = 0,120 нм
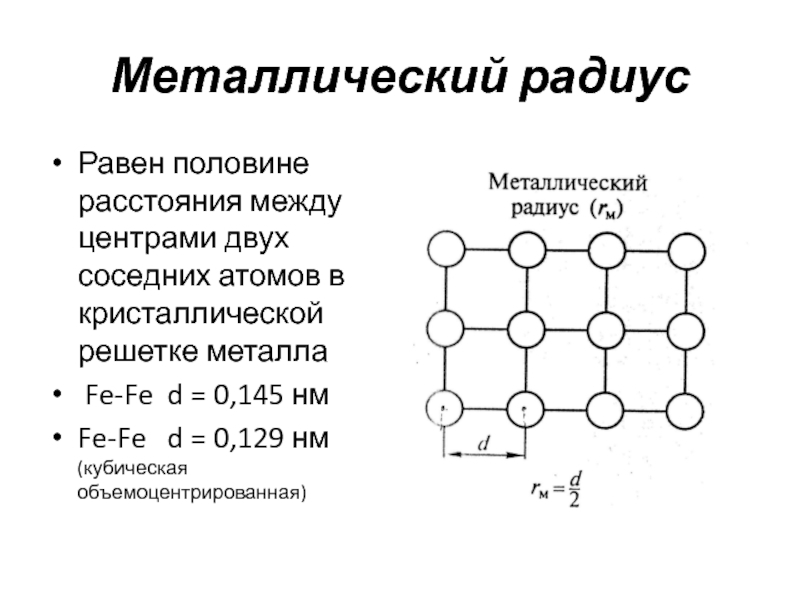
Слайд 22Металлический радиус
Равен половине расстояния между центрами двух соседних атомов
в кристаллической решетке металла
Fe-Fe d = 0,145 нм
Fe-Fe
d = 0,129 нм (кубическая объемоцентрированная)Слайд 23Для золота Au
орбитальный радиус атома – 0,119 нм;
ковалентный радиус атома
– 0,134 нм;
металлический радиус атома – 0,146 нм.
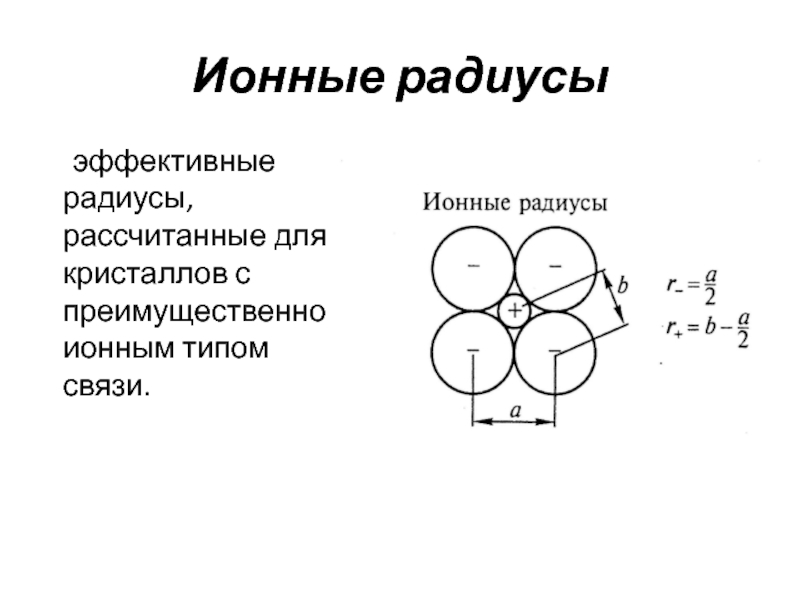
Слайд 24Ионные радиусы
эффективные радиусы, рассчитанные для кристаллов с преимущественно ионным
типом связи.
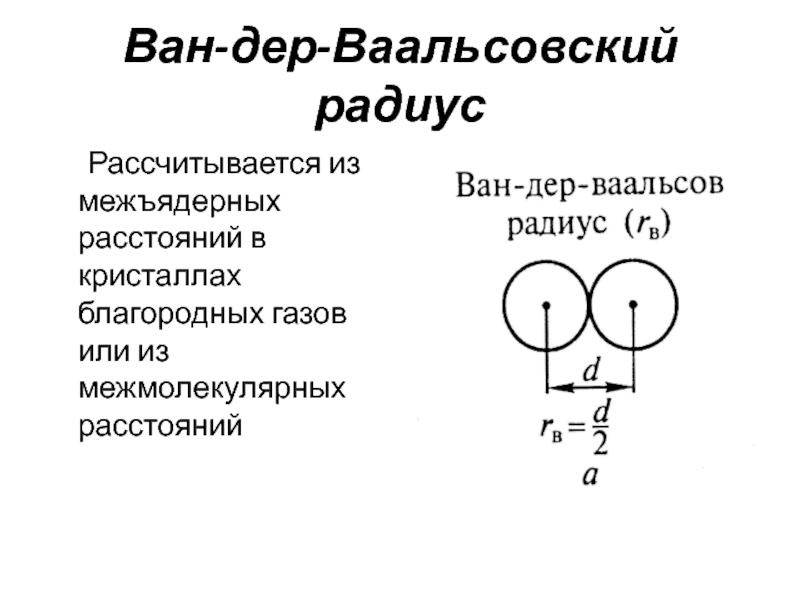
Слайд 25Ван-дер-Ваальсовский радиус
Рассчитывается из межъядерных расстояний в кристаллах благородных газов
или из межмолекулярных расстояний
Слайд 27ЭНЕРГИЯ ИОНИЗАЦИИ
Энергия ионизации – энергия, необходимая для превращения 1 моль
атомов в газовой фазе в 1 моль катионов в газовой
фазе.Единицы измерения- кДж/моль, эВ/атом.
Потенциал ионизации - наименьшее напряжение электрического поля, при котором происходит отрыв электрона от невозбужденного атома.
Единицы измерения – В.
Слайд 28Величина энергии ионизации
определяется:
эффективным зарядом ядра;
радиусом атома;
конфигурацией электронной оболочки;
эффектом
экранирования электронной оболочки;
проникающей способностью электронов внешнего слоя.
Li – e-
= Li⁺ E₁ = 5,39 эВLi⁺ – e- = Li⁺⁺ E₂ = 75,65 эВ
Li⁺⁺ – e- = Li⁺⁺⁺ E₃ = 122,42 эВ
Слайд 32
ЭНЕРГИЯ СРОДСТВА К ЭЛЕКТРОНУ
Сродством к электрону F называется энергетический эффект
присоединения электрона к нейтральному атому Э с превращением его в
отрицательный ион Э-:Э + e- = Э-+ F; H + e- = H-; E = 0,75 эВ.
Энергия сродства к электрону = f(заряд ядра (Z), ra, электронной конфигурации).
Слайд 34Сродство к электрону для молекул
PtF6 Е=6,8 эВ, т.е.
он способен отнимать электроны даже у молекулы кислорода, превращая ее
в ион O2+ (образуются кристаллы [O2PtF6]Слайд 35ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ характеристика (условная величина) способности атома в химическом соединении смещать электронную
плотность в свою сторону
По Полингу шкала электроотрицательности рассчитана на основании
экспериментальных значений энтальпии образования связей в двухатомных молекулах;наибольшее значение электроотрицательности имеет самый активный неметалл – фтор (χ=4,0), а наименьшее значение – щелочные металлы – церий и франций (χ=0,7)
Слайд 36ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
По Малликену: χ =1/2(Еиониз+Еср-ва к электрону).
По шкале Оллреда-Рохова электроотрицательность определяется
электрическим полем на поверхности атома; ее величина фактически является мерой
стабильности электронной оболочки атома. Для атома Не χ = 5,50.Слайд 40
В периодах (с увеличением порядкового номера):
увеличивается заряд ядра,
увеличивается
число электронов на внешних атомных орбиталях,
уменьшается радиус атомов,
увеличивается
прочность связи электронов с ядром (энергия ионизации), увеличивается электроотрицательность.
Слайд 41
В группах (с увеличением порядкового номера):
увеличивается заряд ядра,
увеличивается радиус
атомов (только в А-группах),
уменьшается прочность связи электронов с ядром
(энергия ионизации; только в А-группах), уменьшается электроотрицательность (только в А-группах).
Слайд 42Вторичная периодичность
немонотонное изменение свойств химических элементов по группе
Энергия сродства к
электрону
F 3,50 эВ
Cl
3,61 эВBr 3,54 эВ
I 3,29 эВ
Слайд 43Диагональная периодичность
Li - Mg (реакции с азотом и углеродом; карбонаты
и фосфаты нерастворимы);
Be - Al (взаимодействуют со щелочами, гидроксиды амфотерны,
соединения склонны к полимеризации);B - Si (простые вещества инертны и тугоплавки, образуют кислотные оксиды, галогениды подвергаются гидролизу)
Ионный потенциал = отношение заряда иона к радиусу иона (Z/R) (Be – 5,9; Al – 5,9).
Слайд 44Диагональная периодичность
Особенно часто диагональное сходство элементов проявляется в явлении изоморфного
замещения одними элементами других в кристаллах – гетеровалентный изоморфизм
Примером является
диагональ Na+-Ca2+-Y3+ с ионными радиусами 0,98; 1,06 и 1,06 Å.Слайд 46
ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ПЕРИОДАХ
Свойства простых веществ
и их соединений (оксидов, гидроксидов,водородных соединений) по периоду изменяются от
металлических через амфотерные к неметаллическим.Слайд 47Увеличение кислотных свойств
Эn+
О
Н
Радиус , заряд ядра
NaOН Mg(OH)2 Al(OH)3
H2SiO3 H3PO4 H2SO4 HСlO4
+2
+3
+6
– основный
– амфотерный
– кислотный
CrO Cr(OH)2
Cr2O3 Cr(OH)3 H3CrO3
CrO3 H2CrO4
Кислотно-основные свойства
соединений химических элементов
Слайд 48
В периодах (с увеличением порядкового номера):
усиливаются окислительные свойства простых
веществ ("неметалличность");
ослабевают восстановительные свойства простых веществ ("металличность");
ослабевает основный характер
гидроксидов и соответствующих оксидов; возрастает кислотный характер гидроксидов и соответствующих оксидов.
Слайд 49ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ГРУППАХ
Элементы второго периода аналогов
не имеют.
В каждой А-группе (кроме VIII) металлические свойства простых веществ
и основный характер соединений (вследствие увеличения радиуса атома) сверху вниз усиливаются.Слайд 50
В группах А (с увеличением порядкового номера):
ослабевают окислительные свойства простых
веществ («неметалличность»),
усиливаются восстановительные свойства простых веществ ("металличность»),
возрастает основный
характер гидроксидов и соответствующих оксидов; ослабевает кислотный характер гидроксидов и соответствующих оксидов;
снижается устойчивость водородных соединений (повышается их восстановительная активность).
Слайд 51ХАРАКТЕР ИЗМЕНЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ГРУППАХ
Сходство между элементами групп
А и групп В (главных и побочных подгрупп) наглядно проявляется
в соединениях с максимальной степенью окисления. Например, Cl2O7 и Mn2O7 – кислотные оксиды (хотя MnО – основный оксид).Слайд 53Границы периодической системы
«Будущее не грозит периодическому закону разрушением, а только
надстройки и развитие обещает»
(Д.И.Менделеев, 1905 г.)
Слайд 54
Верхняя граница
периодической системы
наличие электронов в атоме
релятивистский эффект
Z = 200
радиоактивный распад
элементов
количество синтезируемых элементов
110Э – 5 атомов
проблемы идентификации
Слайд 55
Проблема синтеза трансурановых элементов:
наличие электронов в атоме – релятивистский эффект;
радиоактивный
распад элементов;
количество синтезируемых элементов (5 -10 атомов) и проблемы их
идентификацииВерхняя граница ≈200
Слайд 57
Нижняя граница периодической системы
Позитроний (Ps) – электрон и позитрон, вращающиеся
вокруг общего центра тяжести перед тем как аннигилировать.
«Атомный» вес
1/920, время жизни 10-10-10-7 с.Энергия связи электрона и позитрона = 6,8 эВ
Слайд 58Нижняя граница периодической системы
Мюоний (Mu)
μ⁺ мезон (мюон) и электрон
вокруг него
масса μ+ мезона = 200 масс электрона, атомный» вес
– 1/9, время жизни ~2·10-6 с.Рисунок из http://www.arxiv.org/abs/1311.6431
Слайд 59
Нижняя граница периодической системы
Мезоатомы (нет электронов)
μ⁻ мюон (заряд как
у электрона, масса в 207 раз больше) может замещать электрон.
Радиус орбиты мюона в 207 раз меньше, чем радиус орбиты электрона в атоме водорода. В тяжелых атомах орбита μ ⁻ мюона может находится даже внутри ядра.Протоний – протон + анти-протон
Слайд 61Распространенность элементов в земной коре
Кларк элемента – среднее содержание в
земной коре (в %)
О - 47 %
Si – 29,5 %
Al
– 8,05 %Fe – 4,65 %
Ca – 2,96 %
Na – 2,50 %
K – 2,50 %
Mg – 1,65 %