Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Порядок включения лекарств в клинические протоколы. Внедрение клинических
Содержание
- 1. Порядок включения лекарств в клинические протоколы. Внедрение клинических
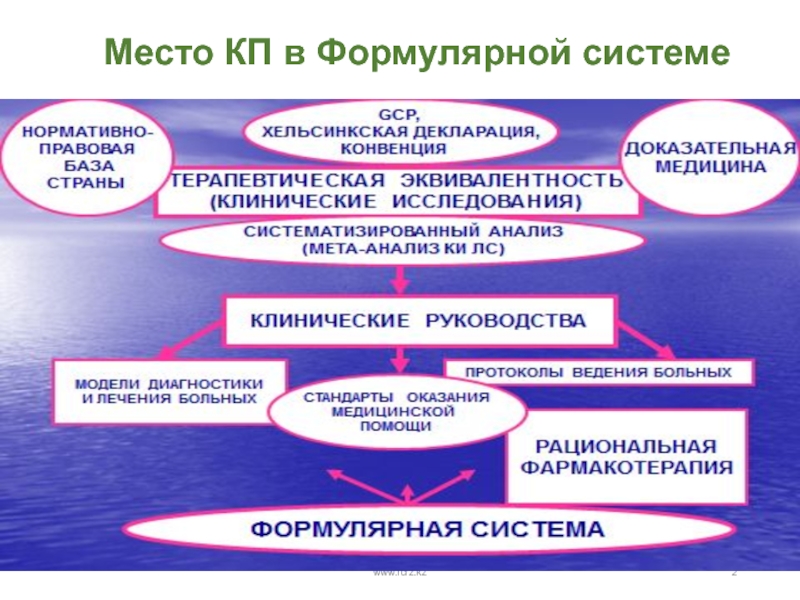
- 2. Место КП в Формулярной системеwww.rcrz.kzwww.rcrz.kz
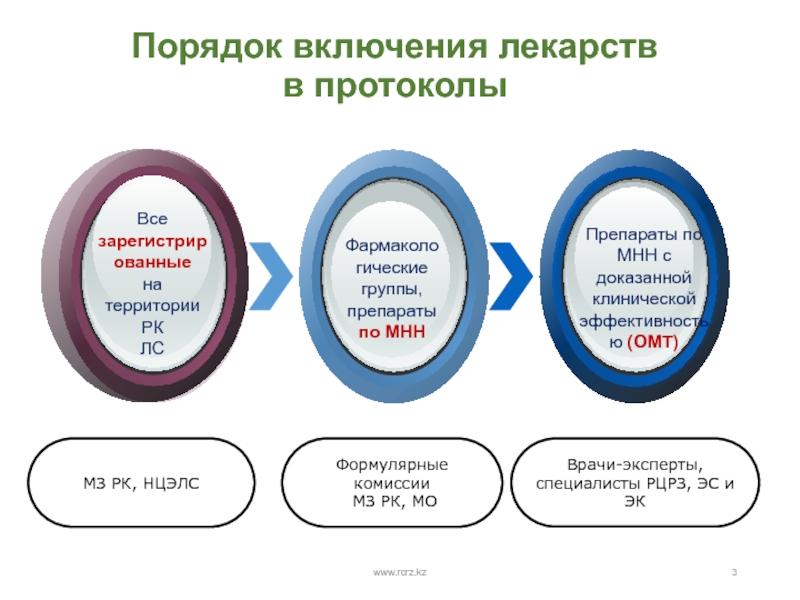
- 3. Порядок включения лекарств в протоколыwww.rcrz.kz
- 4. Оценка лекарственных препаратов: специальные вопросы Режимы дозирования:
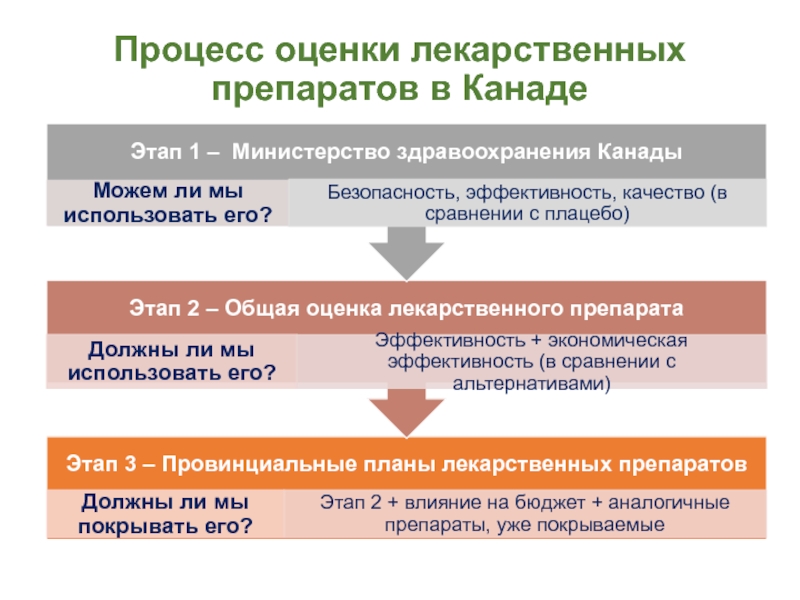
- 5. Процесс оценки лекарственных препаратов в Канаде
- 6. Оценка безопасности фармакотерапии 1. По типу:- побочные
- 7. 2. По частоте побочные реакции подразделяются на:-
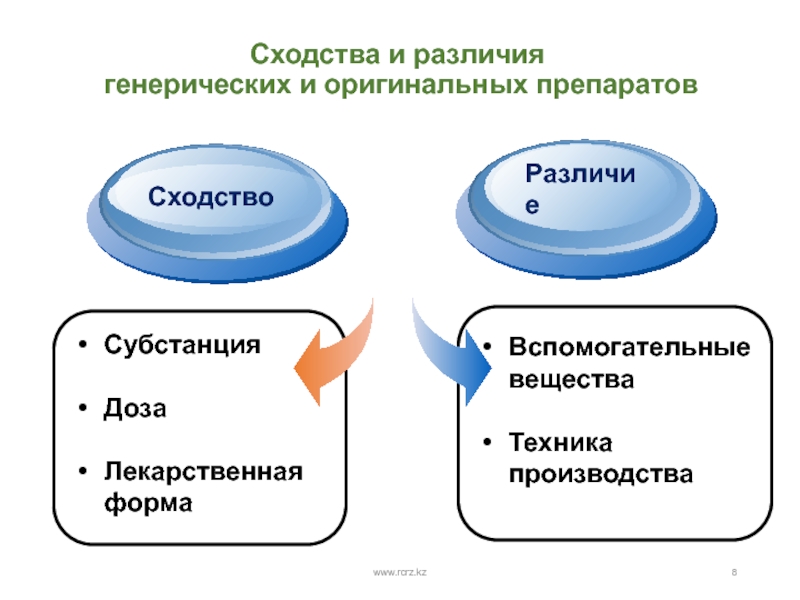
- 8. Сходства и различия генерических и оригинальных препаратовwww.rcrz.kzСубстанция ДозаЛекарственная формаTitleAdd your textВспомогательные веществаТехника производстваСходствоРазличие
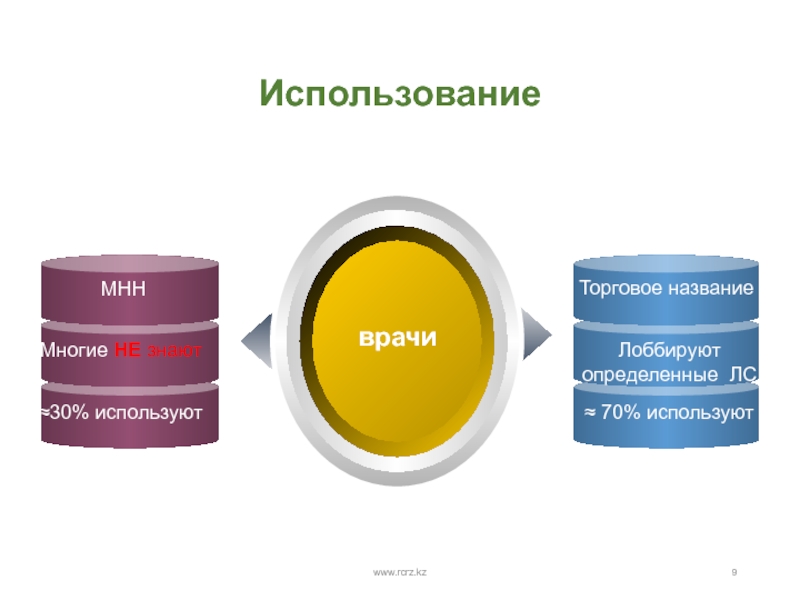
- 9. Использование www.rcrz.kz
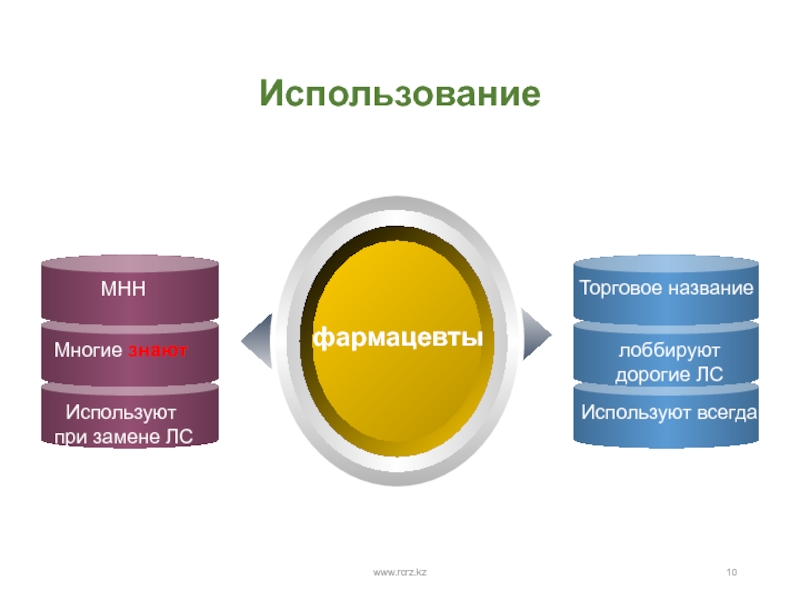
- 10. www.rcrz.kzИспользование
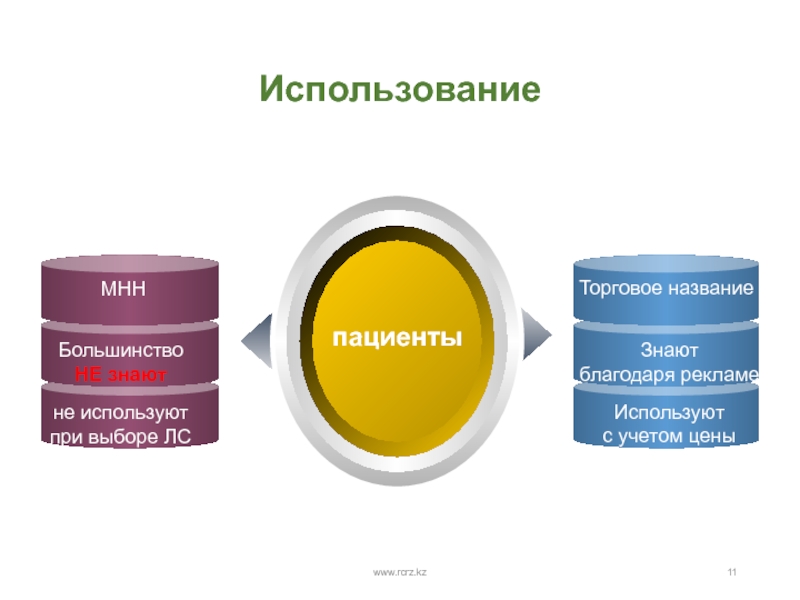
- 11. www.rcrz.kzИспользование
- 12. Преимущества использования генерических названий в КПСтандартизацияУнифицированностьВозможность
- 13. Недостатки использования генерических препаратовДанные об эффективности и
- 14. Сравнение терапевтической эффективности липримара и его дженериковЭффективная
- 15. Проблемы использования генерических препаратовПри некоторых нозологиях
- 16. Эффективность ренитека и его дженериков
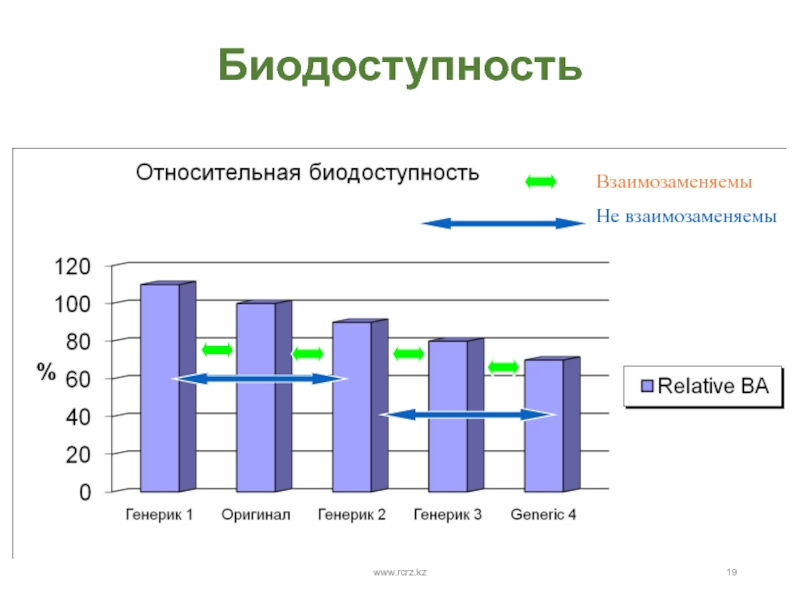
- 17. Взаимозаменяемость Терапевтическая эквивалентность – основное требование взаимозаменяемости Фармацевтическая эквивалентность не гарантирует эквивалентности фармакокинетическойwww.rcrz.kzwww.rcrz.kz
- 18. Биоэквивалентность «Два лекарственных препарата считают
- 19. Биодоступность www.rcrz.kzВзаимозаменяемыНе взаимозаменяемыwww.rcrz.kz
- 20. В 1984 году Управление по контролю за
- 21. Терапевтическая эквивалентностьВ опубликованном в 1998 году FDA
- 22. Кодировка ЛС (FDA)Код «А- препарат с подтвержденной
- 23. Мнение экспертовВ руководстве ВОЗ по регистрационным требованиям,
- 24. Выводы Включение в клинические протоколы ЛС по
- 25. РекомендацииВключать в клинические протоколы ЛС только по
- 26. Внедрение КП в клиническую практику
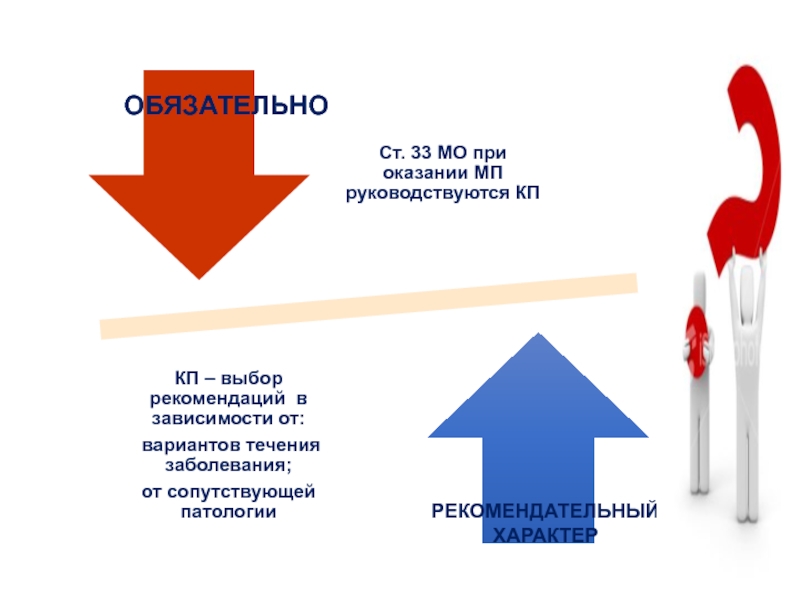
- 27. ОбязательноРекомендуемоПрименение КП …..
- 28. ОБЯЗАТЕЛЬНОРЕКОМЕНДАТЕЛЬНЫЙ ХАРАКТЕР
- 29. Источники:
- 30. Источники:
- 31. Источники:
- 32. Целью внедрения КП/СОП является достижение оптимальной степени
- 33. Определение КП – это документ, устанавливающий общие
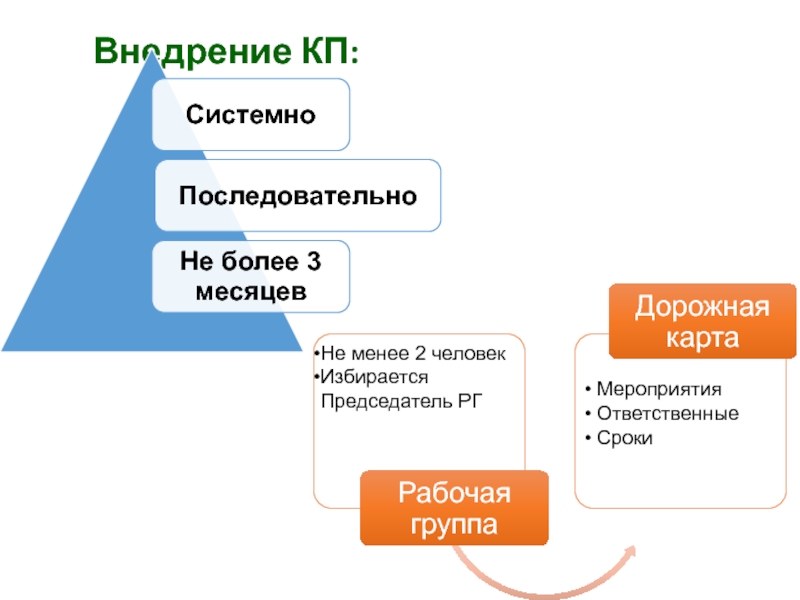
- 34. Внедрение КП:
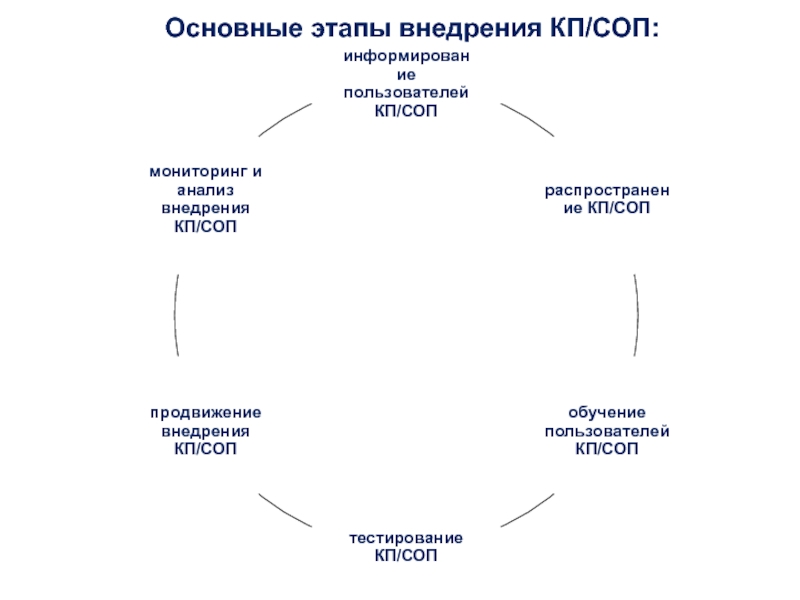
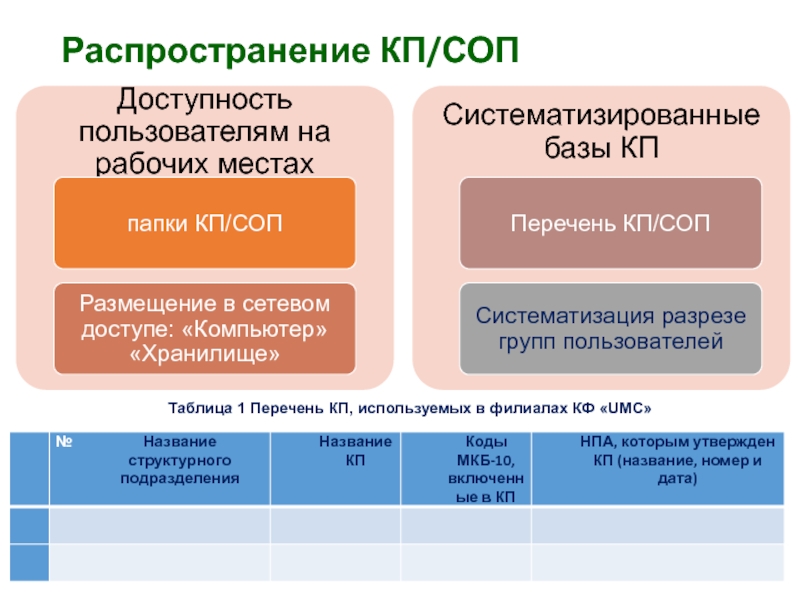
- 35. Основные этапы внедрения КП/СОП:
- 36. Информирование пользователейдоведение информации до пользователей КП/СОП через
- 37. Распространение КП/СОПТаблица 1 Перечень КП, используемых в филиалах КФ «UMC»
- 38. Тестирование КП/СОПЦелью тестирования КП/СОП является определение возможных
- 39. Продвижение и мониторинг внедрения КППодпись исполнителя служит
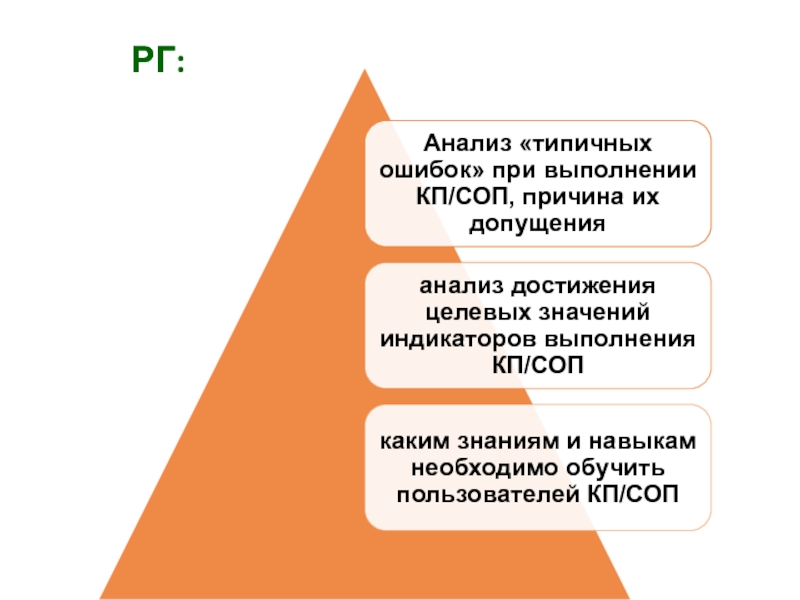
- 40. РГ:
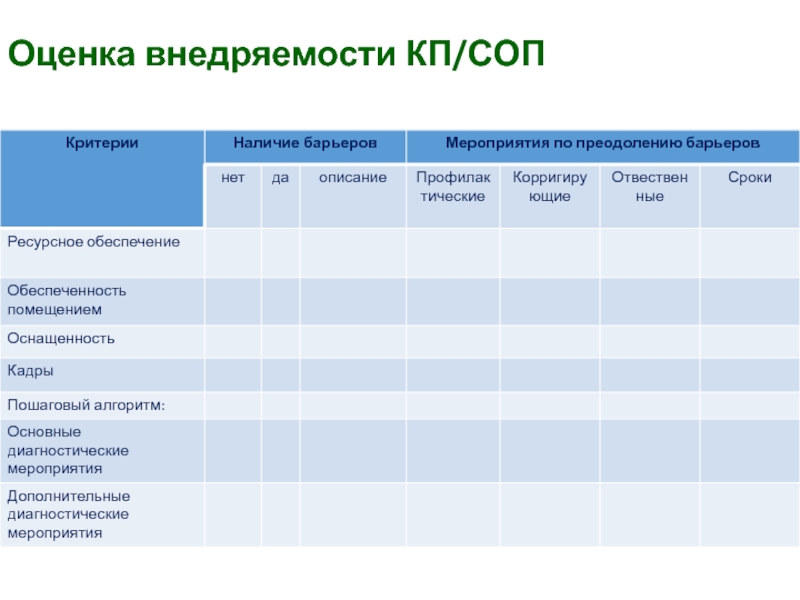
- 41. Оценка внедряемости КП/СОП
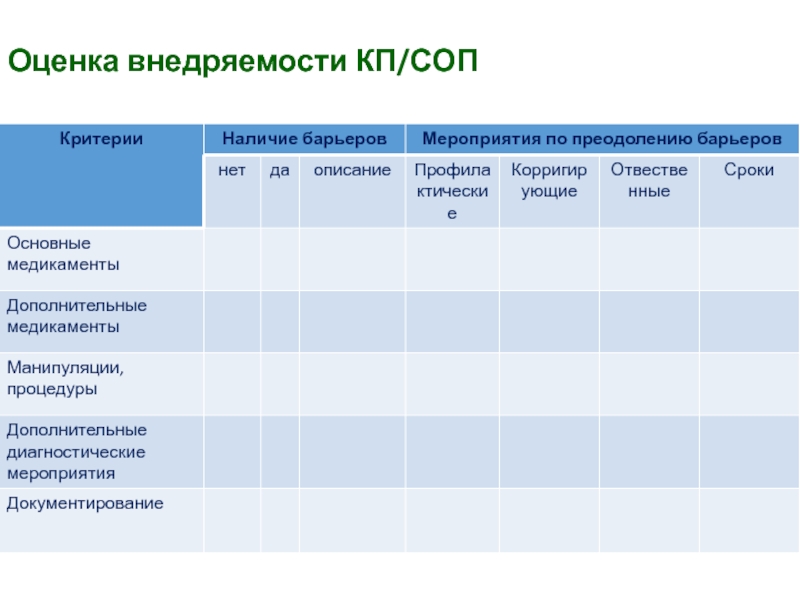
- 42. Оценка внедряемости КП/СОП
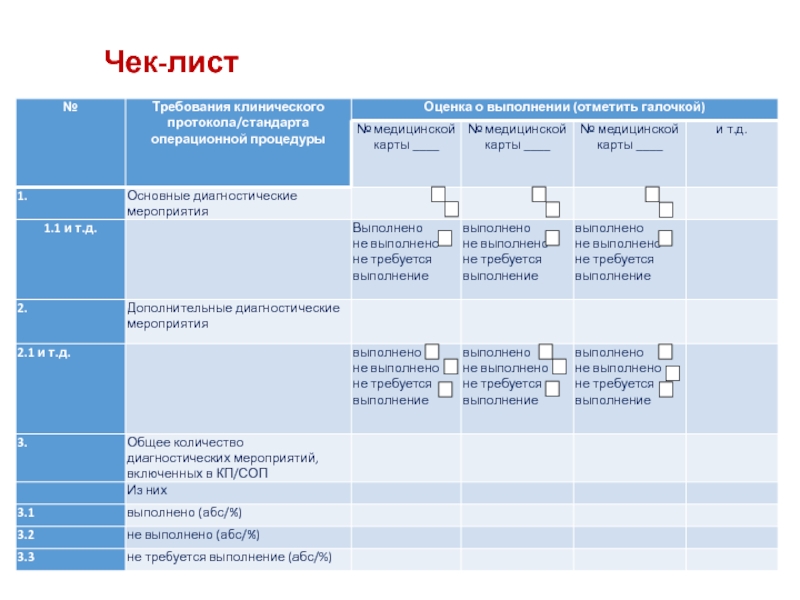
- 43. Чек-лист
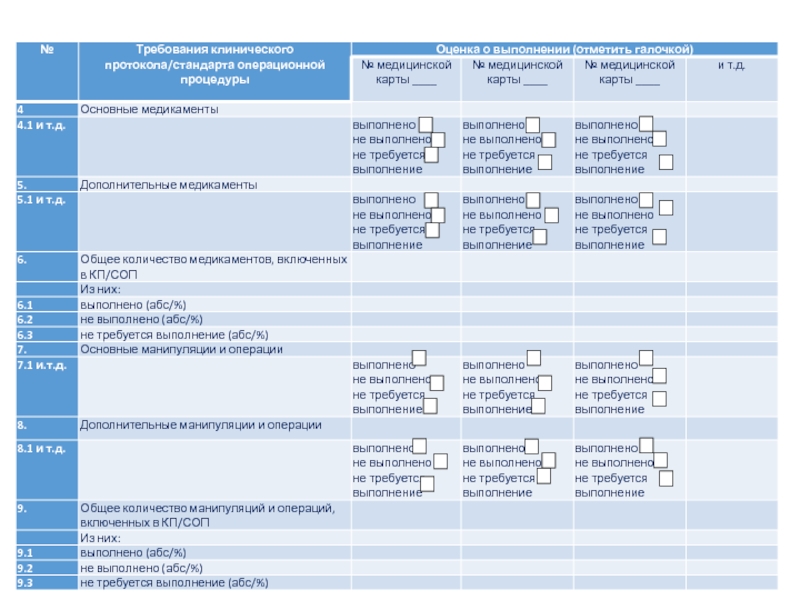
- 44. Чек-лист
- 45. Спасибо за внимание!
- 46. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Порядок включения лекарств в клинические протоколы. Внедрение клинических протоколов в клиническую
практику
ДОМП, к.м.н.Слайд 4Оценка лекарственных препаратов: специальные вопросы
Режимы дозирования: рассмотреть дозу и продолжительность
утвержденного лекарственного препарата в сравнении с тем, что использовалось в
испытанияхЭффективность в сравнении с действенностью: испытания могут имеется только по действенности, поэтому количество может быть незначительным
Модификаторы эффекта: рассмотреть факторы «реального мира», которые модифицируют эффект лечения, например, соответствие с лечением, исследованные группы пациентов
Безопасность: оценить важные побочные эффекты
Слайд 6Оценка безопасности фармакотерапии
1. По типу:
- побочные реакции - любые
непреднамеренные и вредные для организма человека реакции, которые возникают при
использовании препарата в обычных дозах с целью профилактики, лечения и диагностики;- неожиданная побочная реакция - такая реакция, сведения о природе и тяжести которой отсутствуют в инструкции по применению препарата и ее не ожидают исходя из существующих знаний о свойствах препарата, т.е. речь идет о неизвестной реакции на препарат;
- побочные явления - любые неблагоприятные с медицинской точки зрения проявления, которые возникают во время лечения препаратом, но которые не обязательно имеют причинно-следственную связь с этим лечением. Возможно, что эти неблагоприятные проявления только совпадают по времени с приемом препарата;
- побочный эффект - любое непреднамеренное действие лекарства (выходящее за рамки рассчитанного терапевтического эффекта) обусловленное его фармакологическими свойствами, наблюдаемое при использовании лекарства в рекомендуемых дозах. Основные элементы этого определения - фармакологическая природа эффекта, его непреднамеренность и не результат передозировки.
Нежелательные реакции (классификация ВОЗ)
Слайд 72. По частоте побочные реакции подразделяются на:
- очень частые –
более 1/10 (более 10%);
- частые – более 1/100, но менее
1/10 (более 1%, но менее 10%);- нечастые – более 1/1000, но менее 1/100 (более 0,1%, но менее 1%);
- редкие – более 1/10000, но менее 1/1000 (более 0,01%, но менее 0,1%);
- очень редкие – менее 1/10000 (менее 0,01%).
Слайд 8Сходства и различия
генерических и оригинальных препаратов
www.rcrz.kz
Субстанция
Доза
Лекарственная форма
Title
Add your
text
Вспомогательные вещества
Техника производства
Сходство
Различие
Слайд 12Преимущества использования
генерических названий в КП
Стандартизация
Унифицированность
Возможность определения групповой принадлежности
Отсутствие лоббирования
фармкомпаний
Удобство формирования заявки на закуп
Элемент защиты врача и пациента
Низкая стоимость
в сравнении с оригиналомwww.rcrz.kz
www.rcrz.kz
Слайд 13Недостатки использования генерических препаратов
Данные об эффективности и безопасности оригинальных препаратов
часто экстраполируется на генерические препараты
Не все генерики взаимозаменяемы
Высокая частота развития
побочных эффектов при заменеНизкая эффективность при одинаковой дозировке
www.rcrz.kz
www.rcrz.kz
Слайд 14Сравнение терапевтической эффективности липримара и его дженериков
Эффективная дозировка – от
20 мг/сут
Скорость наступления клинических эффектов – 25-40 дней постоянного приема
Клинические
эффекты:Урежение приступов загрудинных болей, повышение порога переносимых физических нагрузок
Снижение среднесуточного АД
Уменьшение и полное исчезновение аритмий
На фоне применения аториса, атомакса и торвакарда подобных клинических эффектов не зарегистрировано
www.rcrz.kz
Слайд 15Проблемы использования
генерических препаратов
При некоторых нозологиях замена оригинального препарата на
генерик приводит к осложнениям и побочным реакциям (Эпилепсия, сахарный диабет,
онкогематология, почечная недостаточность)Необходимость увеличения дозировки препаратов
Необходимость замены лекарственного препарата
www.rcrz.kz
www.rcrz.kz
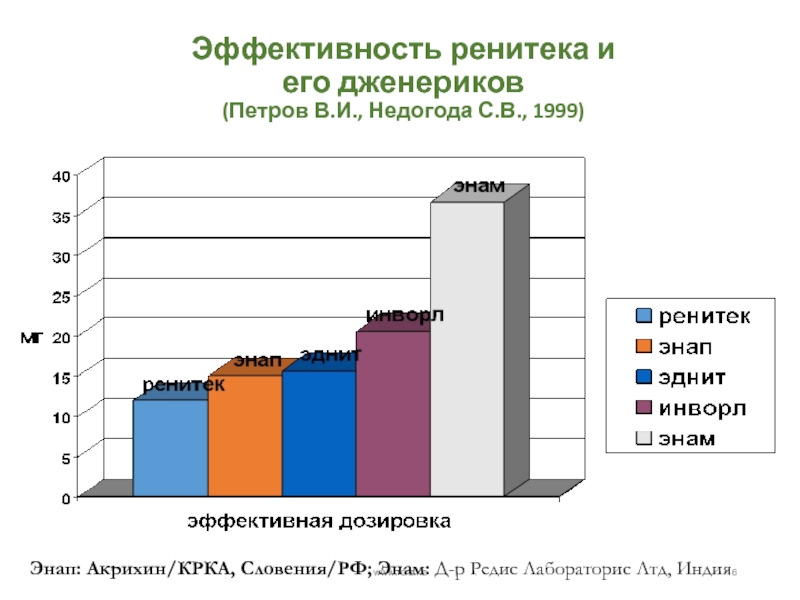
Слайд 16Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999)
www.rcrz.kz
Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р Редис Лабораторис Лтд, Индия
www.rcrz.kz
Слайд 17Взаимозаменяемость
Терапевтическая эквивалентность – основное требование взаимозаменяемости
Фармацевтическая эквивалентность не
гарантирует эквивалентности фармакокинетической
www.rcrz.kz
www.rcrz.kz
Слайд 18Биоэквивалентность
«Два лекарственных препарата считают биоэквивалентными, если
они фармацевтически эквивалентны, имеют одинаковую биодоступность и при назначении в
одинаковой дозе обеспечивают должную эффективность и безопасность».ВОЗ
www.rcrz.kz
www.rcrz.kz
Слайд 20В 1984 году Управление по контролю за пищевыми продуктами и
лекарственными препаратами США (FDA) впервые опубликовало перечень одобренных к применению
препаратов с доказанной терапевтической эквивалентностью (Approved Drug Products with Therapeutic Equivalence and Evaluations) - «Оранжевую книгу» (Orange-book).FDA признает терапевтически эквивалентными препараты только в том случае, если они удовлетворяют следующим критериям:
Разрешены к применению как эффективные и безопасные.
Являются фармацевтическими эквивалентами, то есть идентичны по качественному и количественному составу, а также идентичны по силе действия, дозировке и способах введения.
Являются биоэквивалентными
Имеют надлежащую маркировку.
Производятся в соответствии с требованиями GMP
www.rcrz.kz
Слайд 21Терапевтическая эквивалентность
В опубликованном в 1998 году FDA проекте правил оценки
терапевтической эквивалентности дженериков предлагается указывать на этикетке препарата наличие или
отсутствие терапевтической эквивалентности, а также препарат, с которым производилось сравнение (как правило, это оригинальный препарат).Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
www.rcrz.kz
www.rcrz.kz
Слайд 22Кодировка ЛС (FDA)
Код «А- препарат с подтвержденной терапевтической эквивалентностью (сведения
о проблемах биоэквивалентности препарата отсутствуют)
Код «АВ» - то же, что
и код «А», но сведения о проблемах биоэквивалентности имели место (но были опровергнуты дополнительными исследованиями)Код «В» - терапевтическая эквивалентность препарата не подтверждена
Любой врач и пациент в США могут узнать код нужного ему рецептурного лекарственного препарата в ежегодно переиздаваемой «Оранжевой книге», доступной в сети Интернет.
www.rcrz.kz
www.rcrz.kz
Слайд 23Мнение экспертов
В руководстве ВОЗ по регистрационным требованиям, предъявляемым для определения
взаимозаменяемости генерических лекарственных препаратов, также указывается, что «невозможность гарантировать взаимозаменяемость
может нанести вред здоровью и безопасности пациентов»(WHO Technical Report Series, No. 863, 1996).
Американская ассоциация врачей не рекомендует в качестве замены отпускать лекарственный препарат, которому FDA присвоило код «В»
(Drug evaluations annual, American Medical Association, 1999, p. 7).
www.rcrz.kz
www.rcrz.kz
Слайд 24Выводы
Включение в клинические протоколы ЛС по МНН является обоснованным
и целесообразным с точки зрения организатора здравоохранения, врача и пациента
Недопустимо
переносить данные по эффективности и безопасности инновационного препарата на генерики без учета терапевтической эквивалентностиДанные по фармакокинетической и терапевтической эквивалентности могут служить основой для терапевтической взаимозаменяемости и фармакоэкономической обоснованности этой замены
Недостаточные знания и навыки применения МНН ЛС среди врачей, фармацевтов и населения
www.rcrz.kz
Слайд 25Рекомендации
Включать в клинические протоколы ЛС только по МНН
Указывать в клинических
протоколах отдельных нозологий о необходимости учета терапевтической эквивалентности и взаимозаменяемости
Создать
базу данных генериков с указанием терапевтической эквивалентности и взаимозаменяемостиИнформировать врачей, фармацевтов и пациентов о необходимости использования ЛС по МНН
www.rcrz.kz
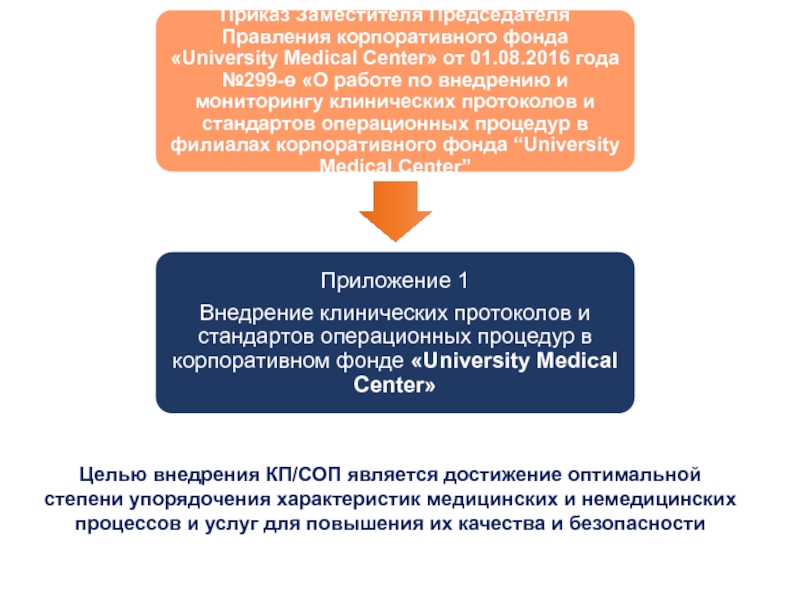
Слайд 32Целью внедрения КП/СОП является достижение оптимальной степени упорядочения характеристик медицинских
и немедицинских процессов и услуг для повышения их качества и
безопасностиСлайд 33Определение
КП – это документ, устанавливающий общие требования к оказанию медицинской
помощи пациенту при определенном заболевании или клинической ситуации.
СОП – это
подробная инструкция, определяющая алгоритм стандартных действий/мероприятий, обеспечивающих достижение поставленных целей, составленная по форме, установленной КФ «UMC».Внедрение КП/СОП – это осуществление мероприятий, обеспечивающих соблюдение требований, установленных КП/СОП, в соответствии с областью его применения.
Слайд 36Информирование пользователей
доведение информации до пользователей КП/СОП через непосредственных руководителей структурных
подразделений;
информирование сотрудников на производственных собраниях;
рассылка электронных сообщений.
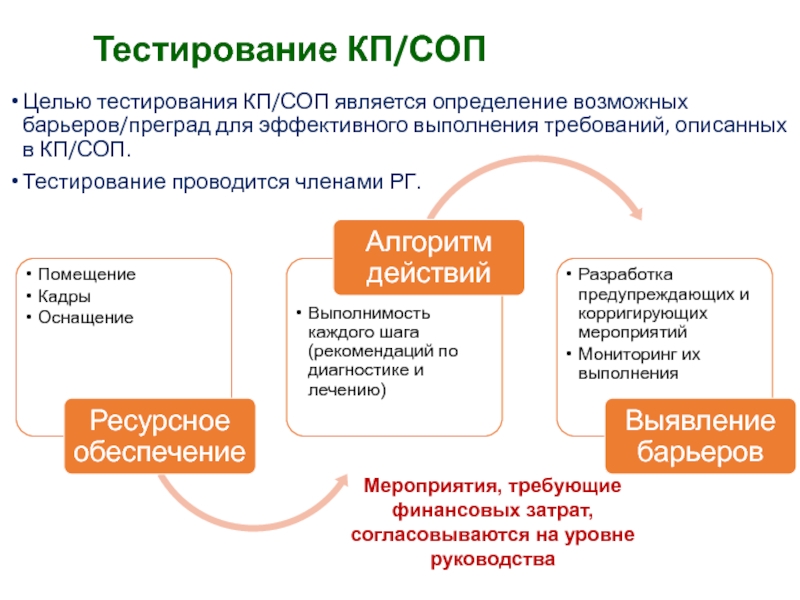
Слайд 38Тестирование КП/СОП
Целью тестирования КП/СОП является определение возможных барьеров/преград для эффективного
выполнения требований, описанных в КП/СОП.
Тестирование проводится членами РГ.
Мероприятия, требующие финансовых
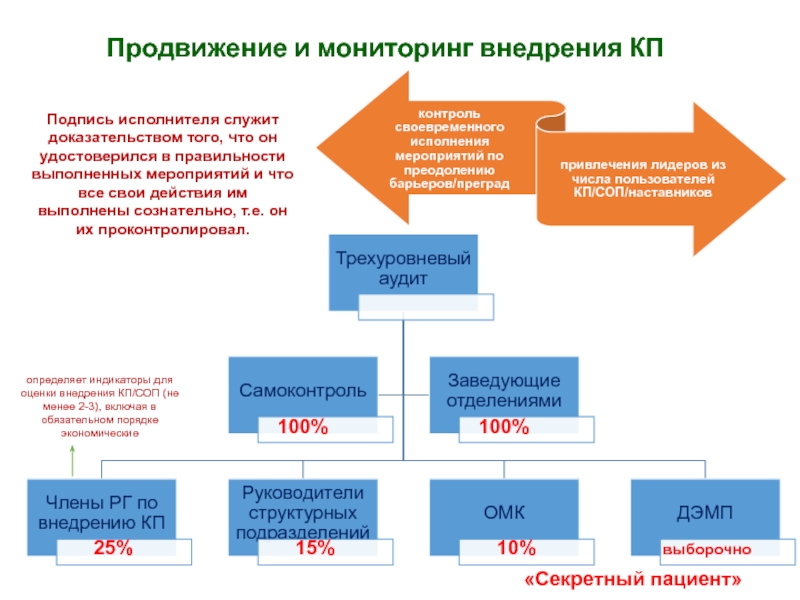
затрат, согласовываются на уровне руководстваСлайд 39Продвижение и мониторинг внедрения КП
Подпись исполнителя служит доказательством того, что
он удостоверился в правильности выполненных мероприятий и что все свои
действия им выполнены сознательно, т.е. он их проконтролировал.выборочно
100%
100%
25%
15%
10%
«Секретный пациент»
определяет индикаторы для оценки внедрения КП/СОП (не менее 2-3), включая в обязательном порядке экономические