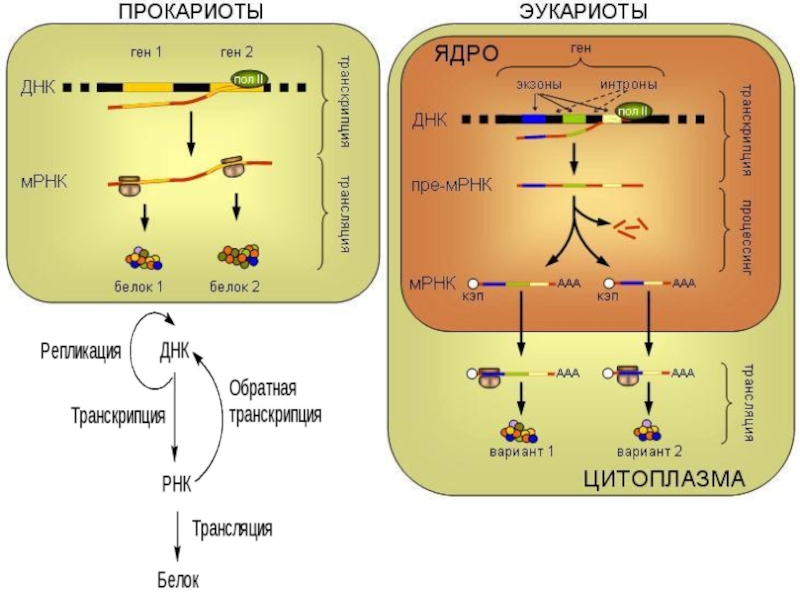
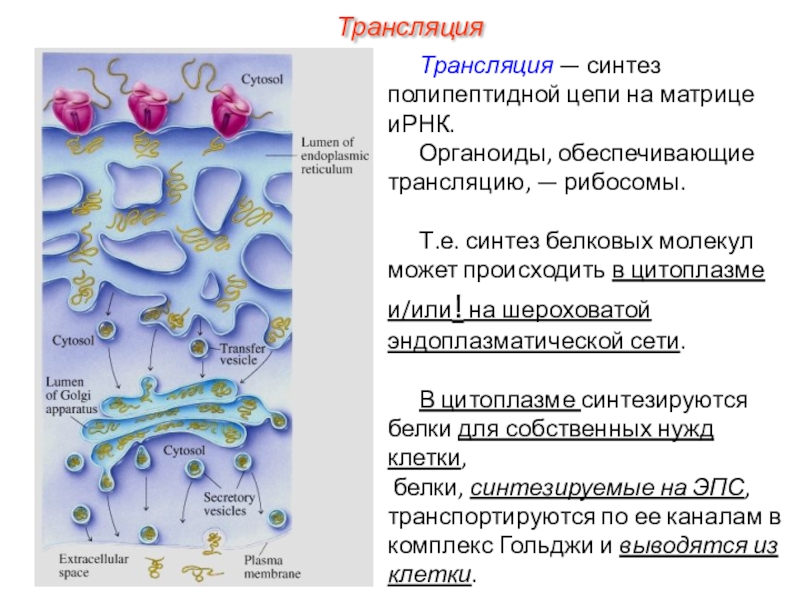
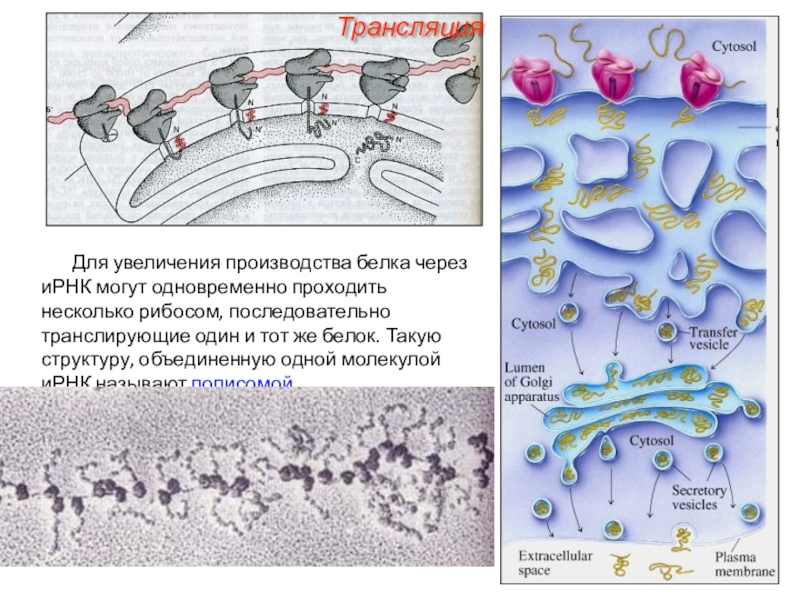
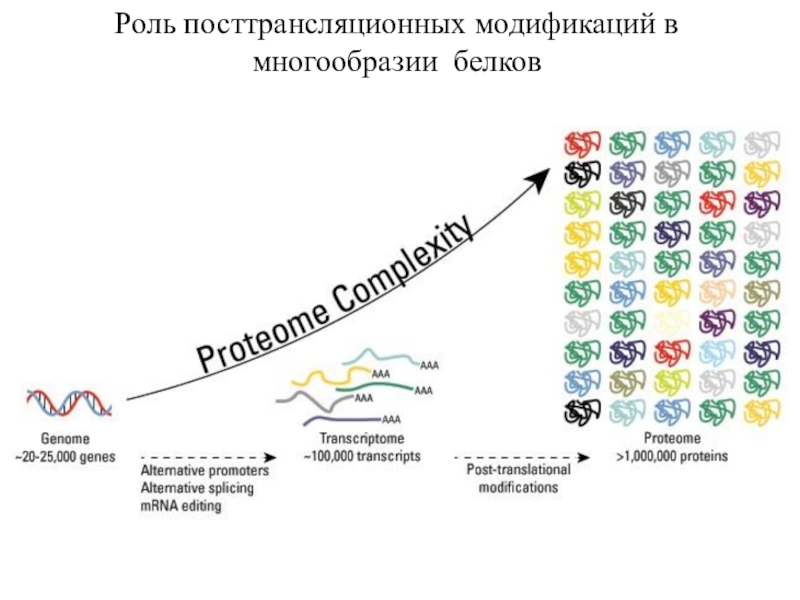
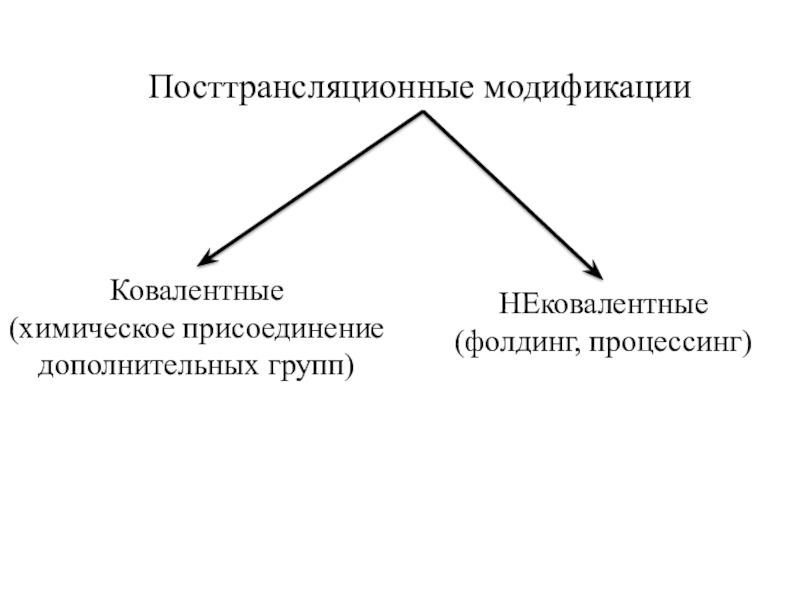
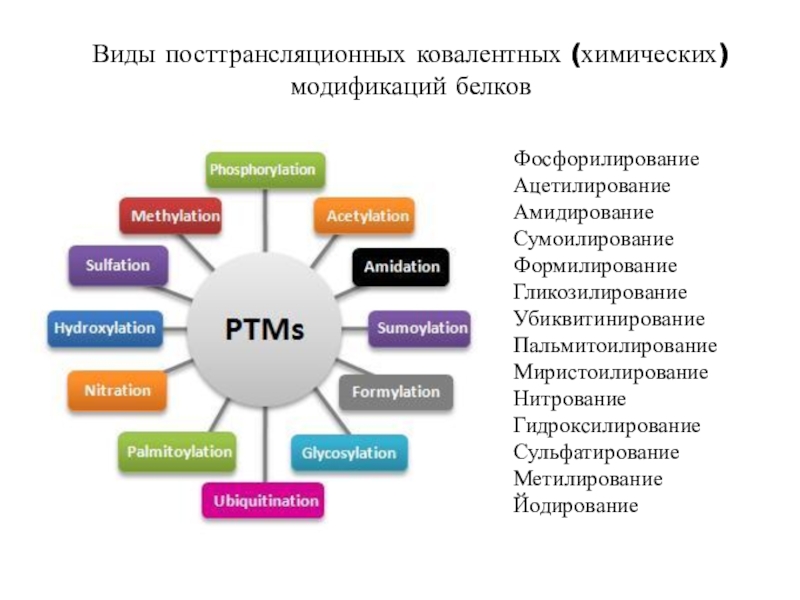
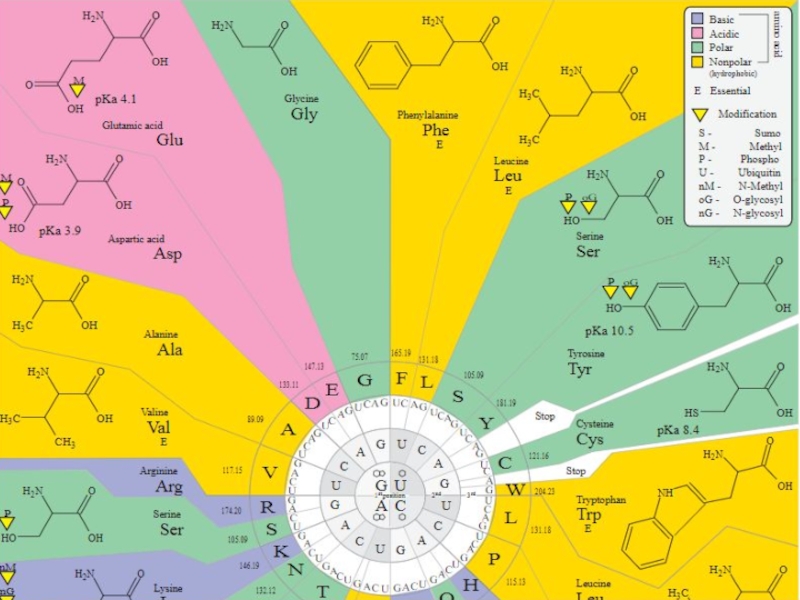
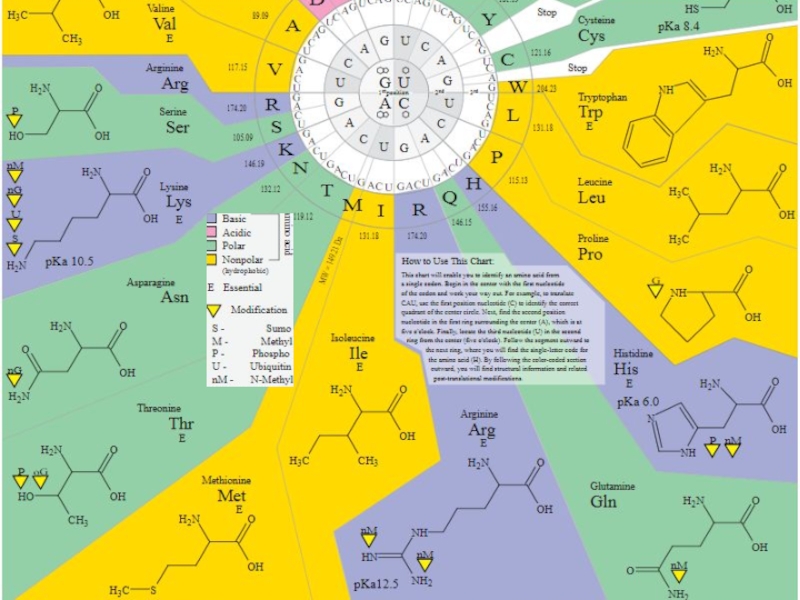
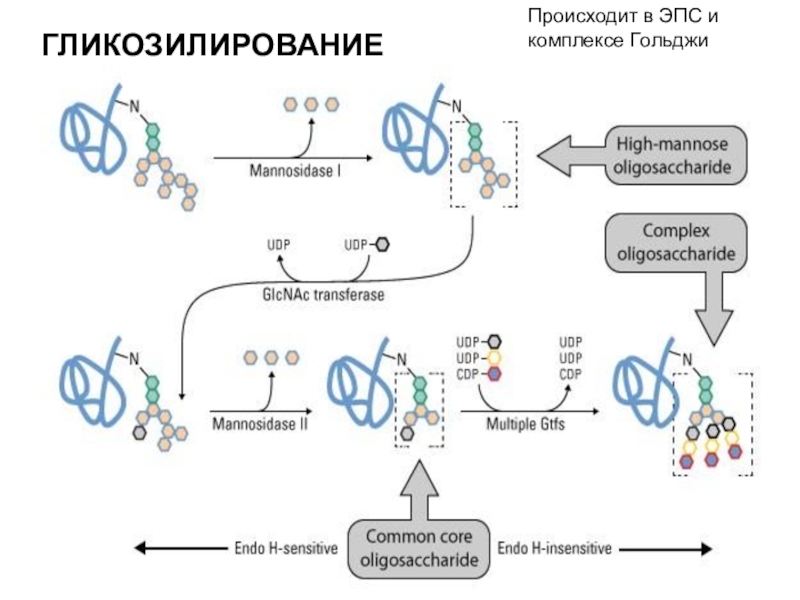
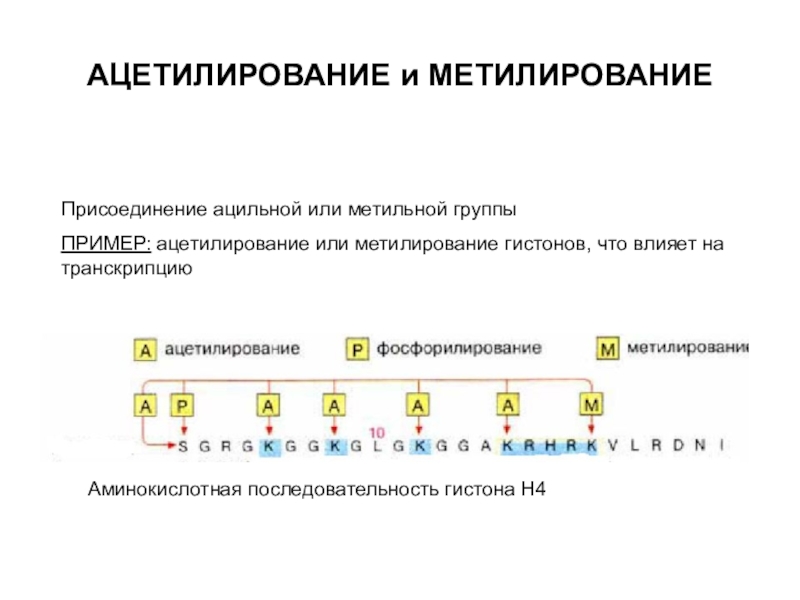
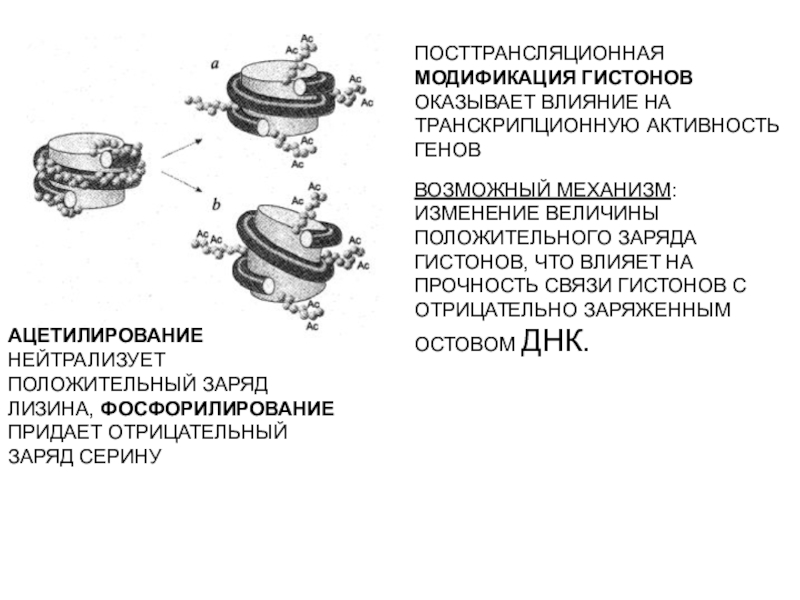
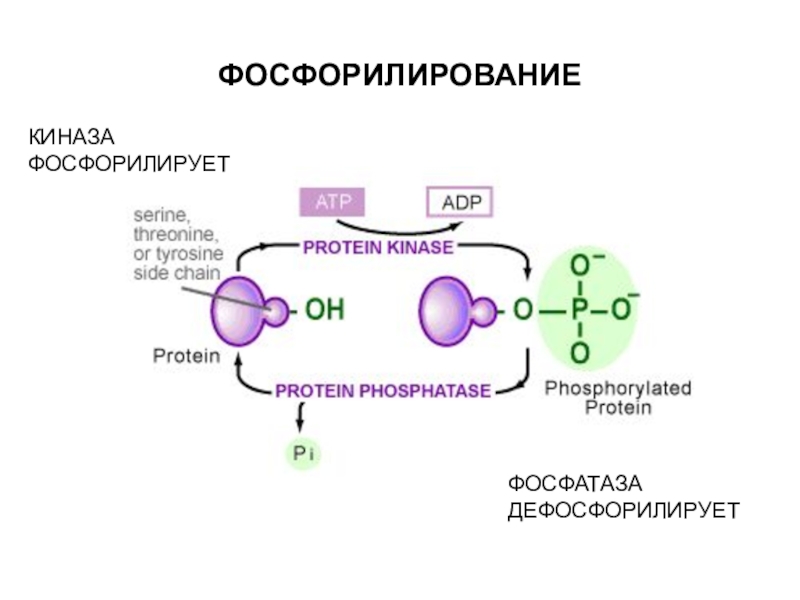
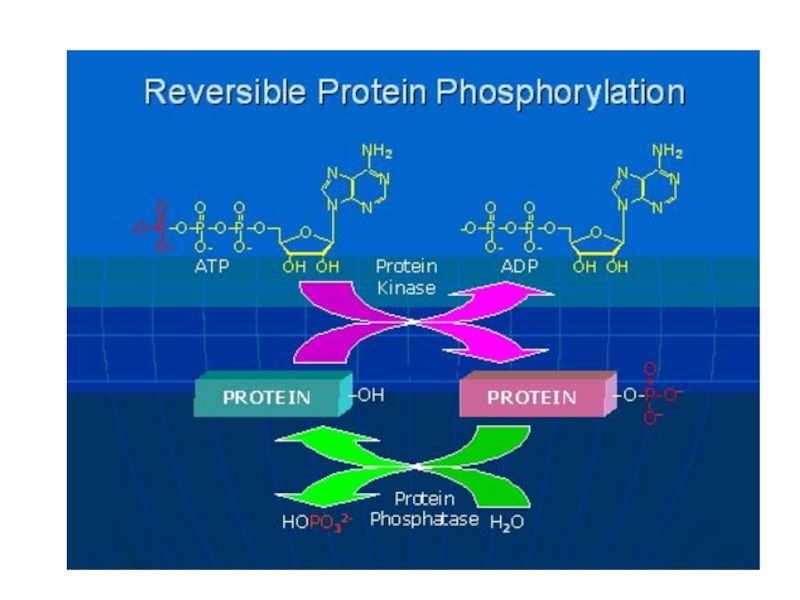
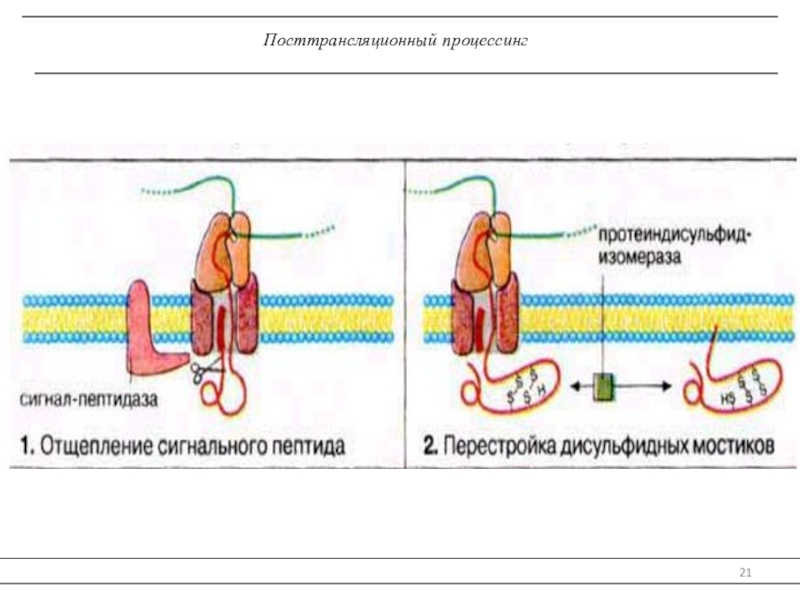
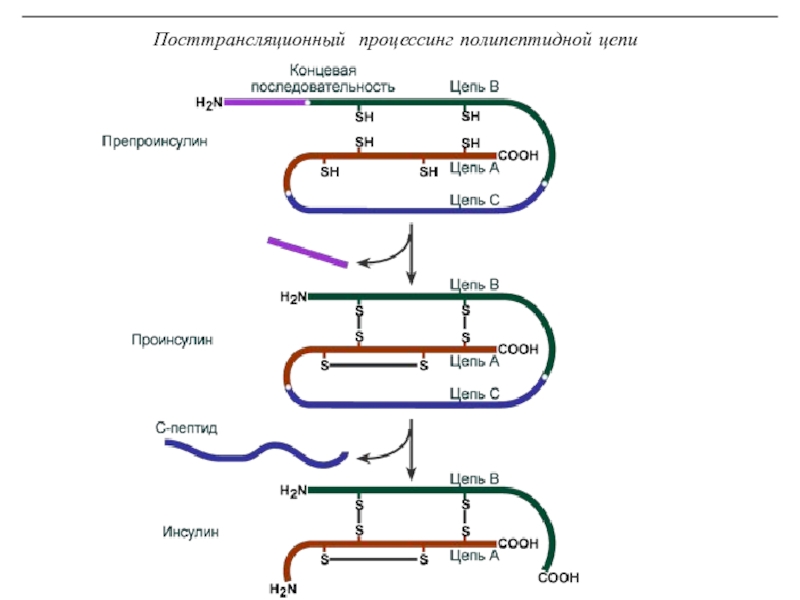
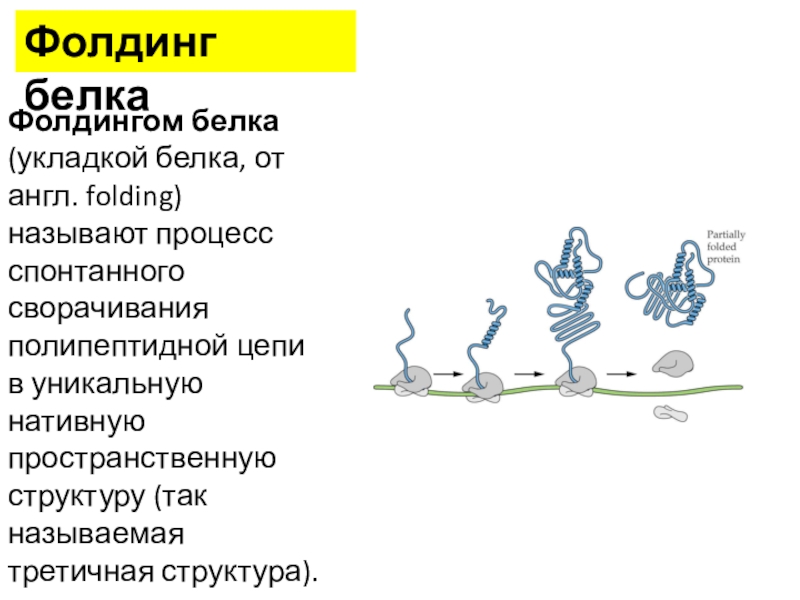
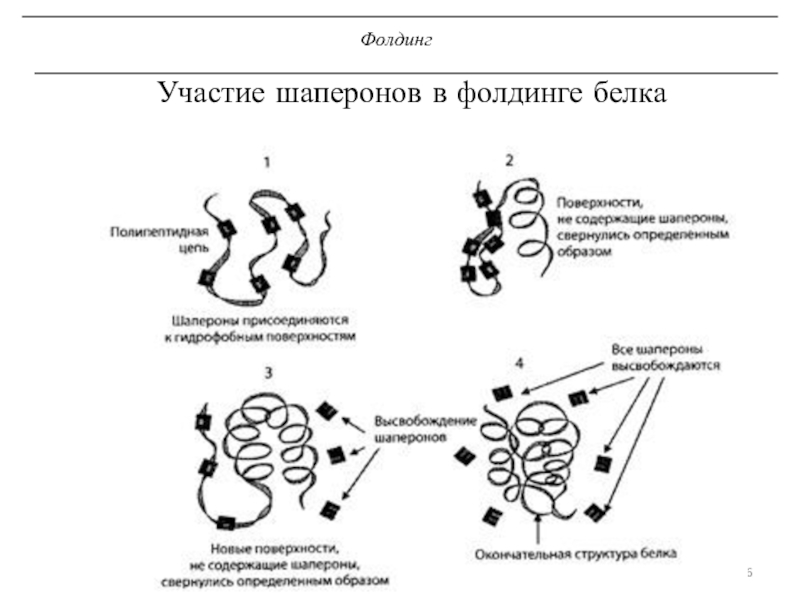
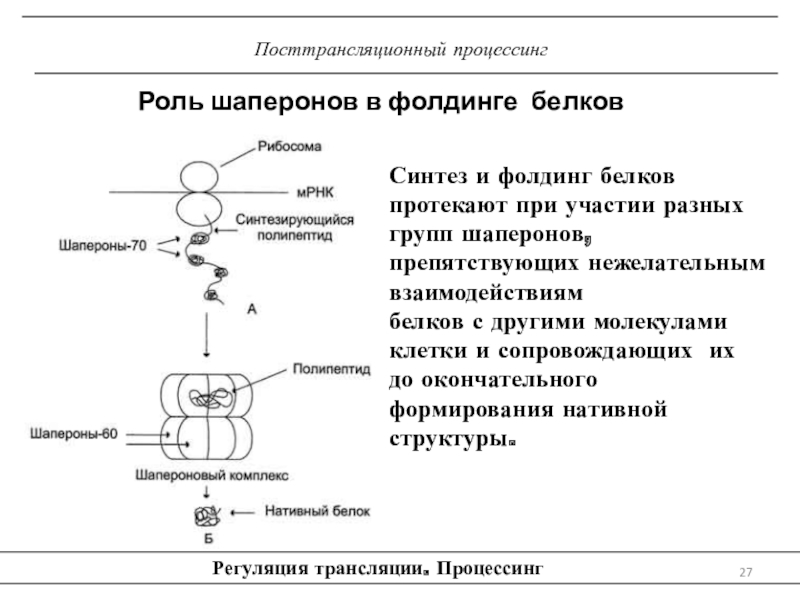
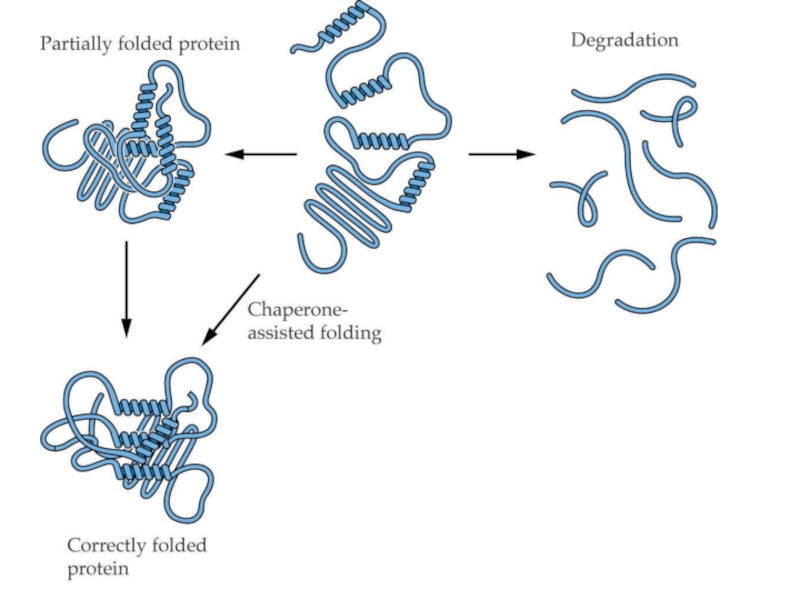
трансляцию, — рибосомы.
Т.е. синтез белковых молекул может происходить в
цитоплазме и/или! на шероховатой эндоплазматической сети.
В цитоплазме синтезируются белки для собственных нужд клетки,
белки, синтезируемые на ЭПС, транспортируются по ее каналам в комплекс Гольджи и выводятся из клетки.