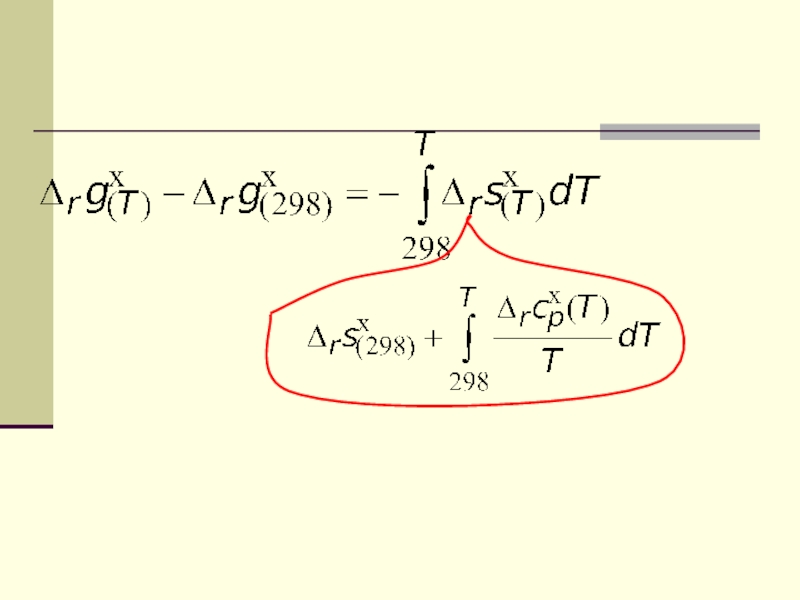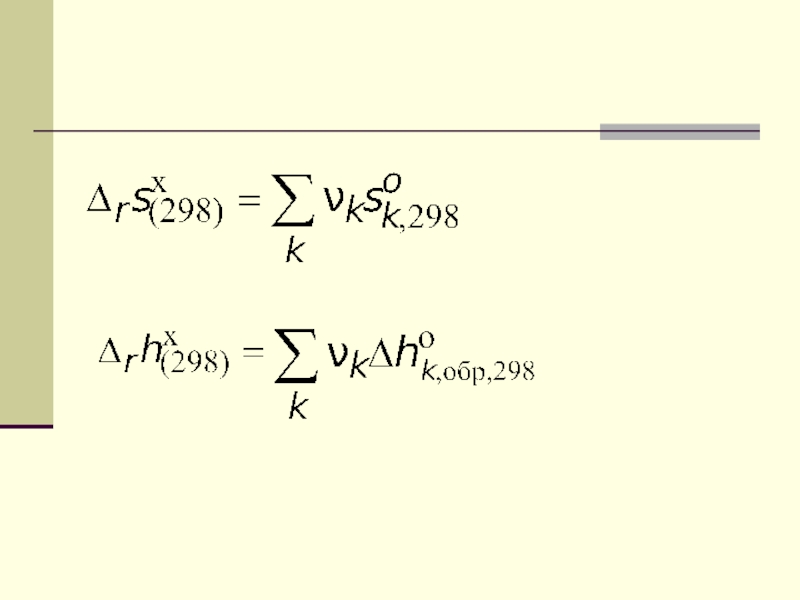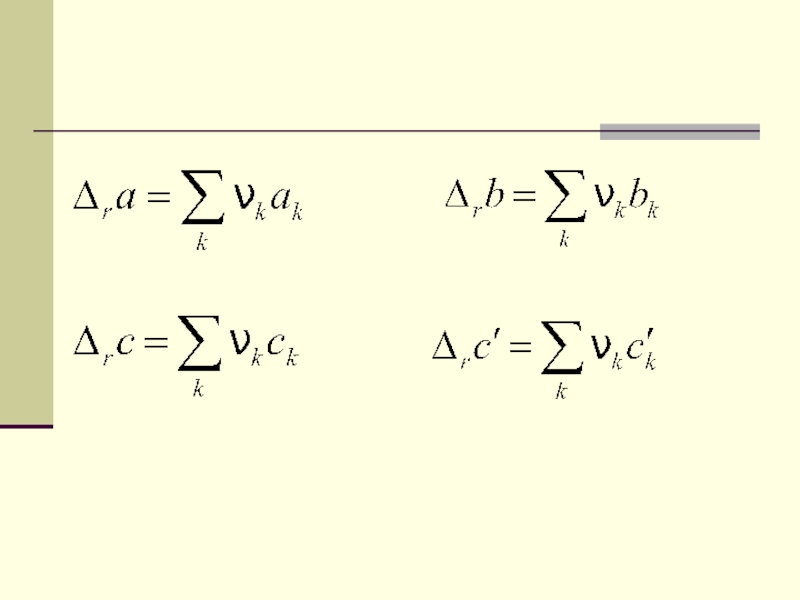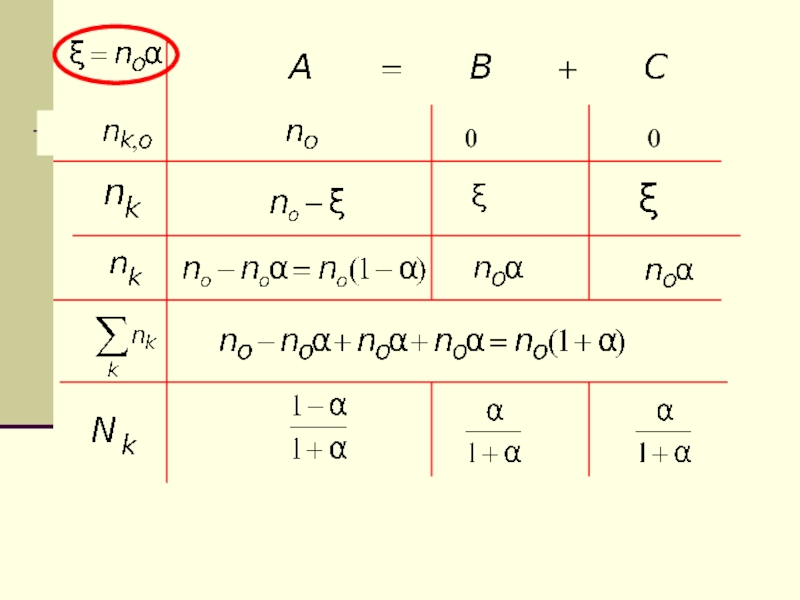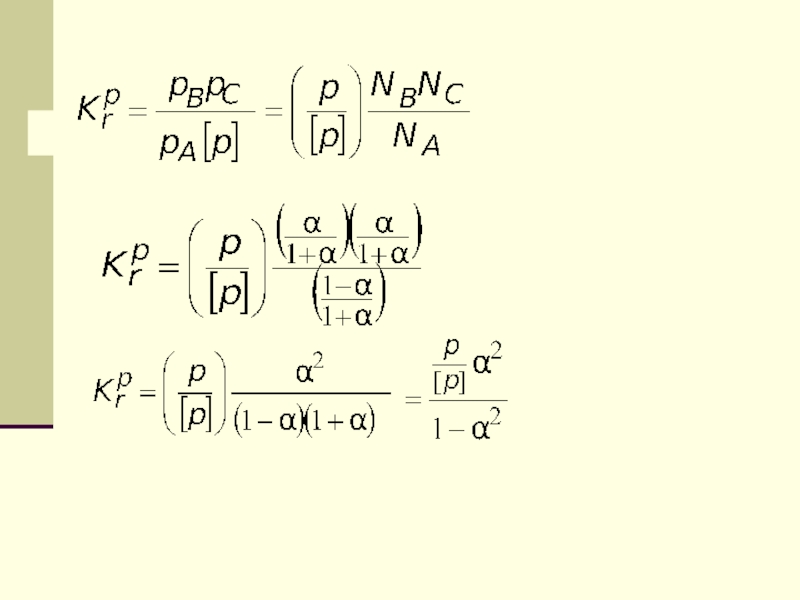Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Пояснения к выполнению РР-2
Содержание
- 1. Пояснения к выполнению РР-2
- 2. Решение РР-2 основано на использовании материала по
- 3. Химическое сродство реакции- это параметр термодинамической системы,
- 4. В 1777 году Карл Венцель предположил, что
- 5. Всякий самопроизвольно протекающий процесс сопровождается ростом энтропииуменьшением
- 6. При достижении максимума энтропииа также минимума энергий
- 7. Функции : внутренняя энергия, энтальпия, энергия Гельмгольца
- 8. Новые представления о химическом сродстве, развивающие основные
- 9. Если в системе нет иного неравновесного процесса,
- 10. Этим фундаментальным соотношением вводится функция состояния, называемая
- 11. Вспомним уравнения, объединяющие I и II законы термодинамики
- 12. С учетом соотношения Де Донде
- 13. Сопоставляя эти выражения с выражениями полных дифференциалов
- 14. Изменение любого экстенсивного свойства E за счет
- 15. Учитывая, что парциальная мольная энергия Гиббса компонента
- 16. Химическая реакция идет, если сродство реакции положительно.Когда
- 17. Чтобы провести расчеты правильно, не путаясь в различных типах символьных величин, вспомним некоторые из них
- 18. Химический потенциал
- 19. Химический потенциал компонента k в идеальном растворе
- 20. Идеальный газовый раствор Идеальный совершенный раствор Идеальный предельно разбавленный раствор
- 21. Химический потенциал компонента k
- 22. Слайд 22
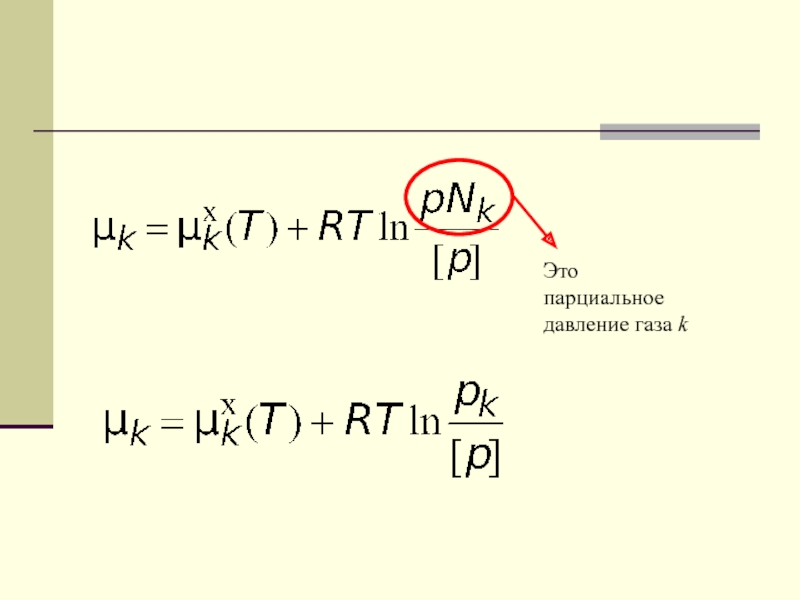
- 23. Это парциальное давление газа k
- 24. Мы рассматриваем химическую реакцию между идеальными газами, значитВернемся к общей формуле
- 25. Мольная энергия Гиббса реакции rСтандартная
- 26. Полученное уравнение называется уравнением изотермы Вант-Гоффа и может быть записано для газовой реакции следующим образом
- 27. Именно по значению химического сродства, вычисленного по
- 28. Если данные о парциальных давлениях газов в
- 29. Алгоритм выполнения РР-2
- 30. В идеальной газовой системе возможно протекание нескольких
- 31. Нужно определить наиболее термодинамически вероятную реакцию.В каждом варианте будет свой набор реакций
- 32. Наиболее вероятную из четырех предложенных реакций будем
- 33. Общая формула для расчета изменений экстенсивных свойств
- 34. это стандартное мольное изменение экстенсивного свойства E
- 35. Но для расчета стандартной мольной энергии Гиббса
- 36. Если нужно вычислить стандартную мольную энергию Гиббса
- 37. Но можно вычислить стандартную мольную энергию Гиббса при любой температуре и другим способом:
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Этот метод расчета стандартной мольной энергии Гиббса реакции называется методом Темкина-Шварцмана
- 42. Слайд 42
- 43. Слайд 43
- 44. Стандартную мольную энергию Гиббса реакции можно обозначить
- 45. Как удобнее работать с программой
- 46. Открыть в Excel программуРеакцию можно набрать в Excel, а можно потом в Word или от руки
- 47. Открыть в Word файл
- 48. Вернуться в программу Excel и вставить скопированные данные в нужные ячейки-10,50,5Ввести значения стехиометрических чисел реактантов
- 49. Результаты расчета стандартных мольных энтальпий и энтропий
- 50. Значения стандартной мольной энергии Гиббса и константы
- 51. Делаем все то же самое с остальными
- 52. Строим графическую зависимость стандартных мольных энергий Гиббса
- 53. Делаем выводы о наиболее вероятной реакции из
- 54. ЗАДАЧА 2Полагая, что все остальные реакции подавлены
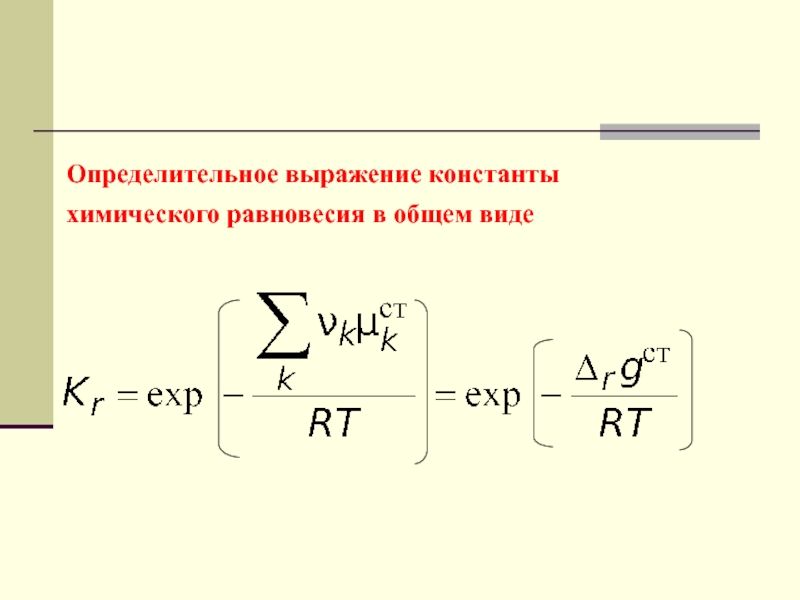
- 55. Определительное выражение константы химического равновесия в общем виде
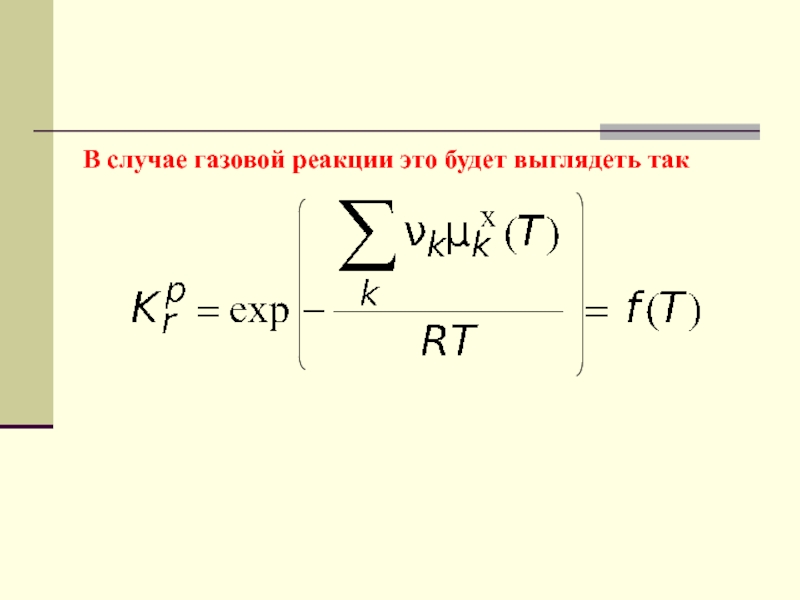
- 56. В случае газовой реакции это будет выглядеть так
- 57. Закон химического равновесия записывается следующим образомВ шкале
- 58. или концентрации компонентов реакционной смеси с плотностью
- 59. У нас будет выбрана одна реакция, поэтому балансовые соотношения будем определять по формуле :
- 60. Использование переменной -
- 61. 00
- 62. Слайд 62
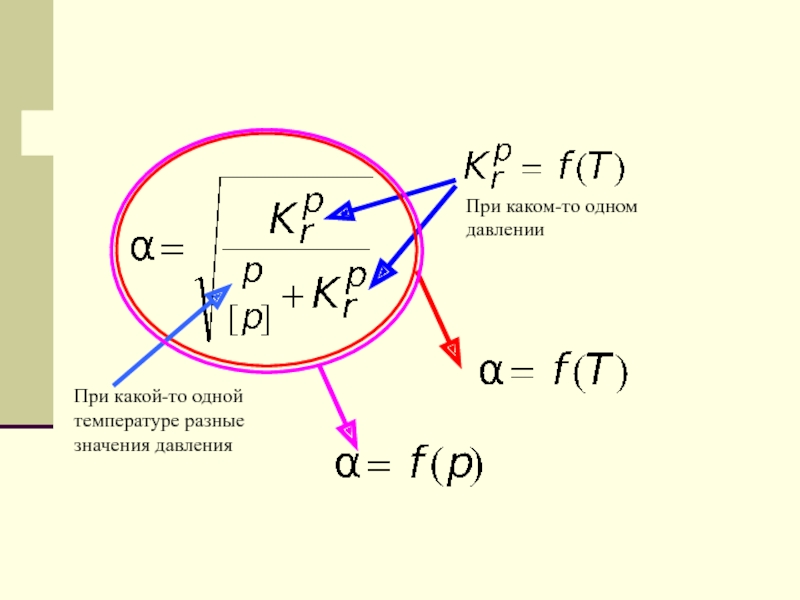
- 63. При какой-то одной температуре разные значения давленияПри каком-то одном давлении
- 64. Строим два рисунка:На одном зависимость степени термической
- 65. Слайд 65
- 66. Слайд 66
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
- 70. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Решение РР-2 основано на использовании материала по расчету изменений экстенсивных
свойств при протекании химической реакции и по расчету химического равновесия
описании химического равновесия большое значение имеет понятие химического сродства реакцииСлайд 3Химическое сродство реакции- это параметр термодинамической системы, характеризующий отклонение системы
от состояния химического равновесия
Химическое сродство – это совокупность химических и
физических условий, которая в данной системе создает возможность протекания химического превращения.
Слайд 4В 1777 году Карл Венцель предположил, что скорость реакции пропорциональна
химическому сродству.
В середине XIX века Марселен Бертло и ХансТомсен связали
сродство с теплотой реакции: сродство больше там, где больше выделяется теплоты реакции. Начало современной теории сродства положили
Джазайя Гиббс, Герман Гельмгольц и Якоб Вант-Гофф
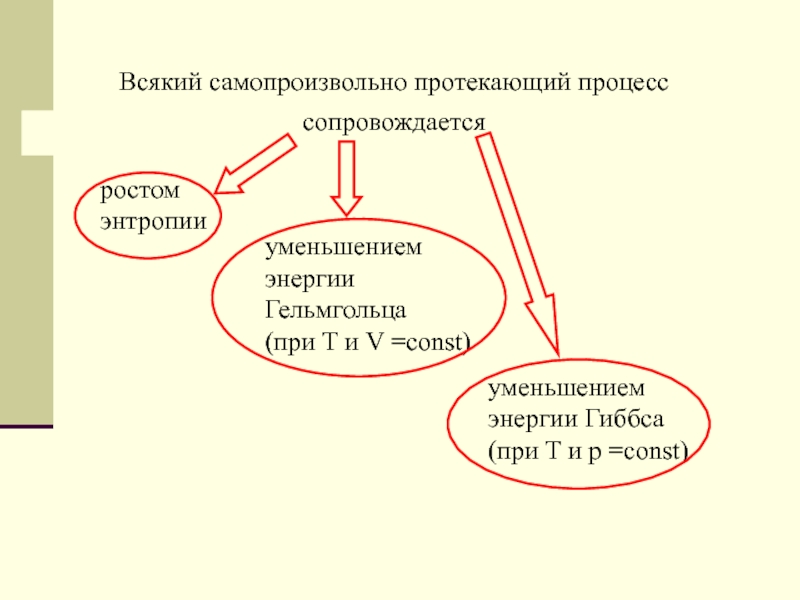
Слайд 5Всякий самопроизвольно протекающий процесс сопровождается
ростом энтропии
уменьшением энергии Гельмгольца
(при T и V =const)
уменьшением энергии Гиббса (при T
и р =const)Слайд 6При достижении максимума энтропии
а также минимума энергий Гельмгольца или Гиббса
прекращается
течение самопроизвольного процесса,
т.е. исчерпывается химическое сродство.
Отсюда принцип, сформулированный
Вант-Гоффом: за меру химического сродства следует принять разность энергий Гельмгольца (или Гиббса) системы до и после реакции, рассчитанную на определенную массу реагирующих веществ.
Слайд 7Функции : внутренняя энергия, энтальпия, энергия Гельмгольца и энергия Гиббса
относятся ко всей системе
Функция химический потенциал относится к отдельным
компонентамДля описания химического превращения нужна функция состояния, относящаяся непосредственно к химическому превращению.
Слайд 8Новые представления о химическом сродстве, развивающие основные принципы методов Гиббса
и Вант-Гоффа, были выдвинуты в 20-х годах XX века
Теофилом
Де Донде и развиты Ильей Пригожиным Пусть имеется система, например, смесь идеальных газов, в которой возможно одно химическое превращение, характеризуемое в любой момент времени глубиной реакции .
Химическое превращение - неравновесный процесс.
Слайд 9Если в системе нет иного неравновесного процесса, то некомпенсированная теплота
обусловлена только протеканием реакции, т. е. она будет пропорциональна глубине
реакцииБесконечно малое количество некомпенсированной теплоты
Приращение глубины химической реакции
Химическое сродство
Соотношение Де Донде
Слайд 10Этим фундаментальным соотношением вводится функция состояния, называемая химическим сродством реакции.
Величина сродства является мерой необратимости химической – реакции, то есть
мерой прироста энтропии на один пробег реакции. Сродство реакции − это функция состояния, связанная непосредственно с переменной, характеризующей химическое превращение – глубиной реакции.
Слайд 13Сопоставляя эти выражения с выражениями полных дифференциалов функций, получим
Чаще всего
сродство реакции выражают через энергию Гиббса
Слайд 14Изменение любого экстенсивного свойства E за счет протекания реакции можно
вычислить по формуле
Для энергии Гиббса эта формула будет такой
Слайд 15Учитывая, что парциальная мольная энергия Гиббса компонента k, реакционной смеси,
совпадает с химическим потенциалом компонента k, получим:
Слайд 16Химическая реакция идет, если сродство реакции положительно.
Когда химическое сродство исчерпывается,
реакция прекращается, наступает химическое равновесие
При отрицательном химическом сродстве реакции она
протекать не можетИтак,
Слайд 17Чтобы провести расчеты правильно,
не путаясь в различных типах символьных
величин,
вспомним некоторые из них
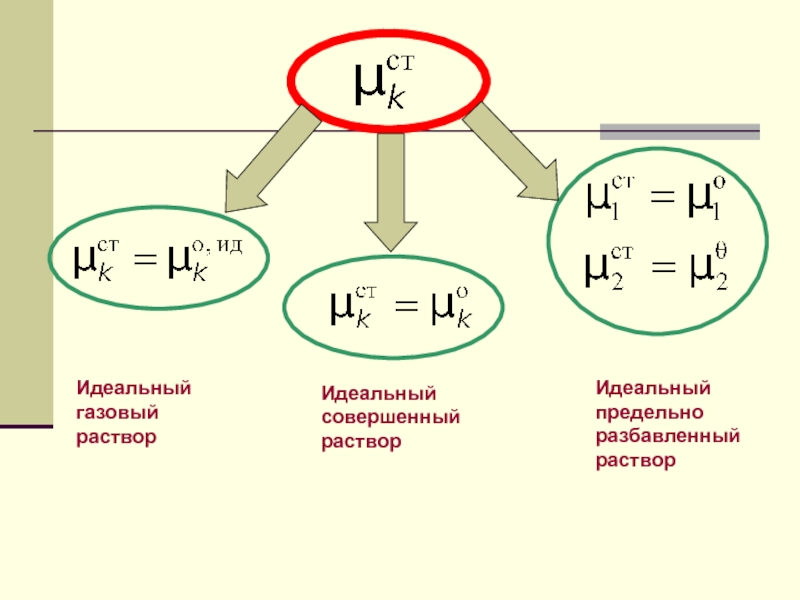
Слайд 20Идеальный газовый раствор
Идеальный совершенный раствор
Идеальный предельно разбавленный раствор
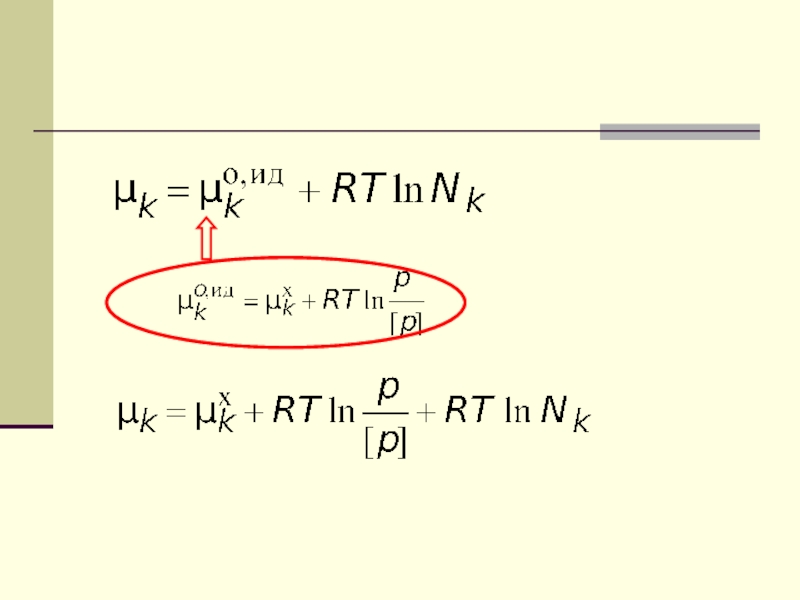
Слайд 21Химический потенциал компонента k в идеальном
газовом растворе
В задачах РР-2 речь идет о газовой
системе, значит нас интересует Слайд 25
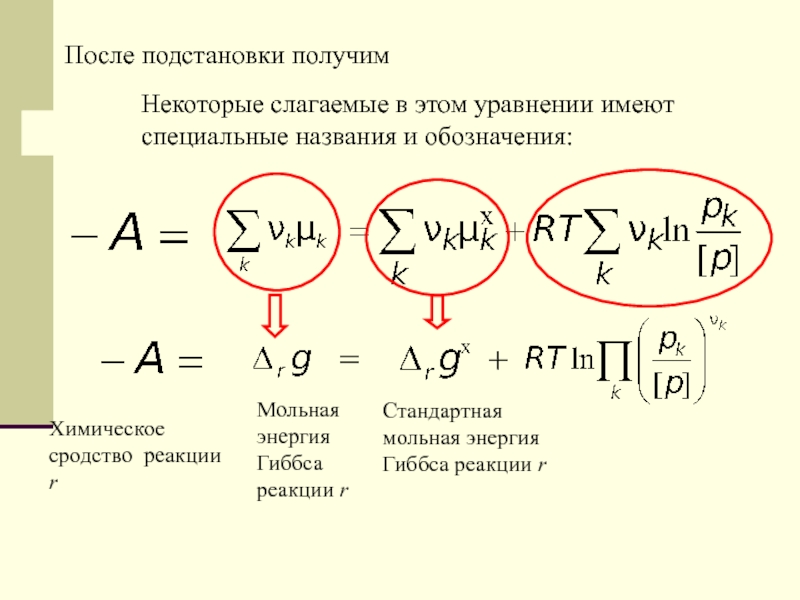
Мольная энергия Гиббса реакции r
Стандартная мольная энергия
Гиббса реакции r
=
+
Химическое сродство реакции r
После подстановки получим
Некоторые слагаемые в
этом уравнении имеют специальные названия и обозначения:Слайд 26
Полученное уравнение называется уравнением изотермы Вант-Гоффа и может быть
записано для газовой реакции следующим образом
Слайд 27Именно по значению химического сродства, вычисленного по уравнению изотермы реакции,
можно судить о возможности самопроизвольного протекания реакции
Слайд 28Если данные о парциальных давлениях газов в смеси неизвестны,
то
возможность самопроизвольного протекания реакции в этих условиях оценивают приближенно
Слайд 30В идеальной газовой системе возможно протекание нескольких реакций, характеризующих
процесс пиролиза пропана.
ЗАДАЧА 1
Температуры, при которых протекает пиролиз пропана,
имеют следующие значения:400 К
500 К
600 К
700 К
800 К
Давление 1 атм
Слайд 31Нужно определить наиболее термодинамически вероятную реакцию.
В каждом варианте будет свой
набор реакций
Слайд 32Наиболее вероятную из четырех предложенных реакций будем определять по
Для этого
рассчитаем значения стандартной мольной энергии Гиббса реакции
при всех требуемых
температурах и давлении 1 атмТа реакция, у которой будут наиболее отрицательными значения стандартной мольной энергии Гиббса
и будет наиболее вероятна в данном диапазоне температур
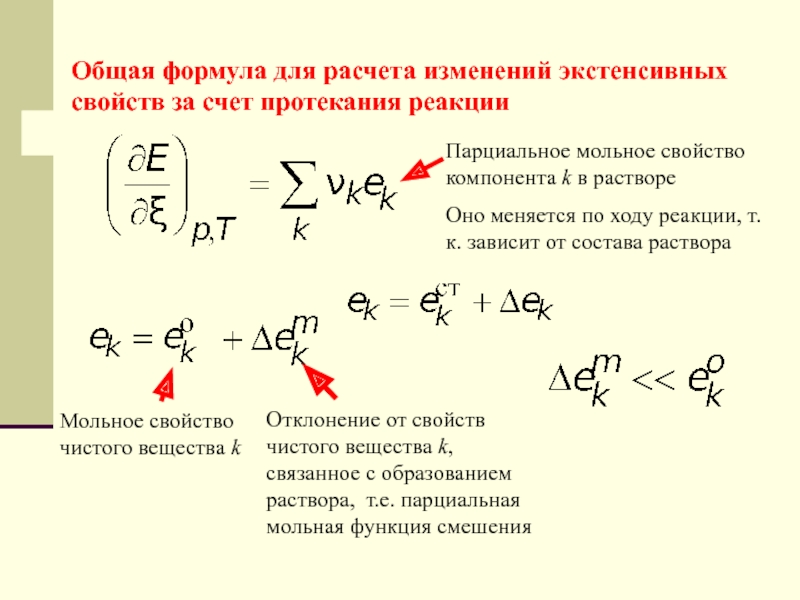
Слайд 33Общая формула для расчета изменений экстенсивных свойств за счет протекания
реакции
Парциальное мольное свойство компонента k
в растворе Оно меняется по ходу реакции, т.к. зависит от состава раствора
Мольное свойство чистого вещества k
Отклонение от свойств чистого вещества k, связанное с образованием раствора, т.е. парциальная мольная функция смешения
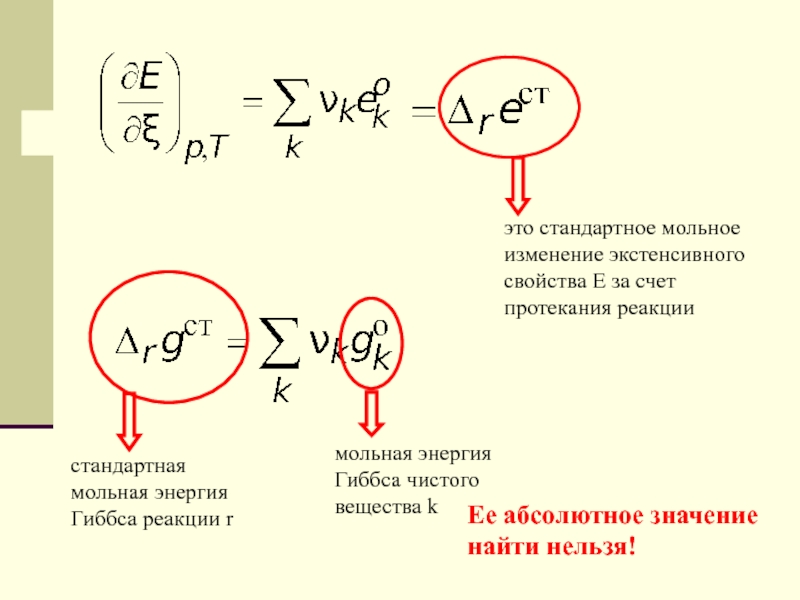
Слайд 34это стандартное мольное изменение экстенсивного свойства E за счет протекания
реакции
стандартная мольная энергия Гиббса реакции r
мольная энергия Гиббса чистого вещества
kЕе абсолютное значение найти нельзя!
Слайд 35Но для расчета стандартной мольной энергии Гиббса реакции можно использовать
формулу, вытекающую из линейной комбинации реакций образования участников реакции из
простых веществСтандартная мольная энергия Гиббса образования вещества k
Проще всего рассчитать это при 298 К
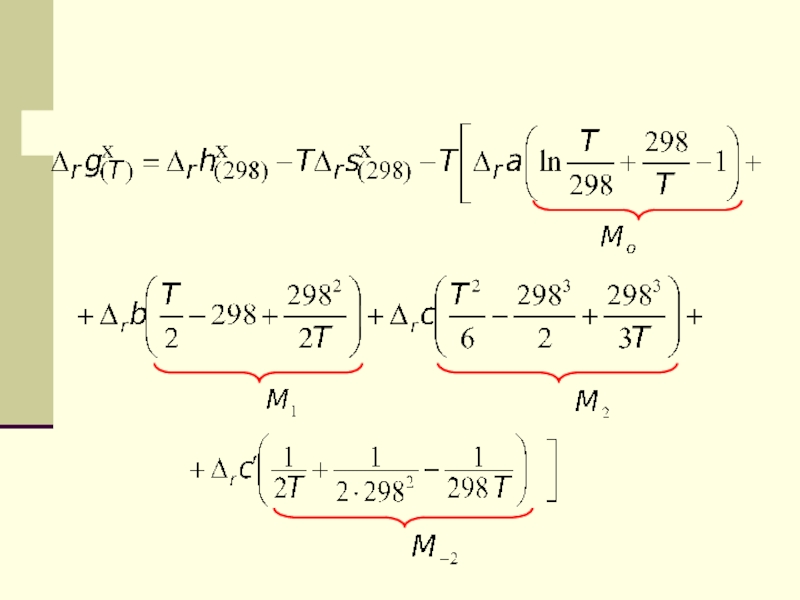
Слайд 36Если нужно вычислить стандартную мольную энергию Гиббса при какой-то температуре
Т
и стандартные мольные энтальпия и энтропия реакции известны,
то
используем определительное выражение для энергии Гиббса Слайд 37Но можно вычислить стандартную мольную энергию Гиббса при любой температуре
и другим способом:
Слайд 41Этот метод расчета стандартной мольной энергии Гиббса реакции называется методом
Темкина-Шварцмана
Слайд 44Стандартную мольную энергию Гиббса реакции можно обозначить по-разному
В самом
общем виде, без указания на то, что именно принимается за
стандартное состояние участников реакцииЕсли за стандартное состояние каждого участника реакции берется состояние его в виде чистого вещества, то
для жидких растворов стандартная мольная энергия Гиббса реакции обозначается
а для смеси газов (газовых растворов)
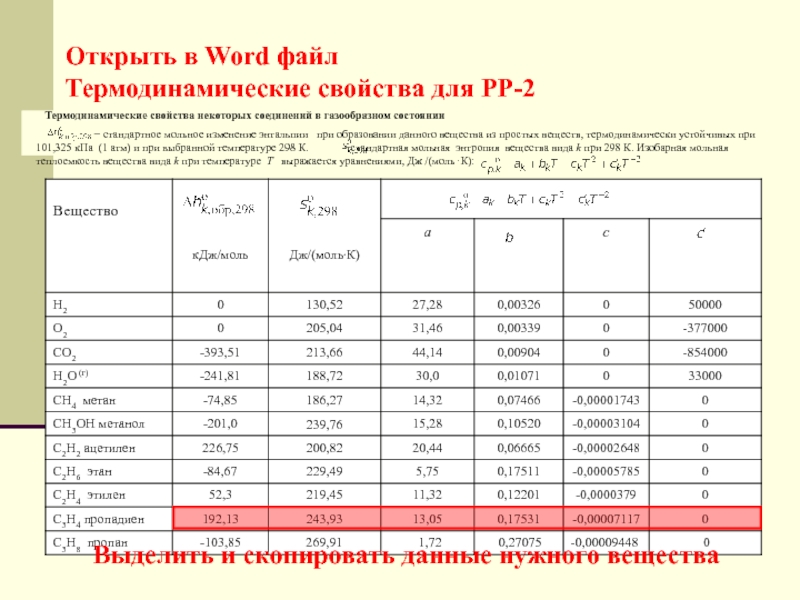
Слайд 47Открыть в Word файл
Термодинамические свойства для РР-2
Термодинамические
свойства некоторых соединений в газообразном состоянии стандартное мольное изменение энтальпии при образовании данного вещества из простых веществ, термодинамически устойчивых при 101,325 кПа (1 атм) и при выбранной температуре 298 К. стандартная мольная энтропия вещества вида k при 298 К. Изобарная мольная теплоемкость вещества вида k при тeмпepaтype Т выражается уравнениями, Дж /(мольК):
Выделить и скопировать данные нужного вещества
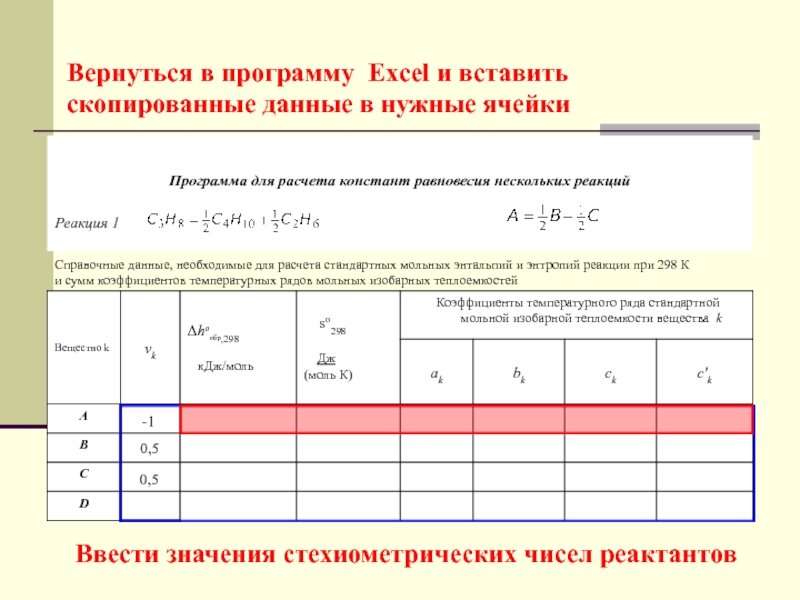
Слайд 48Вернуться в программу Excel и вставить скопированные данные в нужные
ячейки
-1
0,5
0,5
Ввести значения стехиометрических чисел реактантов
Слайд 49Результаты расчета стандартных мольных энтальпий и энтропий реакции при 298
К, а также коэффициентов температурного ряда мольной изобарной теплоемкости реакции
После
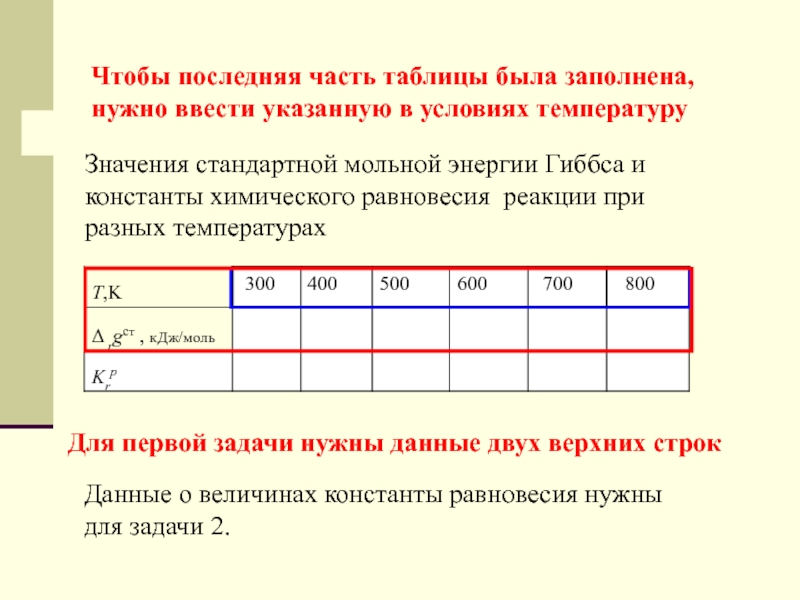
введения справочных данных по всем реактантам, и всех стехиометрических чисел, автоматически получается следующая часть таблицыСлайд 50Значения стандартной мольной энергии Гиббса и константы химического равновесия реакции
при разных температурах
300
400
500
600
700
800
Чтобы последняя часть таблицы была заполнена, нужно
ввести указанную в условиях температуруДля первой задачи нужны данные двух верхних строк
Данные о величинах константы равновесия нужны для задачи 2.
Слайд 51Делаем все то же самое с остальными тремя реакциями
Информацию о
значениях стандартных мольных энергиях Гиббса разных реакций при разных температурах
сводим в табл.5Название таблицы
Таблица 5
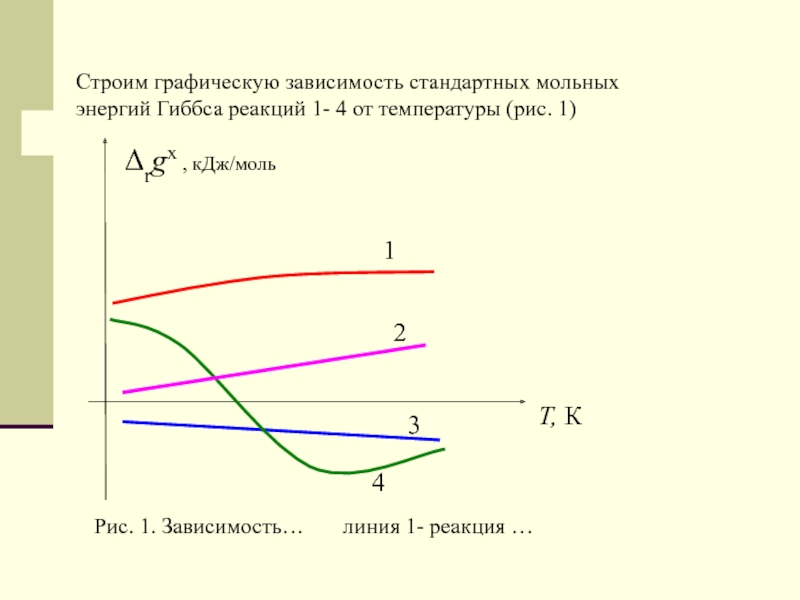
Слайд 52Строим графическую зависимость стандартных мольных энергий Гиббса реакций 1- 4
от температуры (рис. 1)
Рис. 1. Зависимость… линия
1- реакция …1
2
3
4
T, К
Δrgx , кДж/моль
Слайд 53Делаем выводы о наиболее вероятной реакции из рассмотренных
Выводы делаем самостоятельно,
не списывая то, что написал кто-то ранее!!!
Пусть будет немного «корявенько», но зато свое «корявенько»!!!
Слайд 54ЗАДАЧА 2
Полагая, что все остальные реакции подавлены и в системе
протекает только одна, наиболее вероятная реакция, рассчитайте степень термической диссоциации
пропана при разных температурах (и давлении 1 атм) и давлениях (и температуре 620 К)и постройте графические зависимости степени термической диссоциации пропана от температуры и давления.
Проанализируйте полученные данные.
Как будет изменяться степень термической диссоциации пропана, если в систему изначально будет введен посторонний газ?