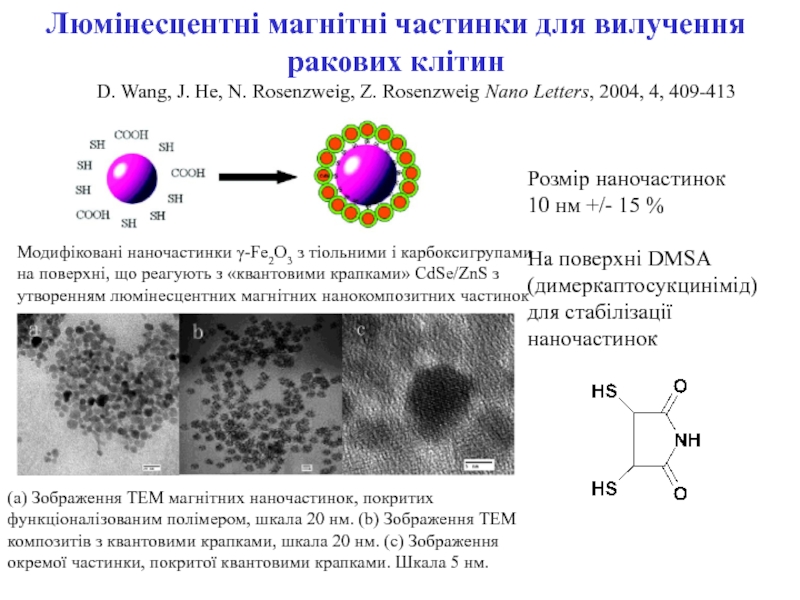
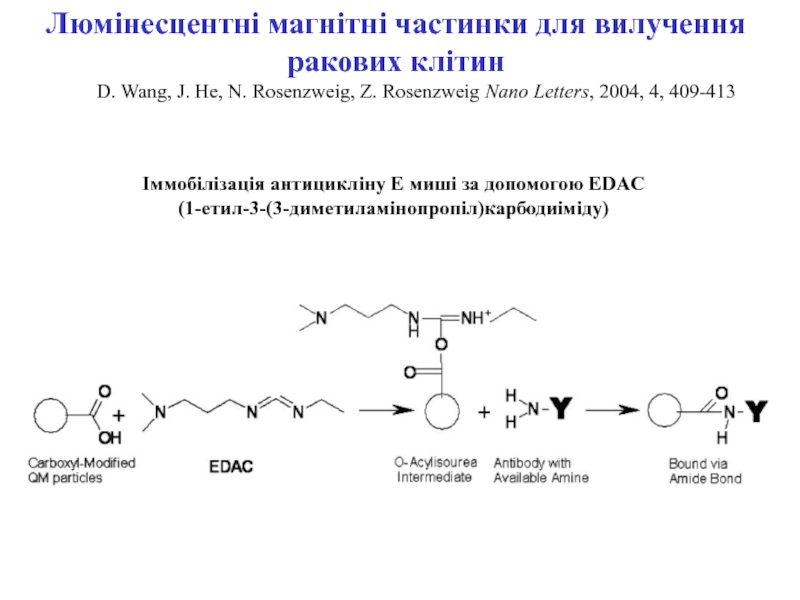
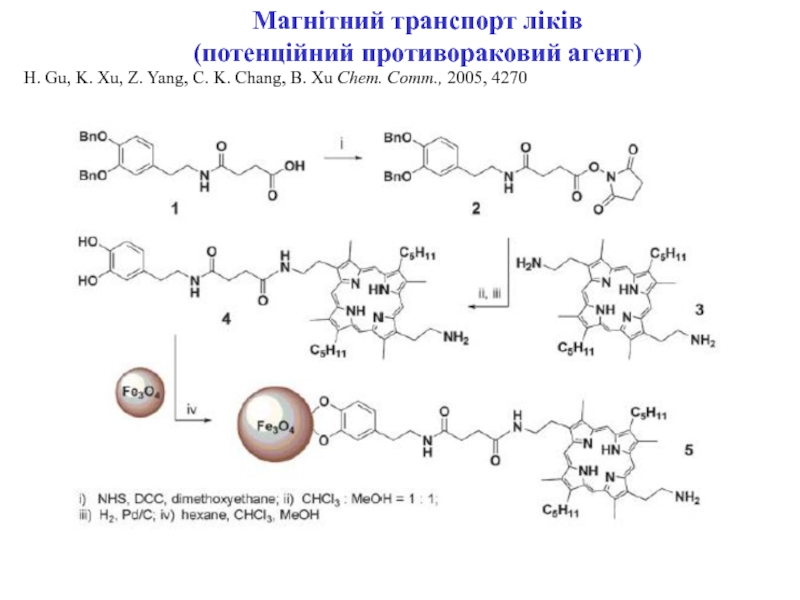
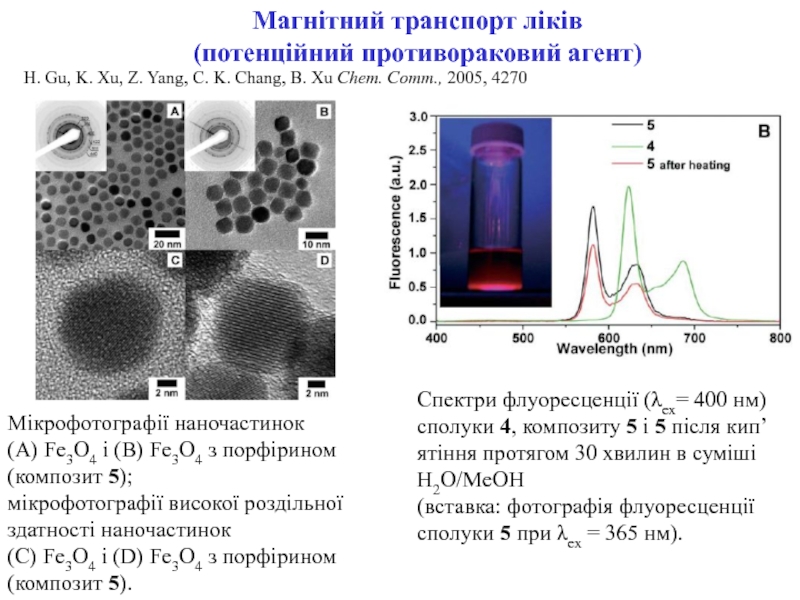
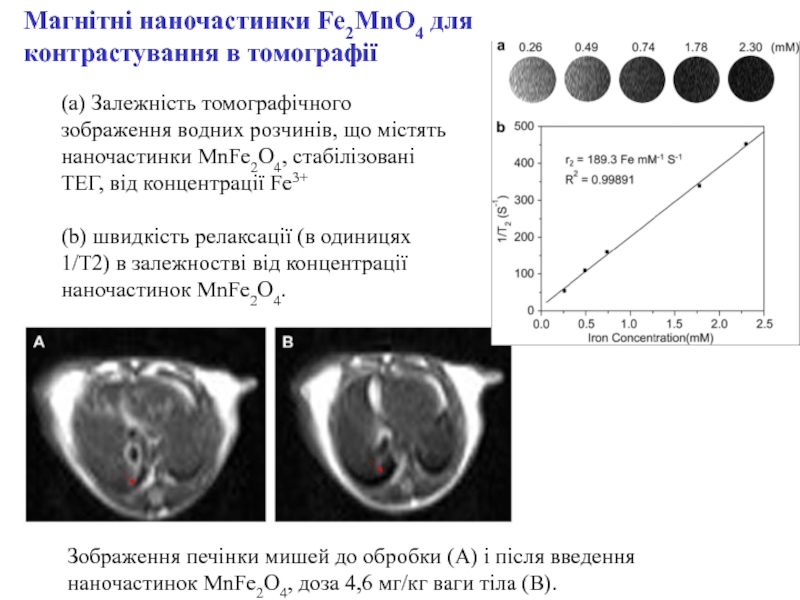
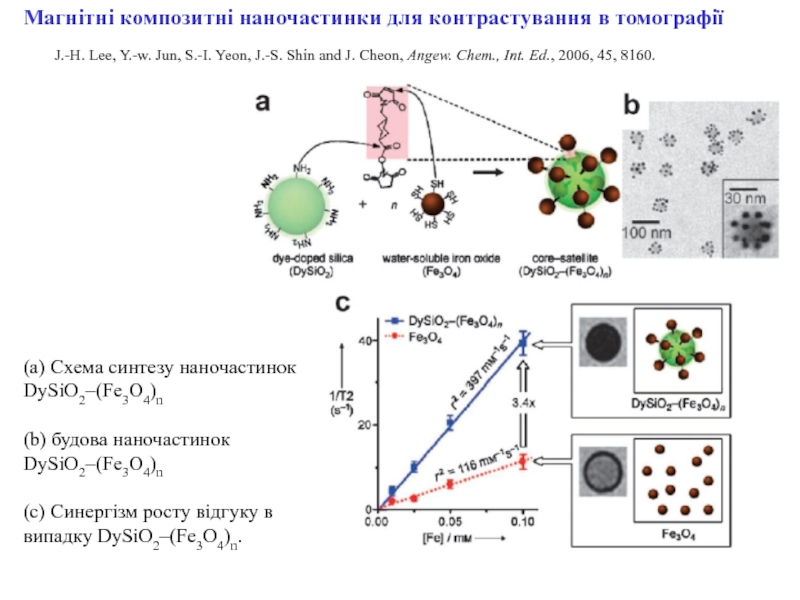
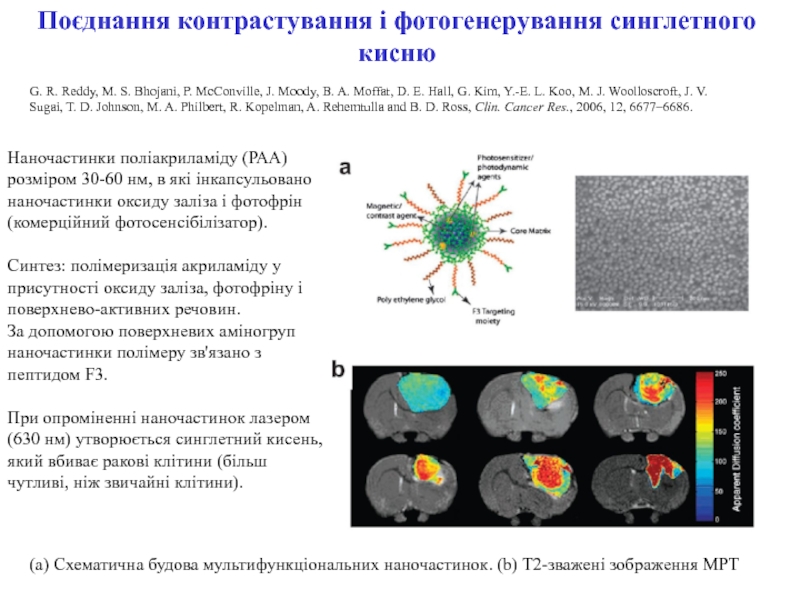
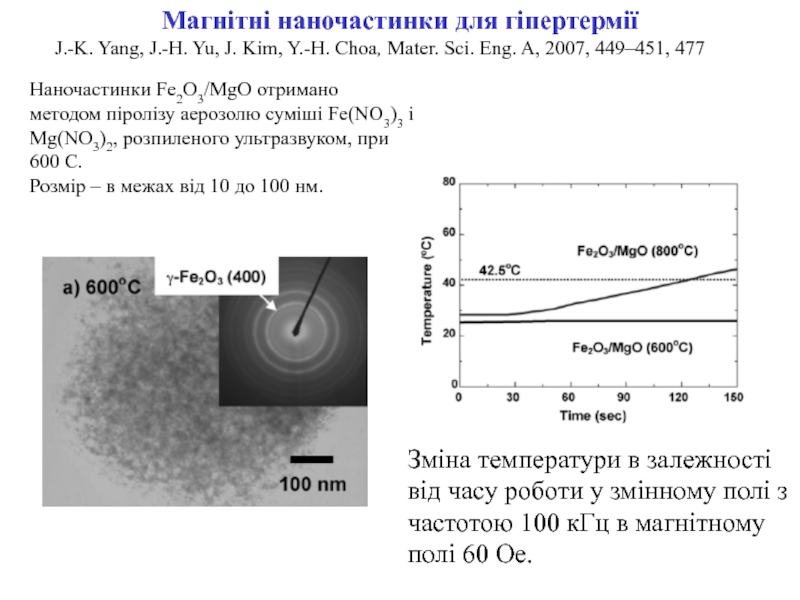
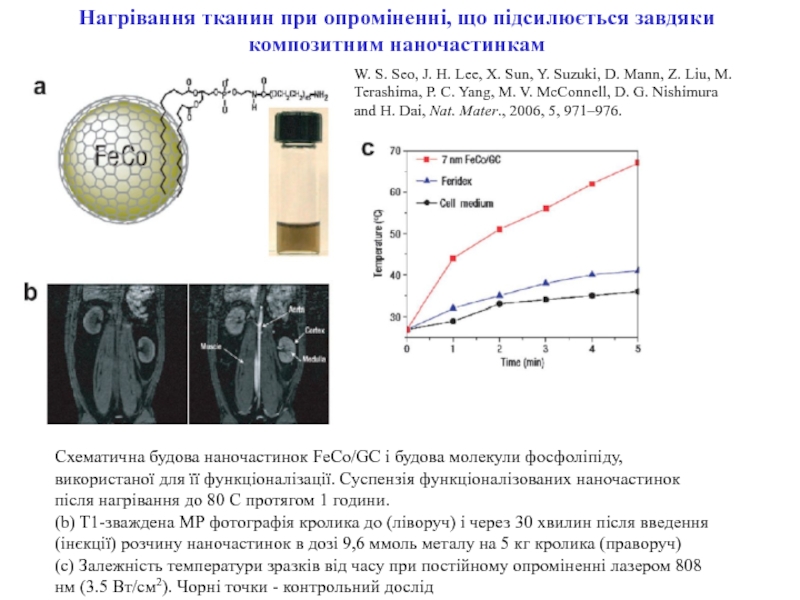
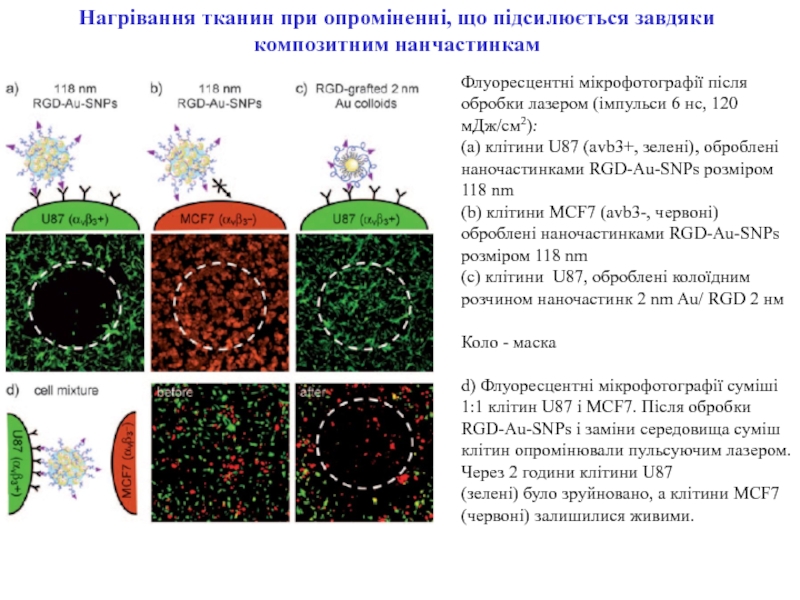
ракових клітин) для діагностики
Магнітний транспорт лікарських препаратів
Агенти для контрастування в
томографії, а також контрастування поряд з ефектами, обумовленими дією світлаАгенти для гіпертермії (міхрохвильового розігрівання тканин)
Візуалізація біохімічних процесів
Регулювання дії модифікованих ензимів