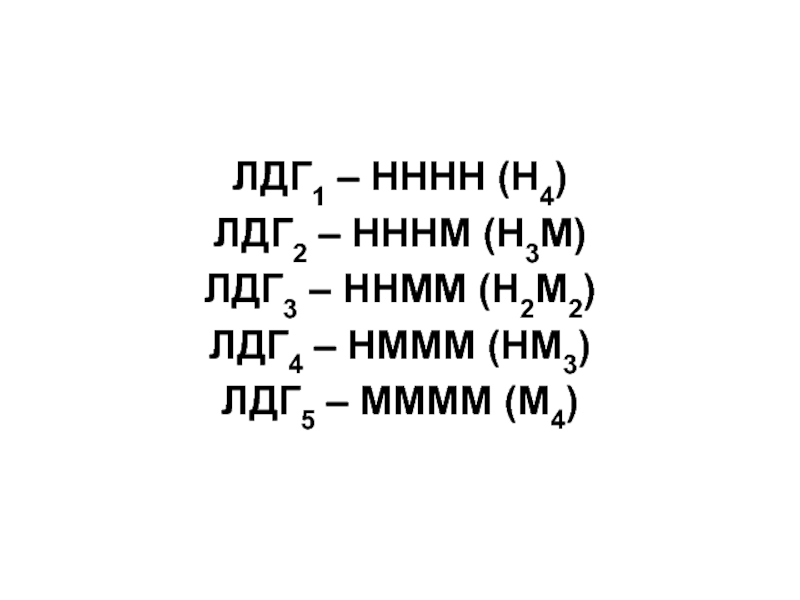Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
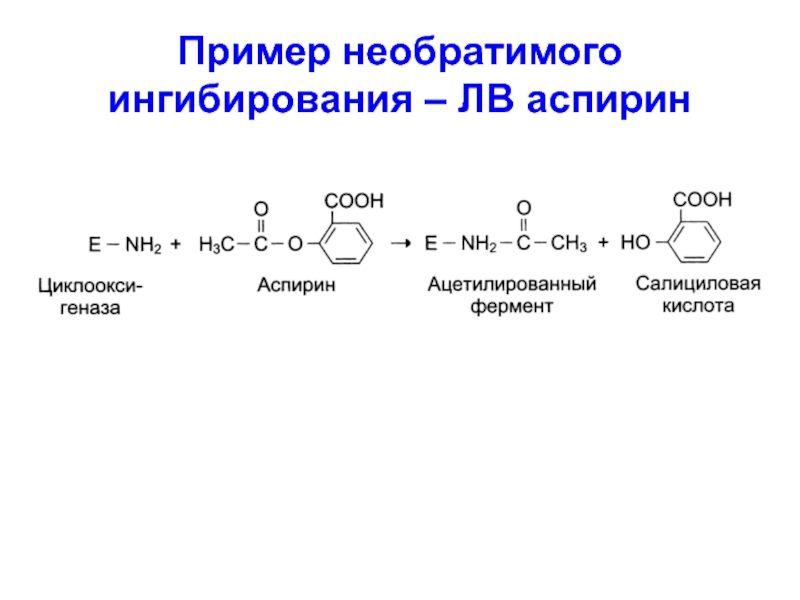
Пример необратимого ингибирования – ЛВ аспирин
Содержание
- 1. Пример необратимого ингибирования – ЛВ аспирин
- 2. Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается
- 3. Конкурентное (изостерическое) I - структурный аналог
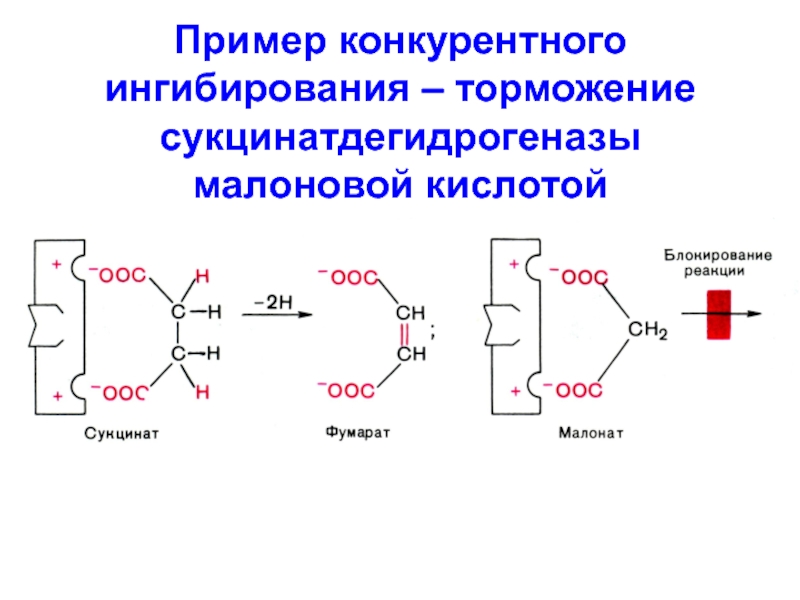
- 4. Пример конкурентного ингибирования – торможение сукцинатдегидрогеназы малоновой кислотой
- 5. Для устранения действия конкурентного I необходимо увеличить
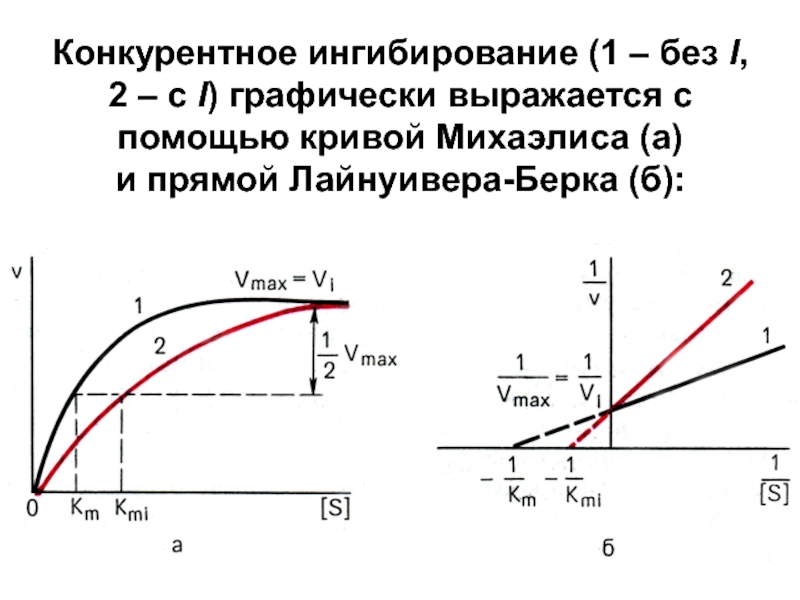
- 6. Конкурентное ингибирование (1 – без I, 2
- 7. Т.о.,в присутствии конкурентного I Vmax реакции не
- 8. На принципе конкурентного ингибирования основано действие многих
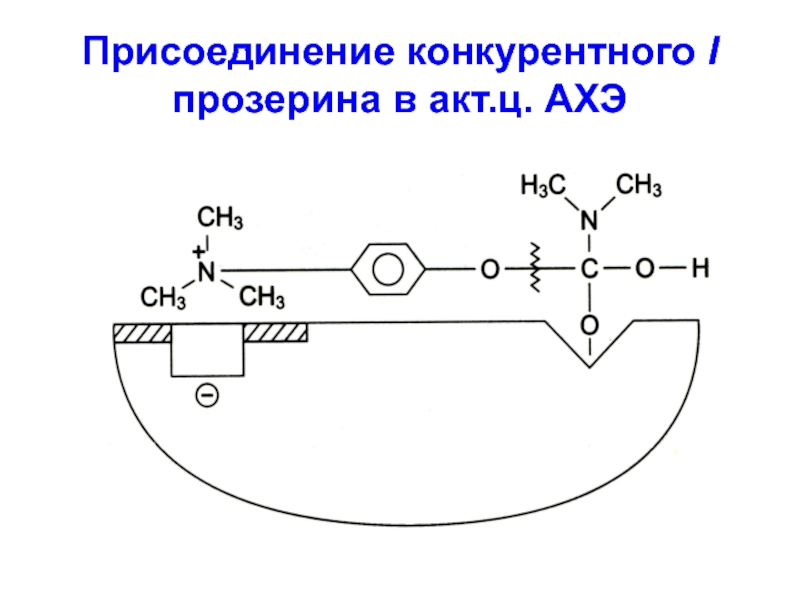
- 9. Присоединение конкурентного I прозерина в акт.ц. АХЭ
- 10. Необратимо действуют фосфоорганические препараты: армин, нибуфин, хлорофос, зарин, зоман, фосфорилируя каталитический участок АХЭ
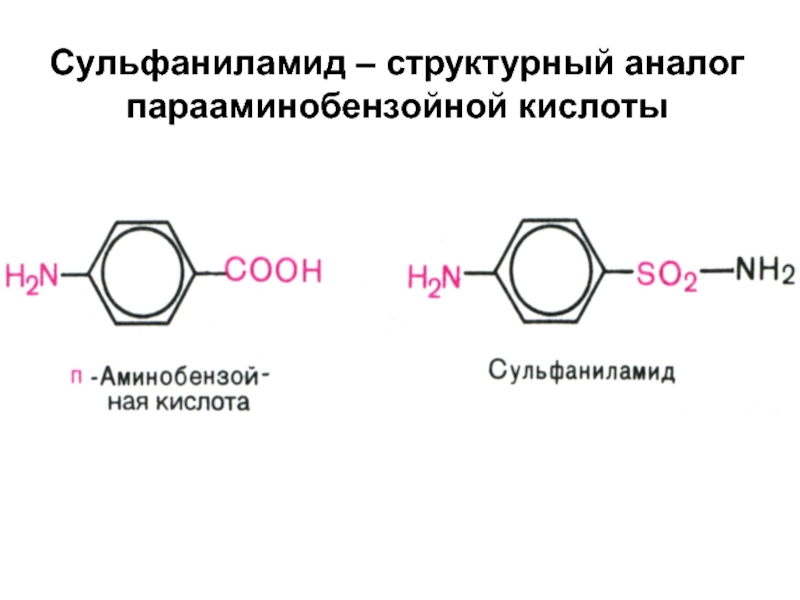
- 11. Сульфаниламид – структурный аналог парааминобензойной кислоты
- 12. Фолиевая кислота образуется в клетках бактерий, если
- 13. Эти Е могут использовать в качестве S
- 14. → в бактериальных клетках возникает недостаток фолиевой
- 15. Неконкурентное (аллостерическое) Это такое ингибирование, при котором I
- 16. Слайд 16
- 17. Неконкурентное ингибирование (1 – без I, 2
- 18. Т.о. под действием неконкурентного I Vmax уменьшается, а
- 19. В роли регуляторов V ферментативных реакций наиболее
- 20. Слайд 20
- 21. Активаторы ферментов 1. Ионы K+, Na+,
- 22. 2. Специфические агенты (н-р, HCl) и другие
- 23. Н-р, пепсиноген превращается в пепсин в результате
- 24. Активность некоторых Е может регулироваться с помощью химической модификации, н-р, путем фосфорилирования-дефорилирования:
- 25. Слайд 25
- 26. 3. Аллостерические активаторы Связываются с R, в
- 27. Слайд 27
- 28. 4. Активаторы, способствующие объединению неактивных субъединиц E в активный надмолекулярный комплекс, имеющий четвертичную структуру
- 29. Изоферменты Это различные молекулярные формы одного
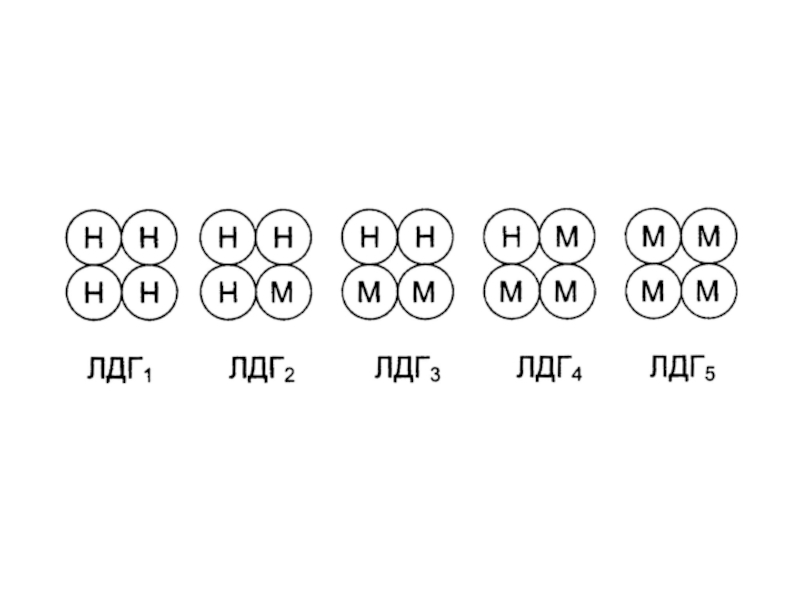
- 30. Например, лактатдегидрогеназа (ЛДГ) имеет четвертичную структуру, содержит
- 31. ЛДГ1 – НННН (Н4)ЛДГ2 – НННМ (Н3М)ЛДГ3 – ННММ (Н2М2)ЛДГ4 – НМММ (НМ3)ЛДГ5 – ММММ (М4)
- 32. Слайд 32
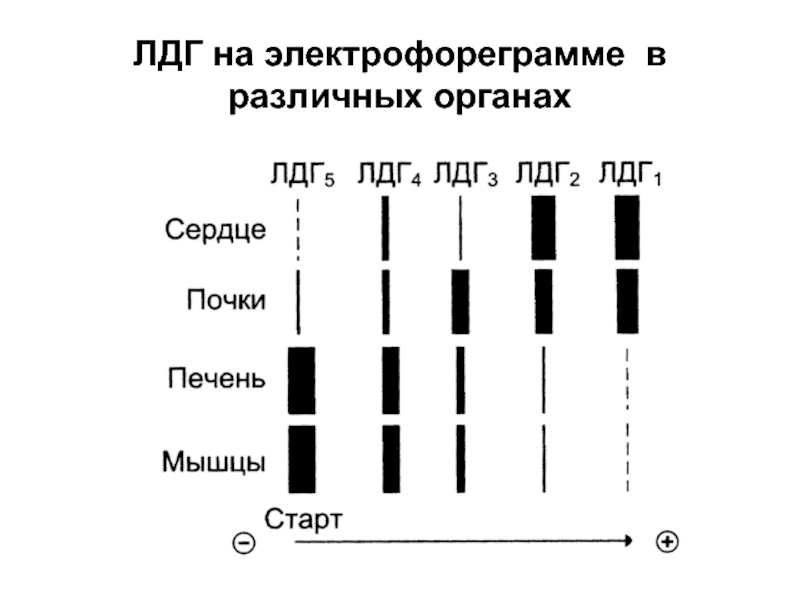
- 33. ЛДГ на электрофореграмме в различных органах
- 34. Мультиэнзимные комплексы (МЭК) - надмолекулярные ферментативные системы, состоящие
- 35. т.е. МЭК – это группа Е, катализирующая последовательное
- 36. Существует несколько видов МЭК, в основе организации
- 37. 1 Отдельные Е объединены в полиферментную систему.
- 38. 2 Е образуют структурные системы с определенной функцией
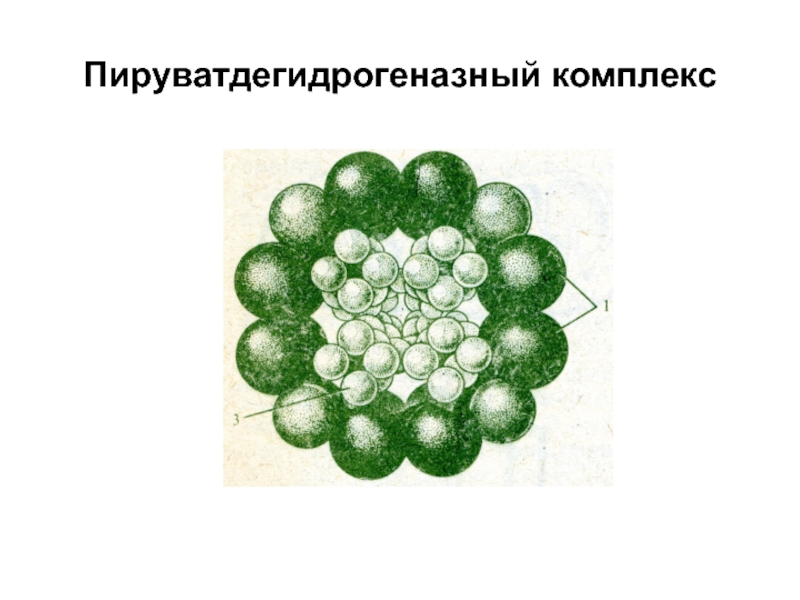
- 39. Пируватдегидрогеназный комплекс
- 40. синтетаза высших жирных кислот, состоящая из 7
- 41. 3 Представляет комбинацию обоих типов организации.
- 42. Биологическое значение Образуется «молекулярный конвейер», благодаря которому: значительно
- 43. Медицинская энзимология ЭнзимопатологияЭнзимодиагностикаЭнзимотерапия
- 44. Энзимопатология
- 45. Н-р, 1: Фенилкетонурия – заболевание, при котором отсутствует
- 46. Энзимодиагностика заключается в
- 47. Например: При инфаркте миокарда увеличивается содержание ферментов ЛДГ1
- 48. Энзимотерапия – использование ферментов в качестве лекарственных
- 49. Имеет следующие направления:Заместительная терапия – использование ферментов
- 50. Использование в качестве дополнительных терапевтических средств (н-р,
- 51. Трудности в использовании ферментов: нестабильностьантигенные свойствапрактически невозможность доставки к клеткам-мишеням
- 52. Для увеличения стабильности Е их связывают с
- 53. Для направленного действия Е на мишень, на
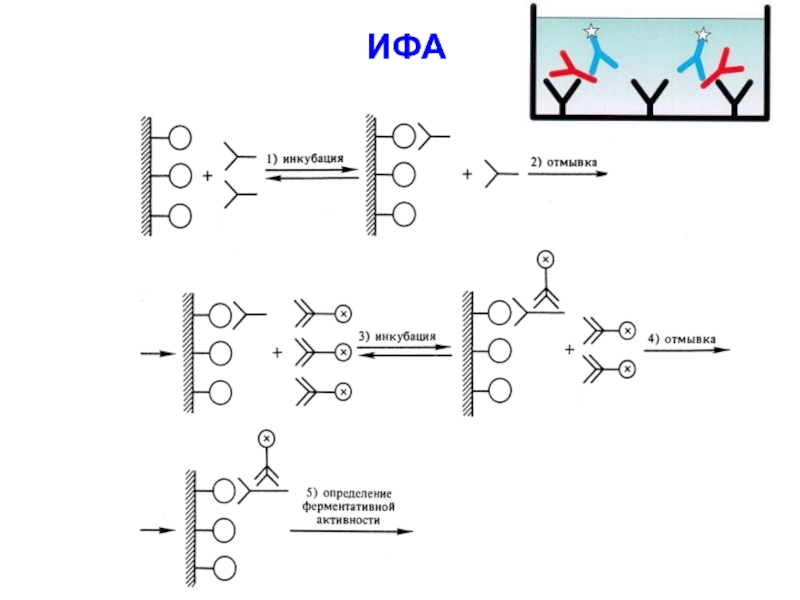
- 54. Ферменты широко используются для определения содержания различных веществ в биологических жидкостях Н-р, с помощью иммуноферментного анализа (ИФА)
- 55. ИФА
- 56. Скачать презентанцию
Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается
Слайды и текст этой презентации
Слайд 2 Обратимое
I связывается с E нековалентными связями → [IE] легко
распадается, активность E при этом восстанавливается
Слайд 3
Конкурентное (изостерическое)
I - структурный аналог S
I связывается с активным
центром E → между I и S возникает конкуренция за
активный центрСлайд 6Конкурентное ингибирование (1 – без I, 2 – с I)
графически выражается с помощью кривой Михаэлиса (а)
и прямой Лайнуивера-Берка (б):Слайд 7Т.о.,
в присутствии конкурентного I Vmax реакции не меняется, а
Кm увеличивается → сродство
E к S уменьшается.Слайд 8 На принципе конкурентного ингибирования основано действие многих ЛВ, например, группа
ацетилхолинэстеразных препаратов, являющихся конкурентными I АХЭ по отношению к S
ацетилхолину: прозерин, физостигмин, эндофоний, севин и др.Слайд 10 Необратимо действуют фосфоорганические препараты: армин, нибуфин, хлорофос, зарин, зоман, фосфорилируя
каталитический участок АХЭ
Слайд 12 Фолиевая кислота образуется в клетках бактерий, если они получают п-аминобензойную
кислоту.
Сульфаниламиды ингибируют Е, у которых при синтезе фолиевой кислоты
используется п-аминобензойная кислотаСлайд 13 Эти Е могут использовать в качестве S сульфаниламиды → синтезируется
не фолиевая кислота, а ее аналог, не способный выполнять функции
кофермента →Слайд 14→ в бактериальных клетках возникает недостаток фолиевой кислоты, нарушаются все
реакции, в которых она участвует, и размножение бактерий становится невозможным
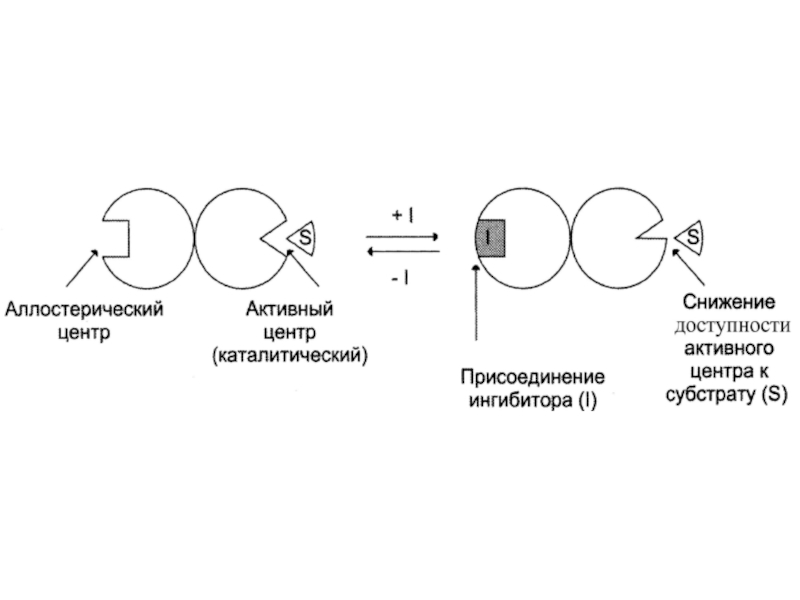
Слайд 15Неконкурентное (аллостерическое)
Это такое ингибирование, при котором I взаимодействует с Е
не в активном центре
(А), а в аллостерическом (R).Связывание I с R приводит к изменению конформации А и ↓ способности связываться с S.
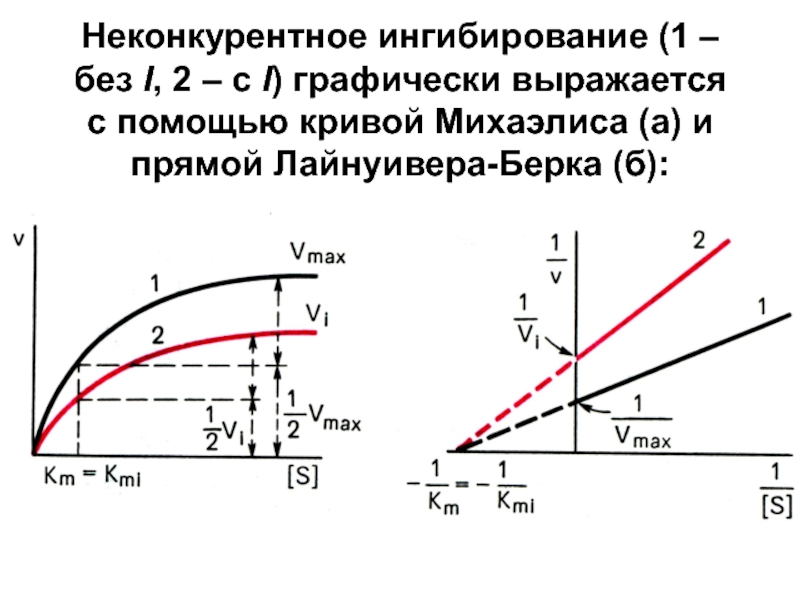
Слайд 17Неконкурентное ингибирование (1 – без I, 2 – с I)
графически выражается с помощью кривой
Михаэлиса (а) и прямой Лайнуивера-Берка (б):Слайд 18Т.о.
под действием неконкурентного I Vmax уменьшается, а Кm не изменяется
→ сродство E к S остается без изменений
Слайд 19 В роли регуляторов V ферментативных реакций наиболее часто выступают: гормоны,
медиаторы, ионы металлов, коферменты, различные метаболиты и т.д.
Ингибиторами аллостерических
ферментов являются часто конечные продукты (Р), а исходные (S) активаторами.Слайд 21
Активаторы ферментов
1. Ионы
K+, Na+, Mg2+, Mn2+, Co2+, Zn2+, Fe2+,
Cl-, SO42-, PO43- и др.
Механизм их действия:
способствуют стабилизации А;
участвуют
в образовании мостика между E и S.Слайд 22 2. Специфические агенты (н-р, HCl) и другие ферменты
Регуляция сводится к
превращению проферментов (неактивных предшественников Е) в активные Е под влиянием
специфических агентов или других ферментов-протеиназ.Слайд 23Н-р, пепсиноген превращается в пепсин в результате ограниченного протеолиза:
под действием
HCl отщепляется пептид, который затрудняет доступ S к A профермента
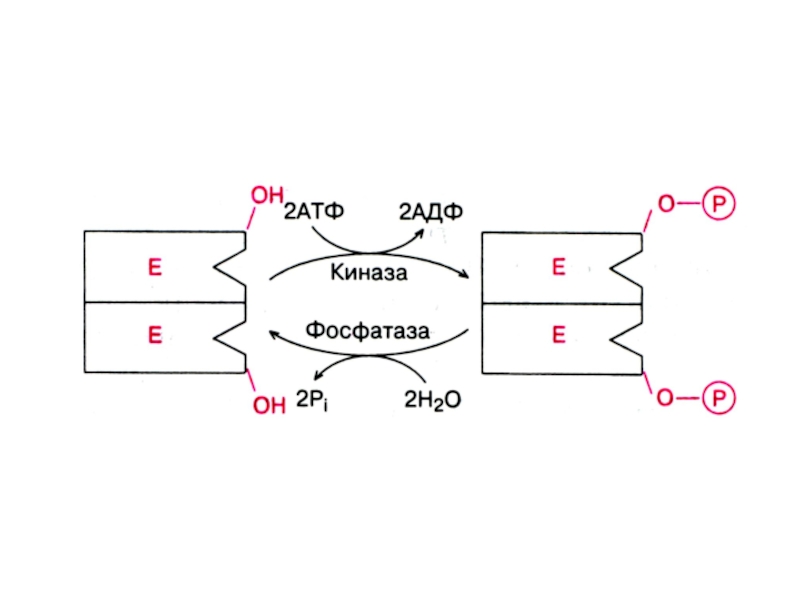
→ E переходит в активную форму - пепсин, к-рый действуя на пепсиноген, делает то же самое, но с большей скоростью (аутокатализ).Слайд 24Активность некоторых Е может регулироваться с помощью химической модификации, н-р,
путем фосфорилирования-дефорилирования:
Слайд 263. Аллостерические активаторы
Связываются с R, в результате чего конформация
E изменяется т.о., что она оптимально соответствует структуре S
Слайд 28 4. Активаторы, способствующие объединению неактивных субъединиц E в активный надмолекулярный
комплекс, имеющий четвертичную структуру
Слайд 29
Изоферменты
Это различные молекулярные формы одного и того же фермента, катализирующие
одну и ту же реакцию, отличающиеся вследствие генетических различий особенностями
строения и физико-химическими свойствами (первичной структурой, электрофоретической подвижностью, Кm, локализацией в клетке).Слайд 30 Например, лактатдегидрогеназа (ЛДГ) имеет четвертичную структуру, содержит 2 типа субъединиц
М и H (от heart - сердце). Путем комбинации этих
двух субъединиц образуются 5 изоформ ЛДГ:Слайд 34Мультиэнзимные комплексы (МЭК) -
надмолекулярные ферментативные системы, состоящие из различных Е,
катализирующих последовательные этапы одного метаболического пути. Отдельные компоненты этих комплексов
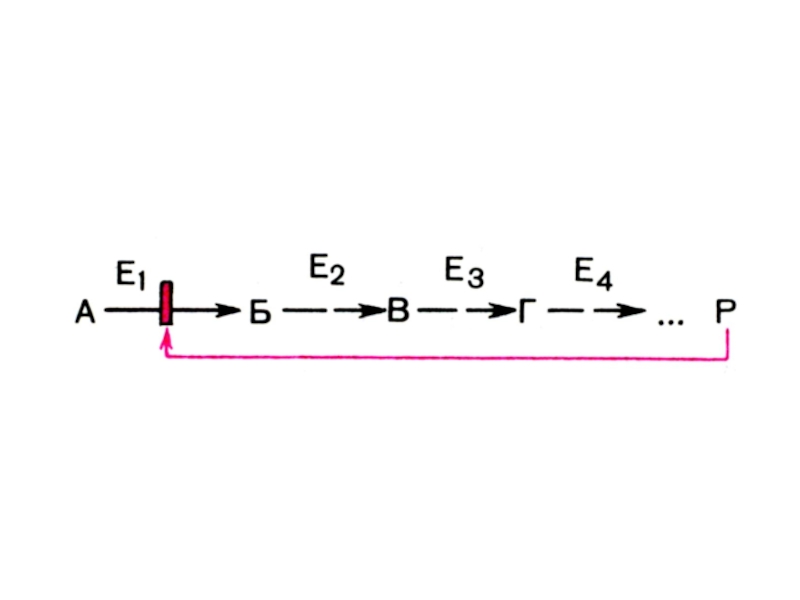
связаны между собой и функционируют только совместно.Слайд 35т.е.
МЭК – это группа Е, катализирующая последовательное
превращение S:
А → В → С → D
и т.д.Е1 Е2 Е3
Слайд 36 Существует несколько видов МЭК, в основе организации которых лежит единство:
1
– функциональное
2 – структурно-функциональное
3 – смешанный тип
Слайд 371
Отдельные Е объединены в полиферментную систему.
Н-р, гликолиз:
S1 → P1(S2) → P2 (S3) →... → PЕ1 Е2 Е11
Каждая реакция катализируется отдельным Е и каждый из P является S следующего Е
Слайд 382
Е образуют структурные системы с определенной функцией при помощи Е-Е
взаимодействий.
Н-р, полиферментный комплекс – пируватдегидрогеназа, состоящий из 3-х E и 5 коферментов, участвующих в окислении ПВКСлайд 40синтетаза высших жирных кислот, состоящая из 7 структурно связанных Е,
в целом выполняющих общую функцию – синтез жирных кислот.
Слайд 413
Представляет комбинацию обоих типов организации.
Н-р, цикл Кребса, в котором часть Е объединена
в α-кетоглутаратдегидрогеназный комплекс (2), а другая часть соединена функционально (1)Слайд 42Биологическое значение
Образуется «молекулярный конвейер», благодаря которому:
значительно сокращается расстояние, на
которое переносятся субстраты;
Е работают более согласованно;
облегчается регуляция Е;
значительно экономится энергия.
Слайд 44Энзимопатология
изучает наследственные
или приобретенные дефекты ферментных систем – энзимопатии. Различают энзимопатии:1 – первичные (наследственные)
2 – вторичные (приобретенные), наблюдающиеяся при всех болезнях
![Пример необратимого ингибирования – ЛВ аспирин Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается](/img/thumbs/2ba32740d8d54ca6a897599c837da196-800x.jpg)