Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Прионы
Содержание
- 1. Прионы
- 2. Прион это«инфекционный белок», который сам принимает неправильную
- 3. Наряду с прионными болезнями к «конформационным» также
- 4. сейчас понятие «прионный» применяется как к «здоровому
- 5. Функции PRPс
- 6. Области реализации функций PrPCФункционирование нервной системы Защитные
- 7. Самовоспроизведение прионовОсуществляется преобразованием с помощью цепных реакцийприоны
- 8. Устойчивость прионов
- 9. Обычные способы стерилизации не были успешными в
- 10. Прузинер сформулировал прионную концепцию – инфекционным агентом
- 11. было обнаружено, что агент, вызывающий скрэйпи, обладает
- 12. Факты дняВ отличие от прионов млекопитающих прионы
- 13. Ключевую роль в размножении прионов дрожжей играет
- 14. Некоторые амилоиды животных имеют полезные и важные
- 15. Влияние наличия PrPc на заражение прионамиорганизмы, лишенные
- 16. Прионные болезниВсе заболевания на сегодняшний день являются
- 17. Штаммовое разнообразие прионовРазмножаясь, белки PrP с различными
- 18. Болезнь Крейтцфельда–Якобаявляется наиболее распространенной человеческой прионной болезнью.
- 19. Слайд 19
- 20. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
- 21. Синдром Герстманна–Штройсслера–Шейнкера (ГШШ; наследственный)Синдром Герстманна–Штройсслера–Шейнкера (ГШШ) является прионным
- 22. Фатальная бессонница яВляется редким наследственным прионным заболеванием, вызывающим
- 23. Болезнь куру или хохочущая смертьЭтой смертельной болезнью
- 24. детекция в тканяхМетод циклической амплификации прионного инфекционного
- 25. фактор невысокой распространённости прионных болезнейсельскохозяйственных животных, прионы
- 26. Группы риска прионных заболеванийВот кого прионные заболевания
- 27. Первые попытки ликвидацииПол Браун с командой, Карлтон
- 28. ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ ПРИОННЫХ ЗАБОЛЕВАНИЙВ настоящее время прионные
- 29. Исследователи из США смогли замедлить течение одной
- 30. Генетики СПбГУ выявили новый тип наследования признаков!В
- 31. Спасибо за внимание!Стать приономБелокНормальная укладка
- 32. Скачать презентанцию
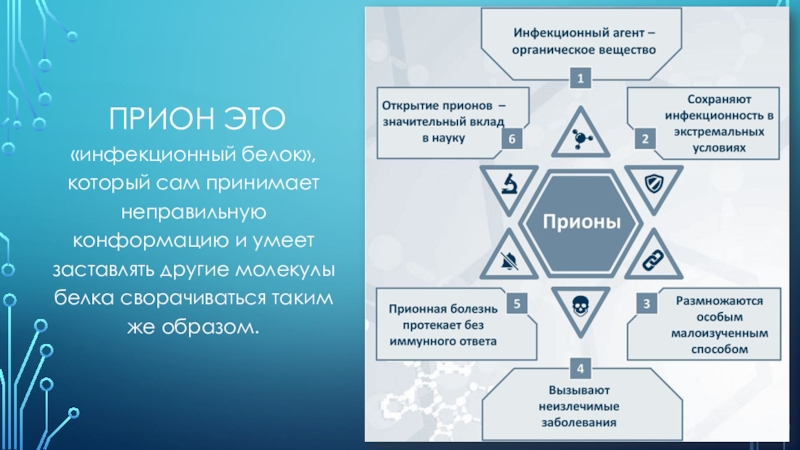
Прион это«инфекционный белок», который сам принимает неправильную конформацию и умеет заставлять другие молекулы белка сворачиваться таким же образом.
Слайды и текст этой презентации
Слайд 2Прион это
«инфекционный белок», который сам принимает неправильную конформацию и умеет
заставлять другие молекулы белка сворачиваться таким же образом.
Слайд 3Наряду с прионными болезнями к «конформационным» также относят амилоидные заболевания,
такие как болезни Альцгеймера, Хангтингтона и Паркинсона.
При амилоидных и
прионных заболеваниях происходит вне- или внутриклеточное накопление белковых агрегатов фибриллярной структуры, состоящих из растворимых в норме клеточных белков. Слайд 4сейчас понятие «прионный» применяется как к «здоровому белку», так и
к патогенному.
Только здоровый называется PrPC (Пи-эр-пи-си) – англ., common
— «обычный» или cellular — «клеточный») , В «здоровой» молекуле превалируют домены а-спирали и почти отсутствуют б-листы (их около 3%), а в молекуле приона б-листы насчитывается порядка 43%молекулА становится нерастворимой и устойчивостью к разрушающим воздействиям
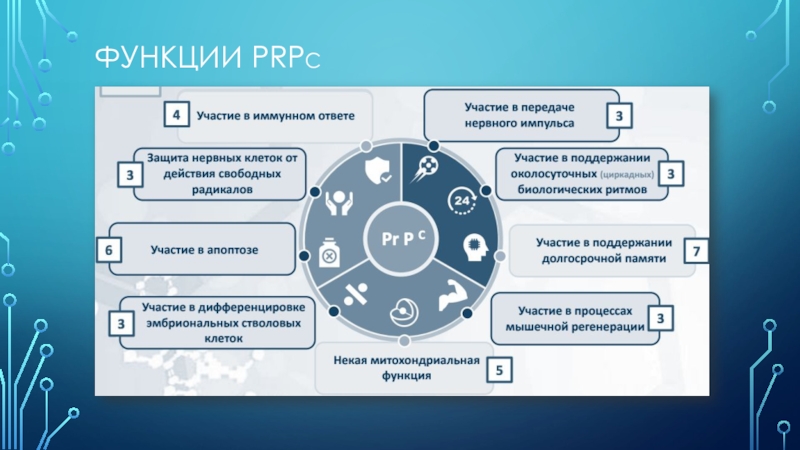
Слайд 6Области реализации функций PrPC
Функционирование нервной системы Защитные процессы в организме
и лимфоретикулярной ткани
Процессы развития
регенерациЯ клеток и тканей
Слайд 7Самовоспроизведение прионов
Осуществляется преобразованием с помощью цепных реакций
прионы должны «найти» в
организме подобные себе PrPC
Меняя конформацию здоровых молекул, прионы увеличивают своё
количество и формируют нерастворимые нити (фибриллы).сначала растёт одна прионная фибрилла, затем она ломается и образуются уже две фибриллы
реакция вовлекает всё большее количество здоровых молекул PrPC до выхода на плато
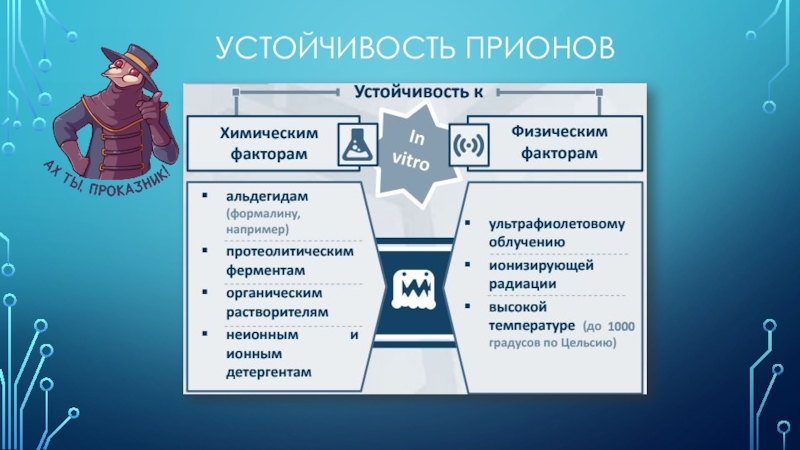
Слайд 9Обычные способы стерилизации не были успешными в устранении инфекционных свойств
прионов.
Недавно запатентовали эффективный способ инактивации прионов. Он заключается в
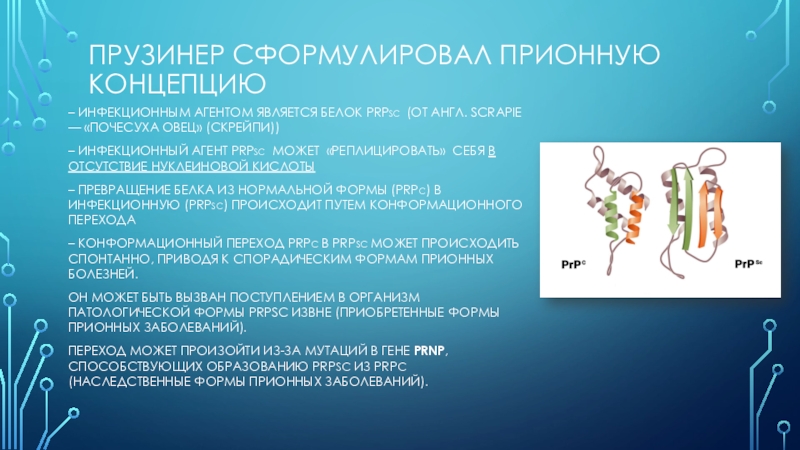
использовании камеры с плазмой (ионизированным газом) H2O2 при высокой (больше 75%) концентрации.Слайд 10Прузинер сформулировал прионную концепцию
– инфекционным агентом является белок PrPSc
(от англ. scrapie — «почесуха овец» (скрейпи))
– инфекционный агент PrPSc
может «реплицировать» себя в отсутствие нуклеиновой кислоты– превращение белка из нормальной формы (PrPC) в инфекционную (PrPSc) происходит путем конформационного перехода
– конформационный переход PrPC в PrPSc может происходить спонтанно, приводя к спорадическим формам прионных болезней.
Он может быть вызван поступлением в организм патологической формы PrPSc извне (приобретенные формы прионных заболеваний).
переход может произойти из-за мутаций в гене Prnp, способствующих образованию PrPSc из PrPC (наследственные формы прионных заболеваний).
Слайд 11было обнаружено, что агент, вызывающий скрэйпи, обладает необычными свойствами:
устойчив
к ионизирующей радиации и ультрафиолету
устойчив к нагреванию
сохраняет активность после обработки
протеиназой , мочевиной, SDS и агентами, повреждающими ДНК – нуклеазами чувствителен к ионизирующей радиации в присутствии кислорода
Слайд 12Факты дня
В отличие от прионов млекопитающих прионы дрожжей не приводят
к гибели клеток, напротив они могут повышать их выживаемость в
неблагоприятных условиях.В 2016 году появилось сообщение о наличии у растения Arabidopsis thaliana белков с прионными свойствами
Так же множество прионных белков было обнаружено и у бактерий!
Слайд 13Ключевую роль в размножении прионов дрожжей играет Hsp104, которая дробит
прионные нити на короткие фрагменты, выдергивая из нитей отдельные белковые
молекулы.Эти мелкие фрагменты растут так же хорошо, как и большие, и обладают даже большей инфекционностью. Вероятно, главное отличие прионов и неинфекционных амилоидов состоит в повышенной подверженности прионов фрагментации.
Hsp104 обнаружена только у дрожжей, у животных пока данный белок не выделен, но явно имеется структура с подобной функцией
Слайд 14Некоторые амилоиды животных имеют полезные и важные функции.
У дрозофилы
переход в амилоидное состояние белка Orb2 является ключевым событием в
механизме долговременной памяти. Не исключено, что память человека тоже основана на амилоидном превращении.Слайд 15Влияние наличия PrPc на заражение прионами
организмы, лишенные PrPC, должны быть
устойчивы к прионной инфекции
Это было показано с использованием трансгенных
мышей, гомозиготных по делеции гена Prnp. Введение гомогената мозга мышей, больных скрэйпи, трансгенным мышам Prnp0/0 не приводило к развитию болезни ввиду отсутствия нормального PrPC. Более того, оказалось, что в отсутствие PrPC не происходит не только репликации приона, но и повреждения нервной ткани. PrPC также необходим для транспорта инфекционного агента периферическими нервами к центральной нервной системе.
Слайд 16Прионные болезни
Все заболевания на сегодняшний день являются смертельными.
Они могут
быть наследственными (примерно 15% случаев), приобретенными (< 1% случаев) и
спорадическими (85% случаев), но независимо от этиологии заболевания оно может быть передано инфекционным путем.Слайд 17Штаммовое разнообразие прионов
Размножаясь, белки PrP с различными конформациями обуславливают разницу
в течении прионных заболеваний: возможны различные инкубационные периоды, клинические проявления,
повреждения разных участков мозга.В последнее время появились данные о возможной роли гликозилирования PrP в приобретении прионом штаммовой специфичности.
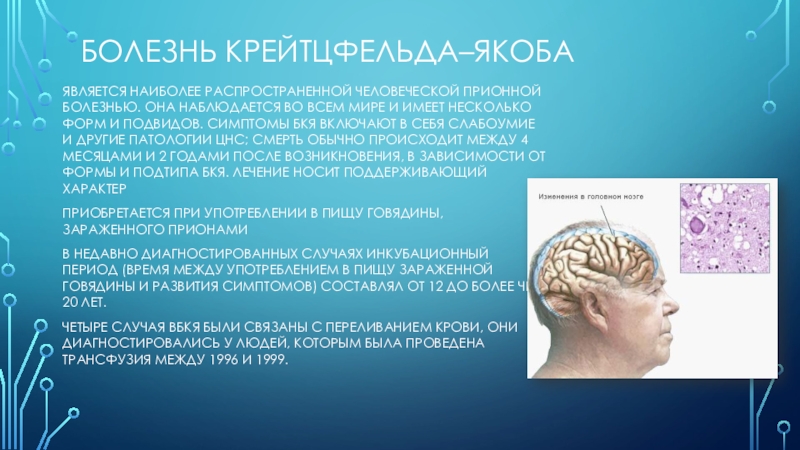
Слайд 18Болезнь Крейтцфельда–Якоба
является наиболее распространенной человеческой прионной болезнью. Она наблюдается во
всем мире и имеет несколько форм и подвидов. Симптомы БКЯ
включают в себя слабоумие и другие патологии ЦНС; смерть обычно происходит между 4 месяцами и 2 годами после возникновения, в зависимости от формы и подтипа БКЯ. Лечение носит поддерживающий характерприобретается при употреблении в пищу говядины, зараженного прионами
В недавно диагностированных случаях инкубационный период (время между употреблением в пищу зараженной говядины и развития симптомов) составлял от 12 до более чем 20 лет.
Четыре случая вБКЯ были связаны с переливанием крови, они диагностировались у людей, которым была проведена трансфузия между 1996 и 1999.
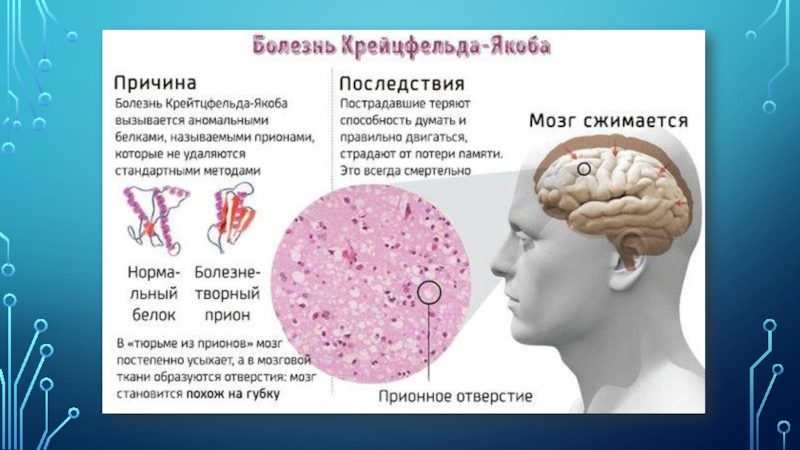
Слайд 20Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань
в результате массовой гибели нейронов.
Слайд 21Синдром Герстманна–Штройсслера–Шейнкера (ГШШ; наследственный)
Синдром Герстманна–Штройсслера–Шейнкера (ГШШ) является прионным заболеванием головного мозга,
которое наследуется по аутосомно-доминантному типу и обычно развивается в среднем
возрасте.У больных с мозжечковой дисфункцией развивается мозжечковая атаксия. Могут присоединиться парез взора, глухота, паркинсонизм, деменция
При наличии характерных симптомов и семейного анамнеза у лиц молодого возраста (≤45 лет) более вероятен синдром ГШШ. Генетическое исследование может подтвердить диагноз.
Слайд 22Фатальная бессонница
яВляется редким наследственным прионным заболеванием, вызывающим нарушения сна, двигательные
расстройства и летальный исход.
Фатальная семейная инсомния - следствие аутосомно-доминантной мутации в PrP гене.
Средний возраст начала заболевания составляет около 40 лет (от поздних 20 до ранних 70 лет). Продолжительность жизни составляет 7-73 мес. Ранние симптомы включают возрастающие трудности с засыпанием и поддержанием сна, а также снижение когнитивных способностейПри спорадической фатальной бессоннице (sFI) генетическая мутация PrP отсутствует.
Слайд 23Болезнь куру или хохочущая смерть
Этой смертельной болезнью страдали члены канибального
племени форе из новой гвинеи. название куру на их языке
имеет два значения — «дрожь» и «порча».Главными признаками заболевания являются сильная дрожь и порывистые движения головой, иногда сопровождаемые улыбкой, подобной той, которая появляется у больных столбняком. В течение нескольких месяцев ткани головного мозга деградируют, превращаясь в губчатую массу, после чего пациент умирает.
Болезнь распространялась через ритуальный каннибализм, а именно поедание мозга болевшего этим заболеванием. С искоренением каннибализма куру практически исчезла.
Смерть обычно наступает в течение 2 лет после появления симптомов; причиной смерти, как правило, являются пневмония или инфекция, вызванная пролежнями.
В случае заболевания куру существует только поддерживающее лечение.
Слайд 24детекция в тканях
Метод циклической амплификации прионного инфекционного агента эффективен для
диагностики губчатых энцефалопатий человека, поскольку позволяет детектировать PrPSc в тканях
и биологических жидкостях человека на ранних стадиях развития болезни.Слайд 25фактор невысокой распространённости прионных болезней
сельскохозяйственных животных, прионы поражают крайне редко
себе
подобных цивилизованное общество в пищу не потребляет
спонтанные сбои конформации PrPC
случаются относительно редко.хотя инфекционность прионов и довольно стойкая, всё же существуют разрушающие воздействия, которые успешно её инактивируют и в несильно агрессивных условиях
Слайд 26Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей
вероятностью:
работники пищевой промышленности;
ветеринары;
патологоанатомы;
хирурги;
пациенты трансплантолога;
каннибалы;
лица, в семье которых были замечены синдромы прионных
заболеваний.Слайд 27Первые попытки ликвидации
Пол Браун с командой, Карлтон Д. Гайдушек 28
марта 2000 года
Биоматериал, содержащий прионы штамма 263К нагревали до температуры
от 150 до 1000 градусов по Цельсию, после чего вводили в мозг здоровым хомякам.Инфекционность на 100% исчезала после нагревания биоматериала до температуры свыше 1000 градусов по Цельсию
Слайд 28ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ ПРИОННЫХ ЗАБОЛЕВАНИЙ
В настоящее время прионные болезни считаются неизлечимыми,
однако подходы к их лечению активно разрабатываются.
Губчатые энцефалопатии характеризуются
отсутствием иммунного ответа на прионную инфекцию. Это связано с тем, что нормальная форма PrP всегда присутствует в организме, и в том числе в T- и B-лимфоцитах. in vitro было показано, что антитела против нескольких эпитопов PrP ингибируют размножение PrPSc.
Вакцинация и пассивная иммунизация антителами против некоторых эпитопов PrP приводили к ингибированию репликации приона и отсрочке заболевания.
Размножение PrPSc может быть остановлено с помощью «блокаторов β-структур»
Слайд 29Исследователи из США смогли замедлить течение одной из прионных болезней
у лабораторных животных. Они использовали антисмысловые нуклеотиды, которые связывались с
транскриптом генов прионных белков и подавляли их синтез.Слайд 30Генетики СПбГУ выявили новый тип наследования признаков!
В исследовании, проведенном на
модельном объекте, дрожжах-сахаромицетах, генетики СПбГУ впервые показали, что наследственные изменения
в клетках этих микроорганизмов могут возникать не в результате прионизации одного белка, а вследствие взаимодействия разных прионов.Таким образом, петербургские ученые впервые охарактеризовали новый «полиприонный» тип наследования признаков.