Слайд 1ПРОТОЧНАЯ ЦИТОМЕТРИЯ
FLOW
CYTOMETRY
ЛЕКЦИЯ 3
Слайд 2 Проточная цитометрия – исследователь-
ская технология, позволяющая на основе
измерений
оптических параметров, охаракте-
ризовать физические и биохимические свой-
ства клеток. В ходе
анализа одновременно
производят фотометрию и флуориметрию
отдельных клеток, которые в составе лами-
нарного потока жидкости поочерёдно пересе-
кают монохроматический световой поток,
создаваемый лазером.
Гелий-неоновый лазер, λ = 633 nm (красный)
Аргоновый лазер, λ = 488 nm
Гелий-кадмиевый лазер, λ около 400 nm (УФ)
Слайд 3 Принцип проточной цитометрии (подсчет клеток крови) был
запатентован в 1953 году в США Уоллесом Коултером (Wallace H.
Coulter).
Первая лабораторная установка для реги-страции флуоресценции потока клеток из первичной суспензии создана в 1968 году Вольфгангом Гёде (Wolfgang Göhde) в Уни-верситете Мюнстера (Германии).
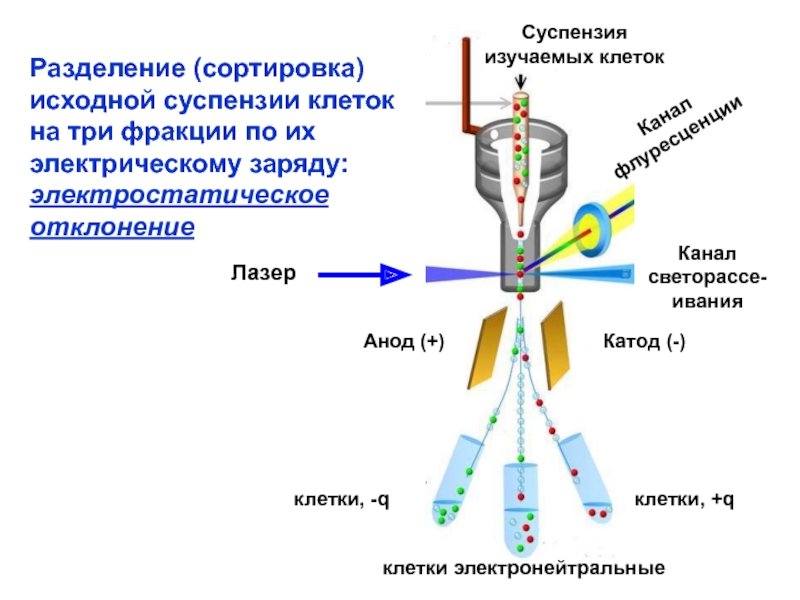
На три года раньше, в 1965 году Марк Фульвейлер (Mack Fulwyler) разработал устройство, позволяющее разделять суспен-зию клеток по их электрическому заряду. Этот методический подход широко исполь-зуется и сегодня.
Слайд 4Разделение (сортировка)
исходной суспензии клеток
на три фракции по их
электрическому заряду:
электростатическое
отклонение
Суспензия
изучаемых клеток
Лазер
Канал
флуресценции
Канал
светорассе-
ивания
Катод (-)
Анод (+)
клетки, -q
клетки,
+q
клетки электронейтральные
Слайд 5
В 1969 году был выпущен первый серийный
проточный
цитометр в форме приставки к
флуоресцентному микроскопу фирмы «Zeiss».
С 1970 года в цитометре стали использо-вать гелий-неоновый лазер с излучением, λ = 633 нм. («Cytograph»). Этот прибор позволял быстро разделить изучаемую суспензию клеток на живые и погибшие клетки по вклю-чению в погибшие клетки красителя трипа-нового синего. Позже прибор был усовершен-ствован благодаря использованию аргоно-вого лазера, λ = 488 нм. («Cytofluorograph»).
Слайд 6 Термин «проточная цитометрия» («flow cyto-
metry») был предложен на
международной
конференции «The Conference of the American
Engineering Foundation in
Pensacola, Florida» в
1976 году.
С тех пор этот термин утвердился во всем
мире.
Иногда можно встретить термин проточная цитофлуориметрия.
Этот термин не корректный, поскольку одно-
временно измеряется не только флуоресцен-
ция, но и интенсивность рассеянного светово-го потока.
Слайд 7 Проточная цитометрия позволяет охаракте-
ризовать физические и биохимические свой-
ства
суспензии клеток в диапазоне их разме-
ров от 0,2 до 150
μm.
Преимущества метода проточной цитометрии:
Короткое время анализа (за счет высокой скорости
движения клеток по капилляру, до 1000 клеток/с);
2. Анализ большого количества клеток (до 108 клеток);
3. Высокая точность измерения интенсивности флуо-
ресценции и светорассеивания.
Образцами являются: костный мозг, ликвор, сустав-ная, плевральная или асцитическая жидкости, а также суспендированные клетки крови и различных тканей.
Слайд 8 В ходе анализа возможно определять 5-10 различ-ных
параметров клетки: размер, содержание ДНК, белков (цитокинов, транскрипционных факоров) и
липидов, антигенные свойства и активность фермен-тов, а также возможны исследование клеточного цикла, мониторинг состояния вирусного процесса, количественный анализ внутриклеточных компонен-тов и количественные измерения путем дифференци-ровки интенсивности рассеяния / флуоресценции при различных длинах волн.
Слайд 9 Проточная цитометрия в её современных вариан-
тах - мультипараметрический
анализ.
Это позволяет минимизировать необходимый объем биологического материала (до
100 мкл), сни-зить время пробоподготовки и фактического анали-за, сокращая тем самым, путь от получения образца до клинической интерпретации результата – ответа лаборатории клинике.
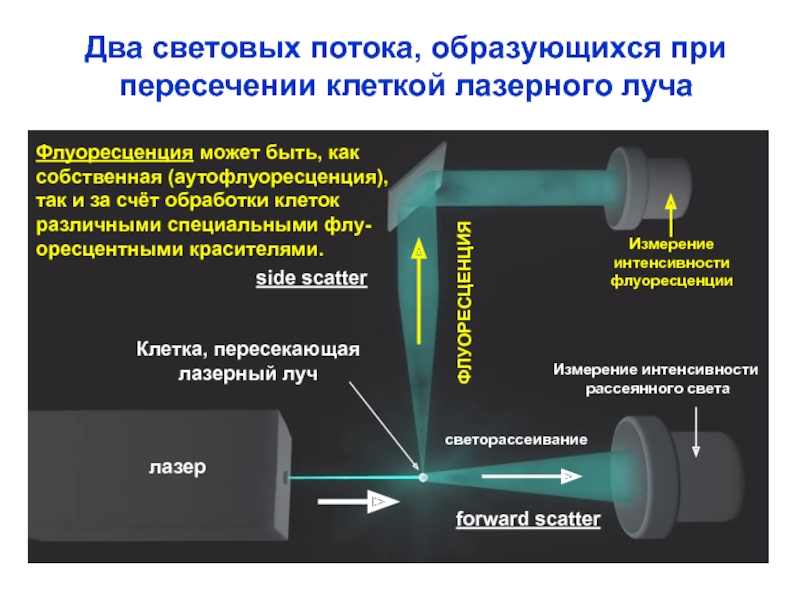
лазера одновременно:
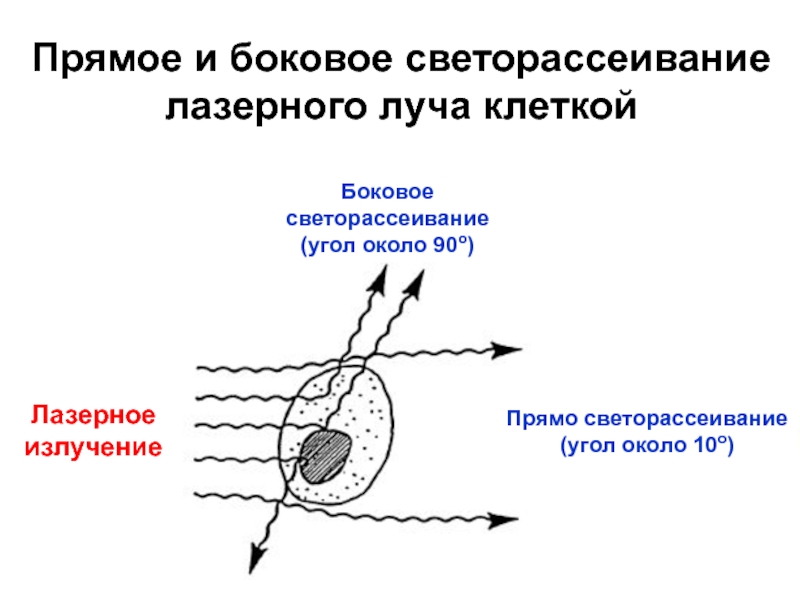
1. Рассеивается клетками: малоугловое (пря-мое) светорассеивание (угол
ок. 10о, если
Ø клетки ≈ λ) и боковое светорассеяние (угол ок. 90о, если Ø клетки < λ). Интенсивность светорассеяния измеряют с помощью фотометрического оптического канала.
2. Возбуждает флуоресценцию: собственная (аутофлуоресценция) и после предвари-тельной обработки клеток одним или несколь-кими флуоресцентными красителями, либо МКА, конъюгированными с молекулой флуо-рохрома. Интенсивность флуоресценции измеряют с помощью флуоресцентного опти-ческого канала.
Слайд 11
side scatter
forward scatter
лазер
Клетка, пересекающая
лазерный луч
ФЛУОРЕСЦЕНЦИЯ
светорассеивание
Измерение
интенсивности
флуоресценции
Измерение интенсивности
рассеянного света
Два световых
потока, образующихся при
пересечении клеткой лазерного луча
Флуоресценция может быть, как
собственная (аутофлуоресценция),
так и за счёт обработки клеток
различными специальными флу-
оресцентными красителями.
Слайд 12
Принципиальное устройство проточного
цитометра (flow cytometer)
Лазер
Устройство для создания
ламинарного потока клеток
изучаемой суспензии (гидро-
динамическое фокусирование)
Лазерный луч
Оптическая система
Датчики, преобразующие
световые потоки в
электрические
импульсы
Компьютер
Поток клеток
Поток рассеяного света
флуоресценция
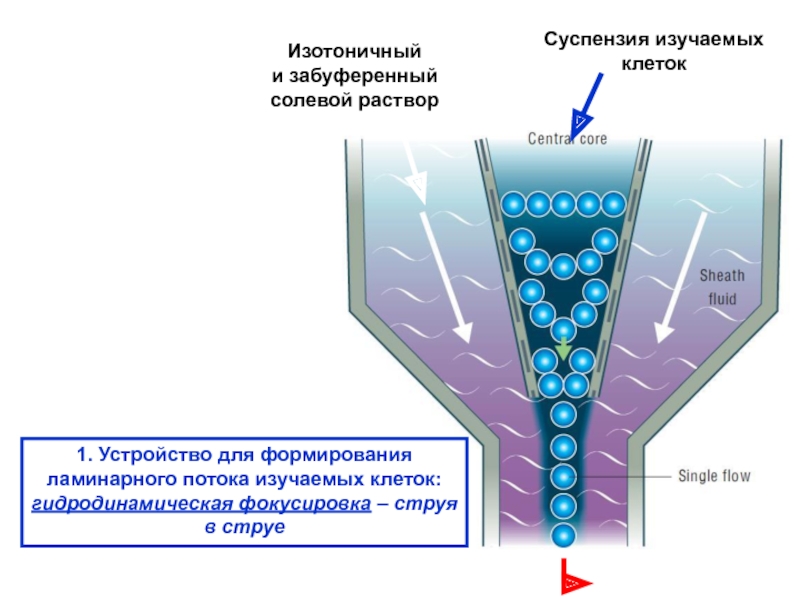
Слайд 131. Устройство для формирования
ламинарного потока изучаемых клеток:
гидродинамическая фокусировка –
струя
в струе
Изотоничный
и забуференный
солевой раствор
Суспензия изучаемых
клеток
Слайд 14
Суспензия изучаемых клеток
Изотоничный
и забуференный
солевой раствор
Кварцевая
проточная
кювета
(в форме
капилляра):
скорость
по-
тока 30 м/с
Луч лазера
(сфокуси-
рованный)
флуоресценция
светорассеивание
Датчик для измерения
интенсивности
флуоресценции
Датчик для измерения
интенсивности
рассеянного
света
1. Устройство для формирования
ламинарного потока изучаемых клеток:
гидродинамическая фокусировка – струя
в струе
Прошедший световой поток
ФЭУ
ФЭУ
Слайд 152. Оптическая система для регистрации интен-
сивности рассеянного светового потока
Измерение интенсивности рассеянного клетками светового потока от лазера позволяет:
а). сосчитать
клетки;
б). определить их размер (по прямому / малоугло-
вому светорассеиванию;
Чем больше размер
клетки (диаметр), тем
сильнее будет свето-
рассеивание.
Слайд 16Лазерное
излучение
Боковое светорассеивание(угол около 90о)
Прямо светорассеивание
(угол около 10о)
Прямое и боковое
светорассеивание
лазерного луча клеткой
Слайд 17Представление распределения клеток изучаемой
суспензии по их размерам (гистограмма распределения)
Количество
клеток
Размер клеток, μm
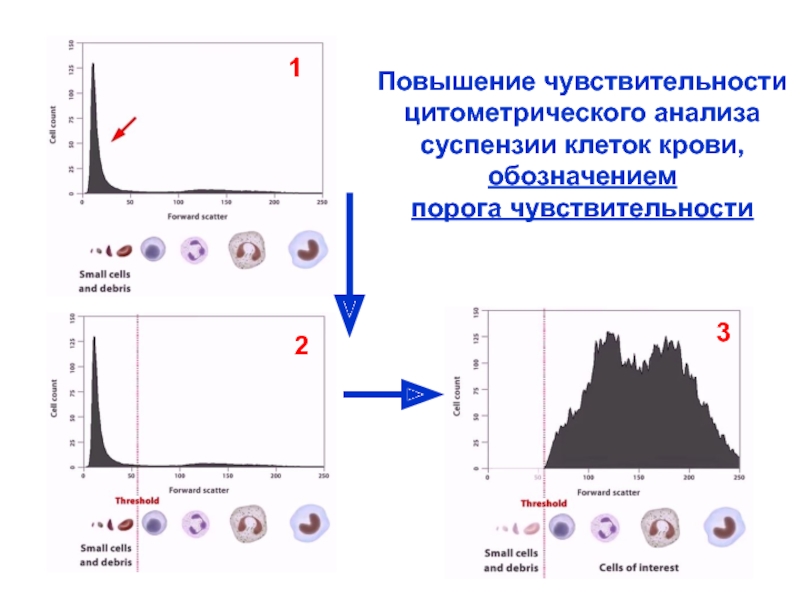
Слайд 18Повышение чувствительности
цитометрического анализа
суспензии клеток крови,
обозначением
порога чувствительности
1
2
3
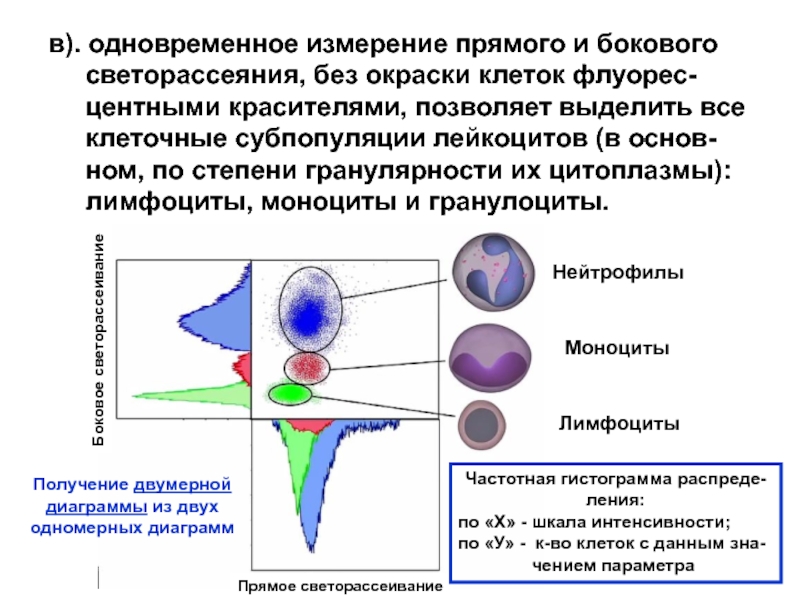
Слайд 19в). одновременное измерение прямого и бокового
светорассеяния, без
окраски клеток флуорес-
центными красителями, позволяет выделить все
клеточные субпопуляции лейкоцитов (в основ-
ном, по степени гранулярности их цитоплазмы):
лимфоциты, моноциты и гранулоциты.
Нейтрофилы
Моноциты
Лимфоциты
Прямое светорассеивание
Боковое светорассеивание
Частотная гистограмма распреде-ления:
по «Х» - шкала интенсивности;
по «У» - к-во клеток с данным зна-
чением параметра
Получение двумерной
диаграммы из двух
одномерных диаграмм
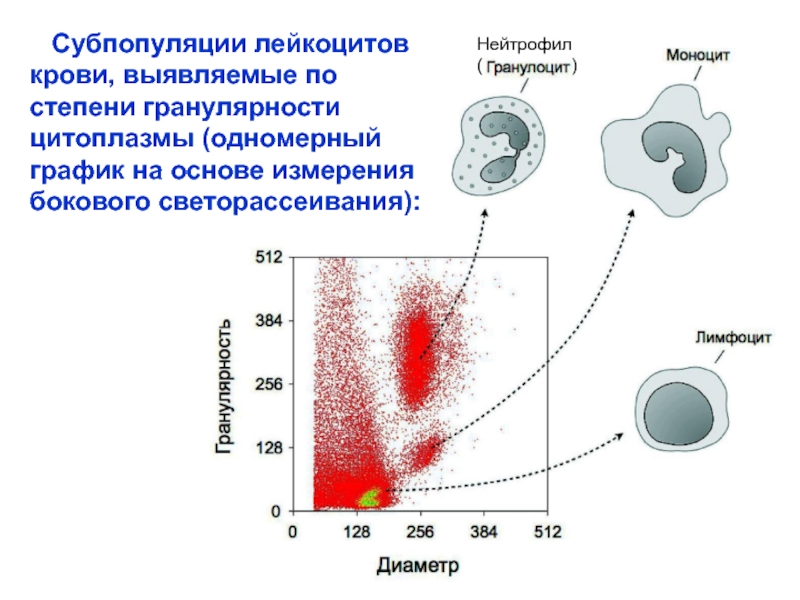
Слайд 20 Субпопуляции лейкоцитов крови, выявляемые по степени гранулярности цитоплазмы
(одномерный график на основе измерения
бокового светорассеивания):
Нейтрофил
(
)
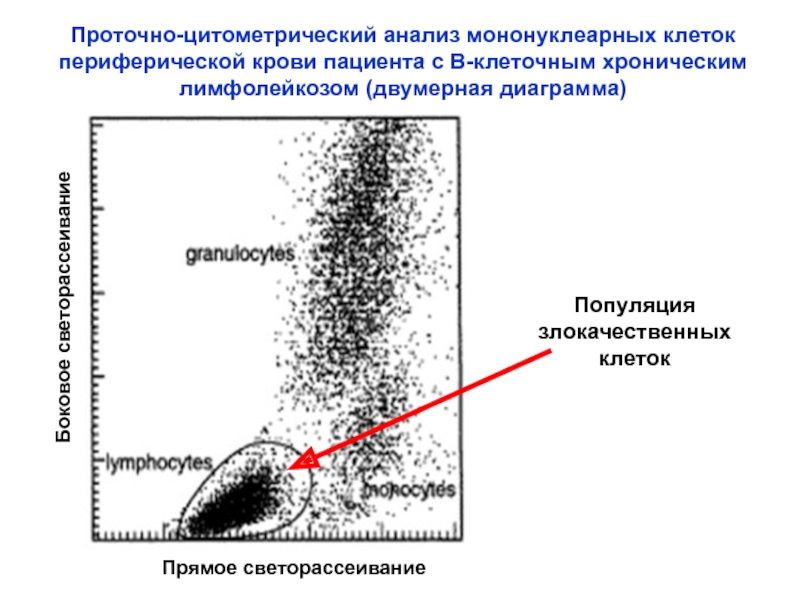
Слайд 21Проточно-цитометрический анализ мононуклеарных клеток периферической крови пациента с В-клеточным хроническим
лимфолейкозом (двумерная диаграмма)
Прямое светорассеивание
Боковое светорассеивание
Популяция
злокачественных
клеток
Слайд 223. Оптическая система для измерения интенсивности
как собственной флуоресценции
клеток, так и пос-
ле их предварительного окрашивания флуресцент-
ым(и) красителем(ями).
В настоящее время синтезированы флуоресцен-тные красители, которые имеют максимумы возбу-ждения в диапазое λ 400 - 650 нм. Их флуоресцен-ция (вторичный световой поток) имеет определен-ную длину волны. Часто изучаемые клетки окраши-вают сразу несколькими красителями. Как резуль-тат – флуоресценция (вторичный световой поток)
является полихромным. Оптический канал позво-
ляет выделить из общего потока флуоресценции все его составляющие (каждый из которых имеет определенную длину волны) и измерить их интен-сивность.
Слайд 23Одновременное измерение интенсивности флуорес-
ценции восьми различных флуоресцентных красителей,
которым были
обработаны изучаемые клетки
Полихромный
флуоресценцентный
световой поток
Прямое
светорассеяние
Слайд 24 Флуорохромы (флуоресцентные красители): флюо-ресцеинизотиоцинат (FITC, λфлуор.= 530
nm), тетраме-тил-родамин (TRITC), фикоэритрин (PE, λфлуор.= 585 nm), белок хлорофилла
– перидинхлорофилл протеин (PerCp, λфлуор. = 650 nm), алло-фикоцианин (АРС, λфлуор.= 661 nm), тандем цианин-5/фикоэритрин (Cy5/PE,
λфлуор.= 670 nm) и др.
Наиболее распространенным является использо-вание 2 - 4-х флуоресцентных меток (при наличии нескольких лазеров в приборе). Возбужденные лазерным лучом флюоресцентные красители, генери-руют вторичные световые потоки (имеющие различ-ные λ = различные цвета), что позволяет определять 2 или 3 антигена одновременно.
Флуоресцентные красители для обработки
клеток (иммунофлуоресцентное мечение)
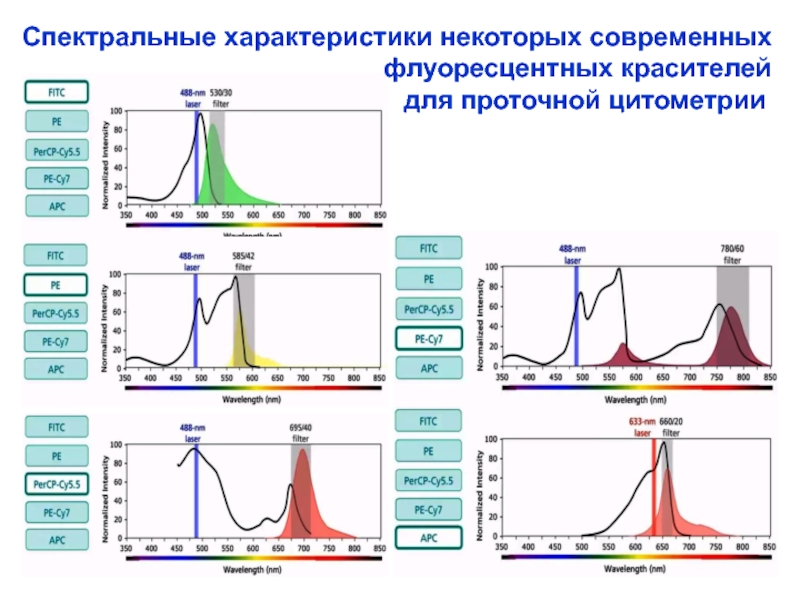
Слайд 25Спектральные характеристики некоторых современных
флуоресцентных красителей
для проточной цитометрии
Слайд 26Моноклональное
антитело (МКА),
конъюгирован-
ное с флуорес-
центным красите-
лем (флуоресцеин изотиоцианат, ФИТЦ ).
Клетки,
с экспрессией соответствующих
антигенов на поверхности, связывают
эти МКА и
начинают флуоресцировать.
Принцип выявления клеточных
маркёров с помощью меченых
флуорохромами моноклональ-
ных антител (МКА)
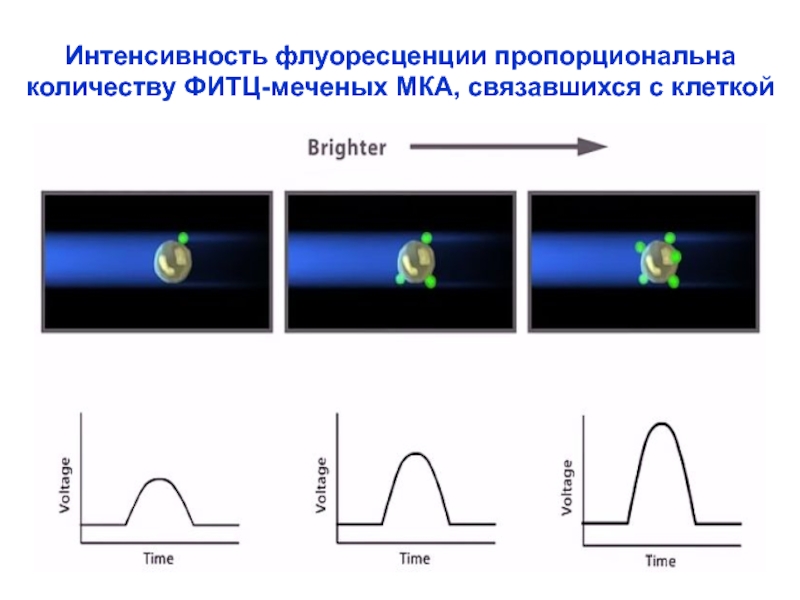
Слайд 27Интенсивность флуоресценции пропорциональна
количеству ФИТЦ-меченых МКА, связавшихся с клеткой
Слайд 28
Информация, получаемая на основе
анализа флуоресценции клеток
1. Измерение содержания
различных пигментов (хлорофилл);
2. Сортировка клеток по содержанию ДНК и
РНК, в том числе
изучение фаз клеточного цикла;
3. Определение количества копий ДНК в клетке;
4. Сортировка клеток по содержанию РНК;
5. Изучение структуры хромосом;
6. Изучение экспрессии белков и их локализацию;
7. Сортировка клеток по содержанию в них трансгеных продуктов
(белок зеленой флуоресценции – green fluorescenece protein)
и др.);
8. Изучение внутриклеточного содержания цитокинов или вторич-
ных мессенджеров;
9. Выявление клеток, имеющих поверхностные антигены;
10. Измерение ферментативной активности;
11. Определение жизнеспособности клеток;
12. Оценка «дыхательного взрыва» макрофагов;
13. Оценка устойчивости опухолевых клеток к хемиотерапевти-
ческим препаратам и др.
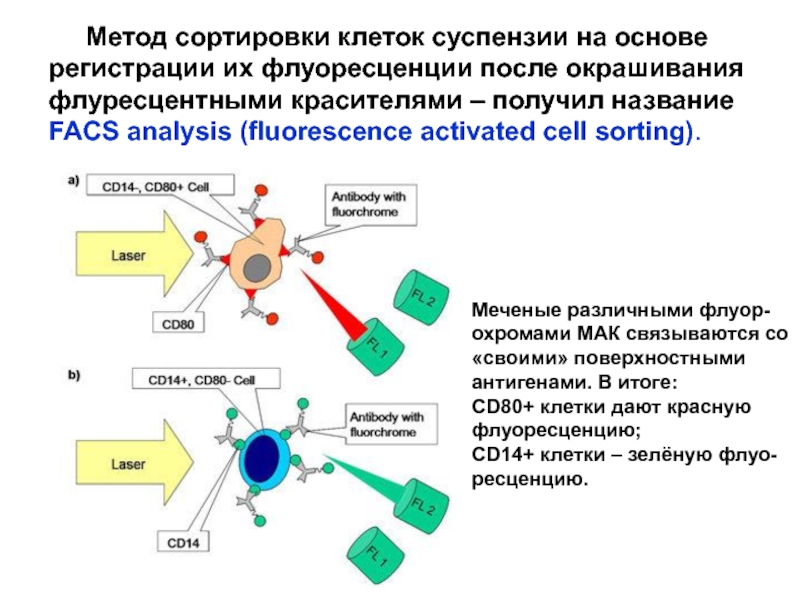
Слайд 29 Метод сортировки клеток суспензии на основе регистрации
их флуоресценции после окрашивания флуресцентными красителями – получил название
FACS analysis
(fluorescence activated cell sorting).
Меченые различными флуор-
охромами МАК связываются со
«своими» поверхностными
антигенами. В итоге:
CD80+ клетки дают красную
флуоресценцию;
CD14+ клетки – зелёную флуо-
ресценцию.
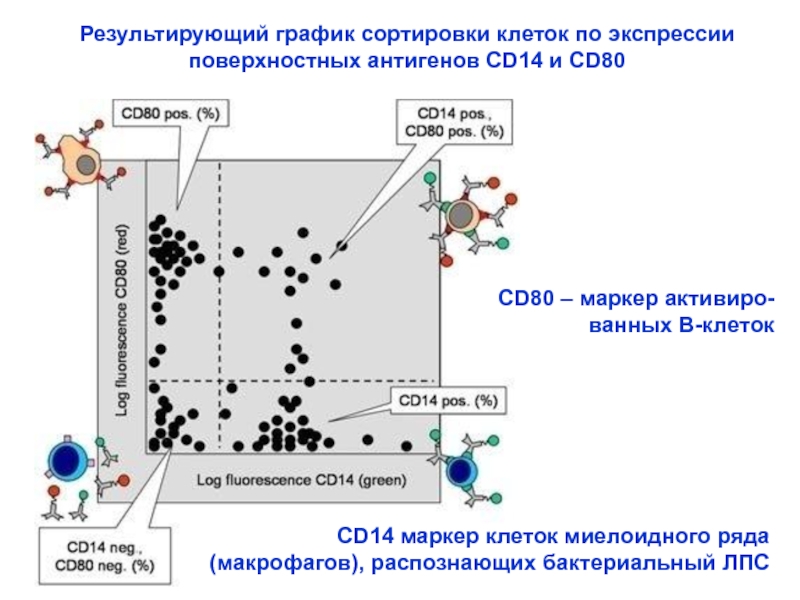
Слайд 30Результирующий график сортировки клеток по экспрессии поверхностных антигенов CD14 и
CD80
CD14 маркер клеток миелоидного ряда
(макрофагов), распознающих бактериальный ЛПС
СD80 –
маркер активиро-
ванных В-клеток
Слайд 31
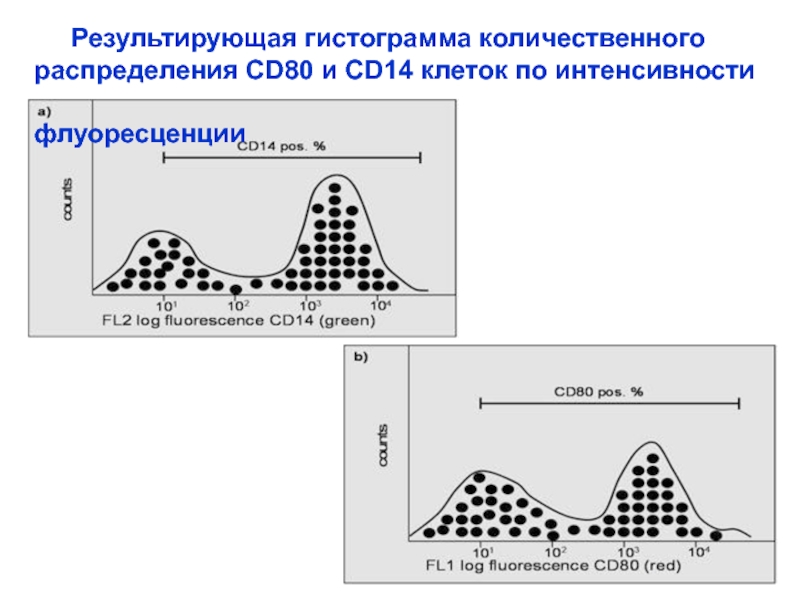
Результирующая гистограмма количественного
распределения CD80 и CD14
клеток по интенсивности
флуоресценции
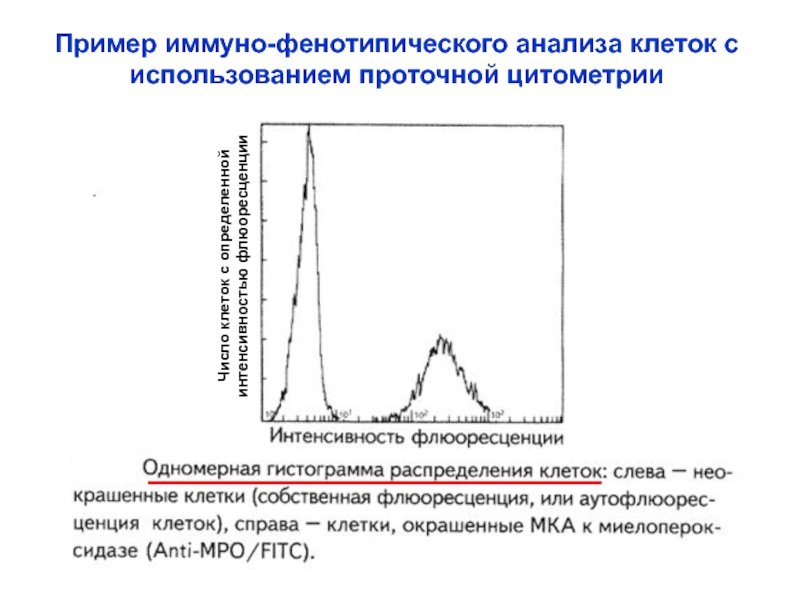
Слайд 32Пример иммуно-фенотипического анализа клеток с
использованием проточной цитометрии
Число клеток с
определенной
интенсивностью флюоресценции
Слайд 33Ядро
Выявление апоптоза клеток по изменениям структуры
плазматической мембраны методом проточной
цитометрии с применением ФИТЦ и PI
Аннексин V – белок с
высоким сродством к фосфатидилсерину.
Используют конъюгат Аннексин V-ФИТЦ.
Propidium Iodide (PI) – флуоресцентный краситель, связывающий-
ся с ДНК или её фрагментами.
Аннексин V-ФИТЦ
Фосфатидилсерин
(ФС)
Экстернализация ФС –
- сигнал для макрофагов:
«ешь меня»
Слайд 34Результат выявления проточной цитометрией
апоптозных клеток с использованием двух
флуорфоров
Живые
клетки
Апоптозные
клетки
Мёртвые
клетки
Суммарный % апоптозных
и мёртвых клеток
Слайд 35 Проточная цитометрия - ведущий метод в клиничес-кой иммунологии
и гематологии. Метод используют для решения следующих задач:
иммунофенотипирования лимфоцитов, включая
определение
количества CD4, CD8 клеток и даже ТН1 и ТН2 (по продукции
специфических цитокинов);
анализа процессов клеточной активации на основе определения
маркеров ранней активации: CD25 (рецептор интерлейкина-2),
CD38, CD69, CD71 (трансферриновый рецептор), CD95 (антиген
апоптоза), CD122, анти-HLA-DR;
определения маркеров пролиферативной активности клеток
иммунной системы (Ki-67, PCNA, Cyclin D3);
оценки внутриклеточной продукции цитокинов различными
клеточными популяциями;
иммунофенотипирования острых лейкозов и лимфом;
анализа клеточного цикла с определением распределения кле-
точной популяции по фазам цикла (ДНК-цитометрия);
анализа маркеров апоптоза (аннексина V, CD95 Fas/APO-1,
CD95L, Bcl-2, P53).
Слайд 36Области применения проточной цитометрии
Иммунология
Иммунофенотипирование клеток крови;
Определение фагоцитарной активности;
Определение внутриклеточных цитокинов и различ-
ных внутриклеточных белков (например транскрип-
ционных факторов);
Определение пролиферативной активности ;
Исследование клеточного цикла;
Оценка клеточной цитотоксичности;
Трансплантационный мониторинг.
Онкология
Количественный анализ
внутриклеточных компо-
нентов (ДНК);
Анализ стадий клеточного цикла;
Определение специфических маркеров;
Наблюдать пациентов, входящих в группу риска;
Слайд 37 Оценка состояния иммунной системы;
Оценка клеточного звена иммунитета (определение
субпопуляций лимфоцитов);
Оценка функциональной состоятельности иммуно-
компетентных клеток (NK тест,
фагоцитарный тест
и т. п.).
Цитология
Определение цитоморфологических характеристик
клетки: размер, соотношение ядро/цитоплазма,
степень асимметричности и гранулярности клеток;
Оценка активности внутриклеточных ферментов с
помощью флуорогенных субстратов;
Определение экспрессии поверхностных антиге-
нов;
Анализ стадий клеточного цикла;
Слайд 38 Измерение физиологических параметров клетки
(внутриклеточный pH, концентрация ионов
Ca2+,
потенциал клеточной мембраны).
Гематология
Анализ субпопуляционного состава клеток
крови;
Подсчет ретикулоцитов, анализ тромбоцитов по
специфическим маркерам;
Диагностика и дифференциальная диагностика
лимфопролиферативных заболеваний;
Диагностика острых лейкозов.
Клеточная биология, биохимия
Измерение экспрессии маркеров;
Измерение активности внутриклеточных фермен-
тов;
Определений стадий клеточного цикла при изуче-
нии механизмов действия БАВ на клеточном
уровне.
Слайд 39 Разнообразие вариантов использования проточной цитометрии на сегодняшний
день может быть ограничено только фантазией исследователя, а в диагностической
службе – аналитическими потребностями клиники.