Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы неэлектролитов
Содержание
- 1. Растворы неэлектролитов
- 2. Растворыгомогенные системы, состоящие из двух или более
- 3. Концентрация раствораМолярная концентрация (С) – число молей растворенного вещества в одном литре раствора.
- 4. Концентрация раствораМоляльная концентрация Сm – число молей
- 5. Растворениесложный физико-химический процесс.фазовый переходΔНф.п. > 0, ΔSф.п.
- 6. РастворимостьНенасыщенный раствор (самопроизвольный процесс растворения) ΔG <
- 7. Растворимость газов в газахГазовые смеси: закон Дальтона
- 8. Растворимость газов в жидкостяхПрирода веществаТемператураΔHр-рения < 0 => при Т ↑ растворимость понижается
- 9. Растворимость газов в жидкостяхДавлениеV уменьшается => при
- 10. Взаимная растворимость жидкостей1) неограниченная растворимость2) ограниченная растворимость3) нерастворимость
- 11. Растворимость твердых веществ в жидкостях ДавлениеΔV ≈ 0 => давление не влияетТемператураИзменение растворимости зависит от ΔH
- 12. Коллигативные свойства растворов– свойства, которые зависят только
- 13. Давление пара над растворомПервый закон Рауля: давление
- 14. Давление пара над растворомПервый закон Рауля: Относительное
- 15. Повышение температуры кипенияР-р, содержащий нелетучее вещество, обладает
- 16. Понижение температуры замерзанияТемпература замерзания раствора ниже, чем температура кипения чистого растворителя
- 17. Определение молярной массы вещества
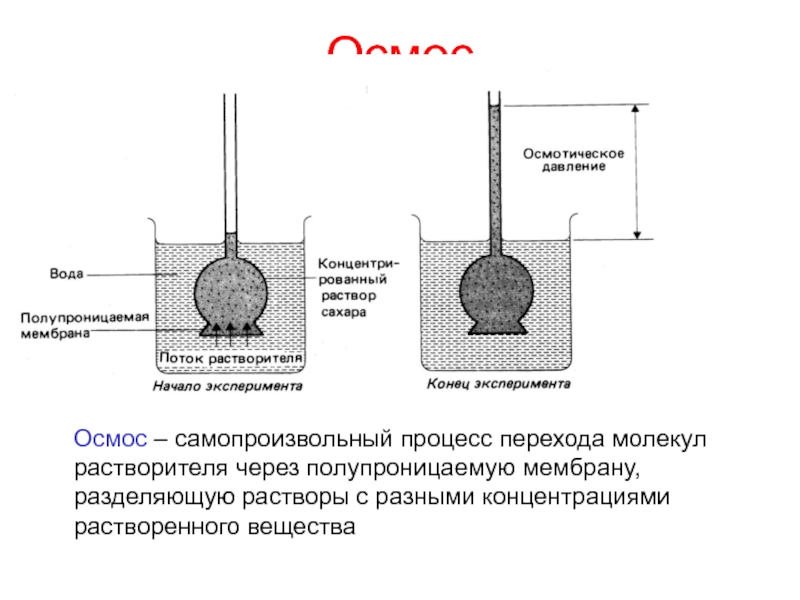
- 18. ОсмосОсмос – самопроизвольный процесс перехода молекул растворителя
- 19. Осмотическое давлениеЗакон Вант-Гоффа:Осмотическое давление (π) равно силе,
- 20. Растворыгипотонический πраствора < πраствора клеткиизотонический πраствора =
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Растворы
гомогенные системы, состоящие из двух или более компонентов, состав которых
можно изменять в некоторых пределах без нарушения однородности
+ растворенное веществоСлайд 3Концентрация раствора
Молярная концентрация (С) – число молей растворенного вещества в
одном литре раствора.
Слайд 4Концентрация раствора
Моляльная концентрация Сm – число молей растворенного вещества в
одном килограмме растворителя.
Процентная концентрация ω – число граммов растворенного вещества
в 100 граммах раствора. Слайд 5Растворение
сложный физико-химический процесс.
фазовый переход
ΔНф.п. > 0, ΔSф.п. > 0
сольватация
ΔHсольв.
0, ΔSсольв. < 0
ΔH = ΔHф.п. + ΔHсольв.
ΔS = ΔSф.п.
+ ΔSсольв.Объемные эффекты растворения:
1л С2Н5ОН + 1л Н2О = 1,93 л (25 ºС)
Растворение – самопроизвольный процесс (ΔG < 0)
Слайд 6Растворимость
Ненасыщенный раствор (самопроизвольный процесс растворения) ΔG < 0
Насыщенный раствор (равновесие)
ΔG = 0
Пересыщенный раствор (кажущееся равновесие) ΔG > 0
Растворимость –
концентрация вещества в насыщенном растворе Растворимость зависит от:
природы вещества ("подобное в подобном")
внешних условий (Т, р)
Слайд 8Растворимость газов в жидкостях
Природа вещества
Температура
ΔHр-рения < 0 => при Т
↑ растворимость понижается
Слайд 9Растворимость газов в жидкостях
Давление
V уменьшается => при р↑ растворимость увеличивается
Закон
Генри
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью
Слайд 10Взаимная растворимость жидкостей
1) неограниченная растворимость
2) ограниченная растворимость
3) нерастворимость
Слайд 11Растворимость твердых веществ в жидкостях
Давление
ΔV ≈ 0 => давление
не влияет
Температура
Изменение растворимости зависит от ΔH
Слайд 12Коллигативные свойства растворов
– свойства, которые зависят только от концентрации растворенного
вещества, от природы вещества не зависят.
Идеальные растворы – разбавленные растворы,
при образовании которых тепловой и объемный эффекты равны нулю (приближение – растворы неэлектролитов)Слайд 13Давление пара над раствором
Первый закон Рауля: давление насыщенного пара растворителя
над раствором равно произведению его давления над чистым растворителем на
мольную долю растворителя1– растворитель; 2 – нелетучее вещество