Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы ВМС
Содержание
- 1. Растворы ВМС
- 2. Высокомолекулярные соединения…… вещества, молекулярная масса которых, по
- 3. Сходства и различия растворов ВМС и коллоидных растворов
- 4. Растворы ВМС …… лиофильные коллоидные системы, термодинамически
- 5. Строение (структура) ВМСлинейнаяразветвлённаяпространственнаяСпецифические свойства ВМС обусловлены их
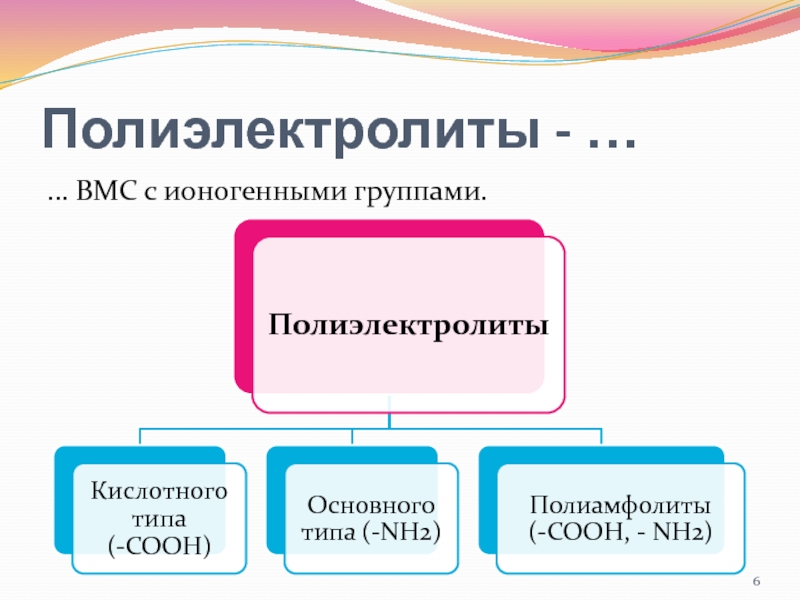
- 6. Полиэлектролиты - …… ВМС с ионогенными группами.
- 7. В растворе полиамфолита устанавливается равновесиеЗаряд белка зависит
- 8. Особенности растворения ВМСВзаимодействие ВМС с водой начинается
- 9. Ограниченное набуханиеСопровождается образованием студня. Студень – пространственная
- 10. Неограниченное набуханиеВедёт к растворению ВМС.
- 11. Количественная оценка набуханияСтепень набуханиягде m0, V0 –
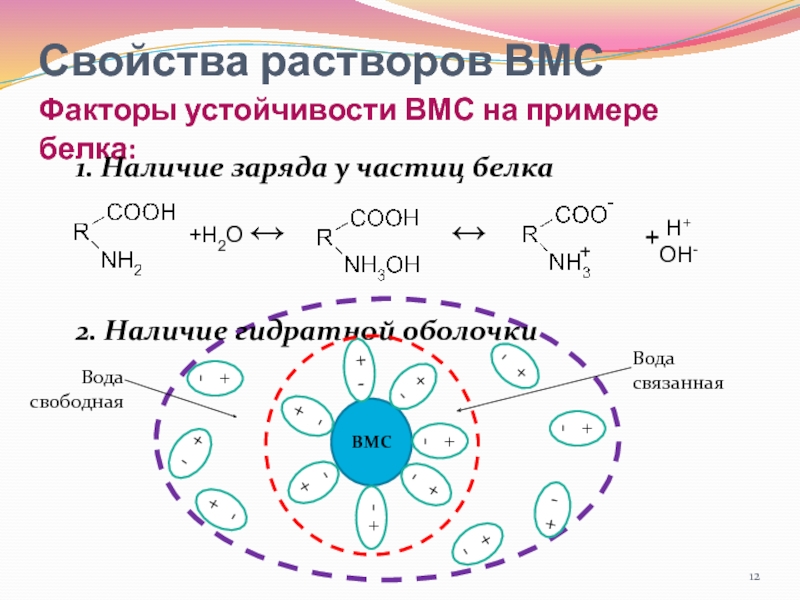
- 12. Свойства растворов ВМС Факторы устойчивости ВМС на
- 13. Пути коагуляции растворов ВМСК коагуляции растворов приводит:одновременная
- 14. Коацервация…… расслаивание концентрированного раствора ВМС при действии
- 15. Высаливание……нарушение устойчивости растворов ВМС при действии неорганических
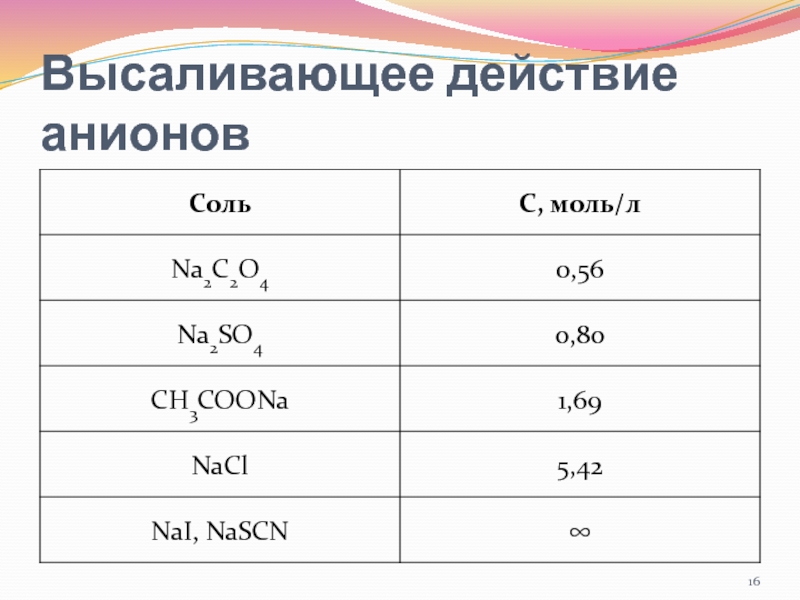
- 16. Высаливающее действие анионов
- 17. Ряды ГофмейстераC2O42- > SO42- > CH3COO- >
- 18. Застудневание растворов ВМС - …… переход растворов
- 19. Основу студня составляет пространственная сетка из цепей
- 20. Старение студней…Синерезис – уплотнение пространственной сетки студня
- 21. Вязкость растворов ВМС (η) …… внутреннее трение
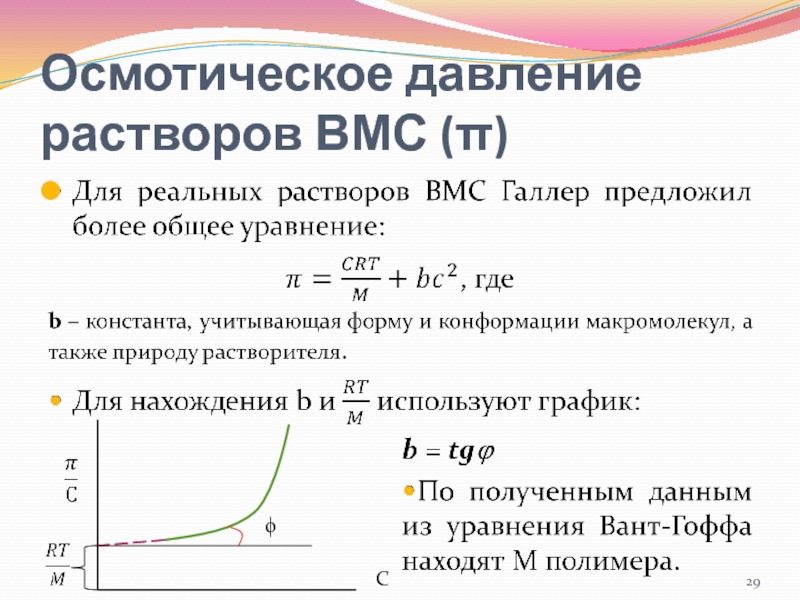
- 22. Уравнение Эйнштейнаη=η0(1+αϕ)η - вязкость раствораη0 – вязкость
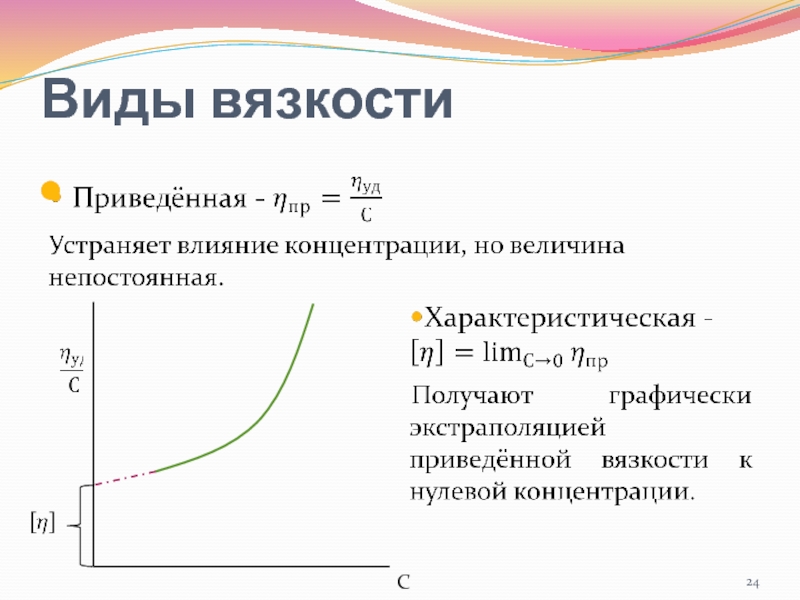
- 23. Виды вязкости
- 24. Виды вязкости С
- 25. Модифицированное уравнение Штаудингера
- 26. Вязкость крови…… очень важный показатель крови, определяющий
- 27. Вязкость кровиВ норме для плазмы крови и
- 28. Осмотическое давление растворов ВМС (π)…
- 29. Осмотическое давление растворов ВМС (π) ϕC
- 30. Онкотическое давление(πонк) ……часть осмотического давления крови, обусловленная
- 31. Понижение πонк, вызванное гипопротеинемией, ведёт к развитию
- 32. Мембранное равновесие ДоннанаОписывает распределение электролитов по обе
- 33. Анализ уравнения ДоннанаВозможны 3 варианта распределения ионов:1)
- 34. Причина мембранного равновесияизбирательная проницаемость клеточных мембран, из-за
- 35. Спасибо за внимание!
- 36. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Свойства растворов ВМС: особенности растворения, реологические свойства, осмос. Устойчивость растворов
ВМС.
Слайд 2Высокомолекулярные соединения…
… вещества, молекулярная масса которых, по данным одних авторов
составляет от 104 до 106 Д, по данным других, от
103 до 1010 Д.К числу природных ВМС, играющих важную роль в жизнедеятельности человека, следует отнести белки, НК, полисахариды.
Слайд 4Растворы ВМС …
… лиофильные коллоидные системы, термодинамически устойчивые и обратимые;
…
молекулярнодисперсные системы, в которых взвешенными частицами являются не мицеллы с
их ядерным строением, а молекулы гигантских размеров.Слайд 5Строение (структура) ВМС
линейная
разветвлённая
пространственная
Специфические свойства ВМС обусловлены их способностью принимать различные
конформации (глобулы, клубки или растянутые формы).
Конформации – энергетически неравноценные формы
макромолекул, возникающие при простом повороте звеньев без разрыва химической связи.Слайд 7В растворе полиамфолита устанавливается равновесие
Заряд белка зависит от:
количества и
способности к диссоциации его –СООН и
, -NH2 групп,рН среды.
ИЭТ – значение рН, при котором белок не заряжен за счёт равного числа кислотных и основных групп. В ИЭТ белок имеет вид: NH3+ - R – COO--
ОН-
Н+
Слайд 8Особенности растворения ВМС
Взаимодействие ВМС с водой начинается с процесса набухания.
Набухание
– самопроизвольный процесс поглощения ВМС низкомолекулярной жидкости, сопровождающийся увеличением массы
и объёма.Причина набухания – различия в размерах и подвижности молекул: молекулы ВМС велики и малоподвижны, молекулы НМС малы и очень подвижны.
Различают 2 вида набухания: ограниченное и неограниченное.
Слайд 9Ограниченное набухание
Сопровождается образованием студня.
Студень – пространственная сетка из цепей
макромолекул, заполненная НМС. Оно характерно для ВМС, отдельные цепи которых
связаны так называемыми «мостичными» связями (типа водородной, бисульфидной и др.).
Слайд 11Количественная оценка набухания
Степень набухания
где m0, V0 – масса и объём
ВМС до набухания.
m, V – масса и объём после набухания.
Факторы,
влияющие на набухание:Температура
Электролиты
рН
Обращённый ряд Гофмейстера
SCN->I- >NO3- >Cl- >CH3COO- >SO42- >C2O42-
Слайд 12
Свойства растворов ВМС
Факторы устойчивости ВМС на примере белка:
1. Наличие заряда
у частиц белка
2. Наличие гидратной оболочки
+Н2О ↔
↔
-
+
Н+
ОН-
+
ВМС
+ -
+ -
+
-+-
+ -
+ -
+ -
+ -
+ -
- +
- +
+ -
+ -
+ -
Вода связанная
Вода свободная
Слайд 13Пути коагуляции растворов ВМС
К коагуляции растворов приводит:
одновременная нейтрализация заряда частицы
ВМС и полное разрушение всей гидратной оболочки.
Электролитом нейтрализовать заряд и
добавить дегидратирующее вещество (спирт, ацетон, танин и др.).В начале провести дегидратацию, а затем нейтрализовать заряд частицы ВМС.
Данные схемы предложены учёным Кройтом.
Слайд 14Коацервация…
… расслаивание концентрированного раствора ВМС при действии дегидратирующих веществ на
2 фазы, одна из которых обогащена ВМС.
Причина: слияние свободной воды
у частиц ВМС; связанная вода не затрагивается. Считать коагуляцией коацервацию нельзя, т.к. у частицы сохранилась часть гидратной оболочки.Слайд 15Высаливание…
…нарушение устойчивости растворов ВМС при действии неорганических солей.
Высаливающее действие соли
заключается в её собственной гидратации за счёт дегидратации коллоидных частичек
ВМС и понижения их растворимости. Для фракционирования белков чаще используют раствор (NH4)2SO4.Слайд 17Ряды Гофмейстера
C2O42- > SO42- > CH3COO- > Cl- > NO3-
> I- > SCN-
высаливающее действие повышают устойчивость
коллоидов ВМСБольшое влияние на процесс высаливания оказывает длина макромолекулы и молекулярная масса ВМС: чем они больше, тем легче идёт высаливание. На этом принципе основано фракционное высаливание, сущность которого заключается в том, что добавляя к растворам ВМС возрастающие концентрации соли можно выделить отдельные фракции белков.
Слайд 18Застудневание растворов ВМС - …
… переход растворов к нетекучей, эластичной
форме.
Образование студня может быть вызвано двумя способами:
р-р ВМС
твёрдый ВМС
СТУДЕНЬ
Слайд 19Основу студня составляет пространственная сетка из цепей полимера, заполненная молекулами
НМС.
Студни со слабыми связями (водородными или дипольными) между цепями полимера
имеют малую прочность и подвергаются тиксотропии – обратимому разрушению при механическом воздействии.Студни с сильными связями (химическими) достаточно прочные.
Слайд 20Старение студней…
Синерезис – уплотнение пространственной сетки студня за счёт выдавливания
части НМС; гель при этом уменьшается в объёме, но сохраняет
исходную форму.Синерезис в живых тканях указывает на старение организма: потеря воды приводит к утоньшению костей, сухости кожи, уменьшению эластичности тканей.
Слайд 21Вязкость растворов ВМС (η) …
… внутреннее трение между слоями ВМС,
движущимися относительно друг друга.
Величина вязкости определяется силами молекулярного притяжения, поэтому
↑
в растворах полярных веществ;↑ в растворах с размерами частиц, превышающими размеры частиц растворителя;
на величину вязкости оказывает влияние форма частиц (?, ಟ, ಯ, Ο и др);
↑ с увеличением молекулярной массы растворённого вещества;
↑ с увеличением концентрации частиц вещества.
Слайд 22Уравнение Эйнштейна
η=η0(1+αϕ)
η - вязкость раствора
η0 – вязкость растворителя
α – коэффициент,
зависящий от формы частиц
ϕ - объёмная доля частиц
Недостаток: не учитывает
наличие различных слоёв у частиц (сольватных, адсорбционных, электрических), создающих дополнительные вязкостные эффекты.14.III 1879 — 18.IV 1955
Эйнштейн Альберт
Слайд 26Вязкость крови…
… очень важный показатель крови, определяющий максимальный срок службы
сердца и сосудов. Чем выше вязкость крови, тем быстрее изнашивается
сердце.Что дает Вам анализ крови на вязкость? Ответ очень прост. Проснетесь Вы завтра или нет. Вязкость крови изменяется в очень широких пределах. При этом на состояние крови влияет очень много факторов. Критическое увеличение вязкости крови ставит всю сердечно-сосудистую систему и ее хозяина на грань выживаемости. Т.е. увеличение вязкости крови повышает кардиологический риск либо риск внезапной сердечной смерти.
Слайд 27Вязкость крови
В норме для плазмы крови и лимфы η=1,4∙10-3Па∙С (t=37°С).
↑
концентрации форменных элементов и белков ↑η.
На η влияет и состояние
мембран эритроцитов (до 45% объёма крови): в норме высокая эластичность, потеря или снижение которой ведёт к ↑η крови.Слайд 30Онкотическое давление(πонк) …
…часть осмотического давления крови, обусловленная наличием белков и
их отдельных сегментов коллоидного размера.
В норме ~ 3,1 кПа.
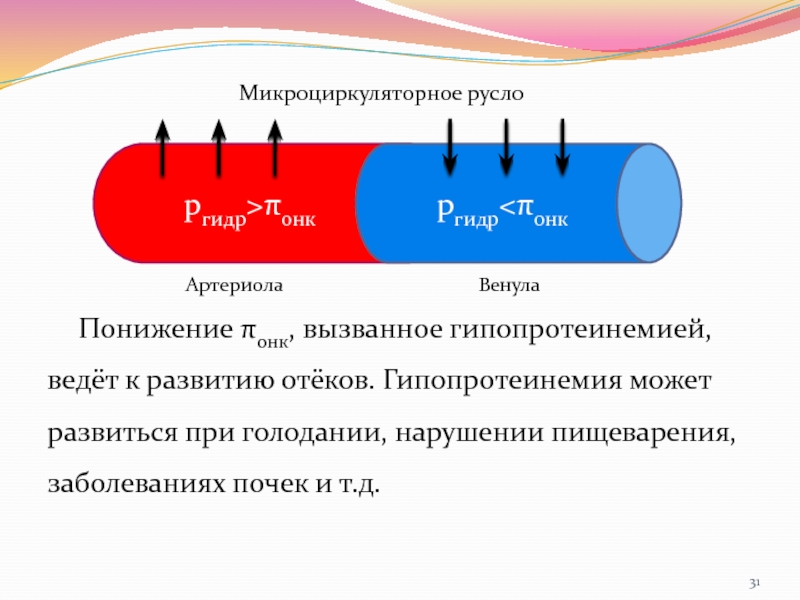
Отклонение этой величины от нормы приводит к серьёзным нарушениям функционирования организма.Причина: на кровь в капилляре действуют гидростатическое давление (ргидр.) ~ 4,5 кПа и онкотическое давление. Стенка капилляра представляет собой мембрану, непроницаемую для белка, но проницаемую для воды и безбелковой части плазмы.
ргидр способствут выдавливанию воды и безбелковой части плазмы в межклеточную жидкость. πонк способствует всасыванию воды из ткани в капилляр.
Слайд 31Понижение πонк, вызванное гипопротеинемией, ведёт к развитию отёков. Гипопротеинемия может
развиться при голодании, нарушении пищеварения, заболеваниях почек и т.д.
ргидр>πонк
ргидр
Слайд 32Мембранное равновесие Доннана
Описывает распределение электролитов по обе стороны клеточной мембраны.
сout
– концентрация ионов в межклеточной жидкости;
сin – концентрация ионов внутри
клетки;х – количество ионов, перешедших в клетку из межклеточной жидкости.
Слайд 33Анализ уравнения Доннана
Возможны 3 варианта распределения ионов:
1) cout > cin
⇒
2) cin > cout ⇒ в клетку перейдёт малое число
ионов3) cin = cout ⇒
Вывод: концентрация ионов в клетке будет всегда выше, чем в межклеточной жидкости.