Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Раздел: Молекулярная биофизика Тема: Структура белка
Содержание
- 1. Раздел: Молекулярная биофизика Тема: Структура белка
- 2. Конформационная энергия полипептидаОбщее строение полипептидной цепи, характеризуется тремя углами:
- 3. Пептидная связь – ω - уголОднако, двойной
- 4. 1. Компланарность – все атомы, входящие в
- 5. Пространственная конфигурация полипептидной цепиТаким образом, пространственная конфигурация
- 6. Не все значения углов ψ и φ
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
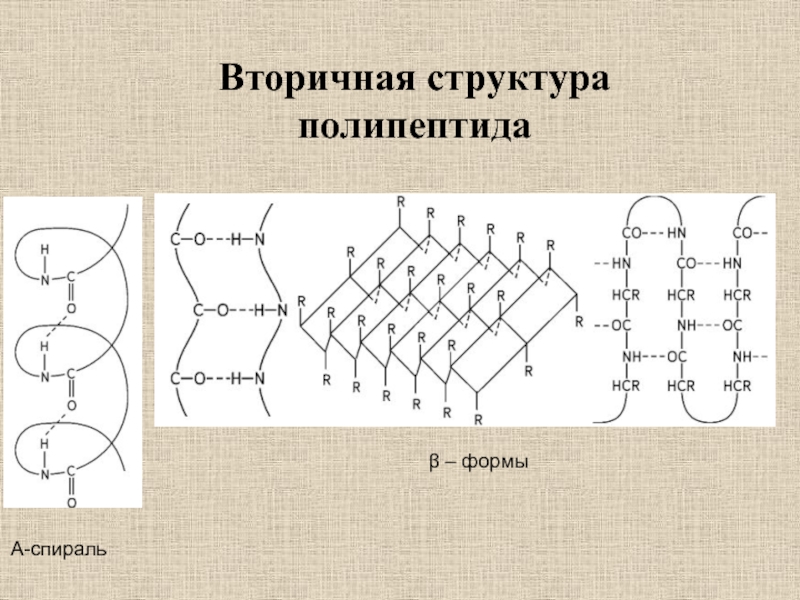
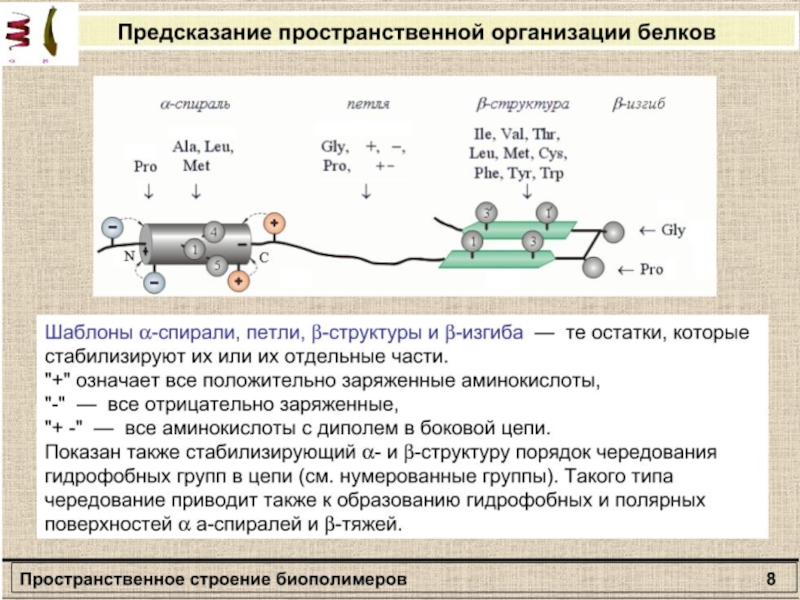
- 12. Вторичная структура полипептидаΑ-спиральβ – формы
- 13. Связи и взаимодействия, стабилизирующие пространстненную структуру белков:
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Раздел: Молекулярная биофизикаТема: Динамика биополимеров
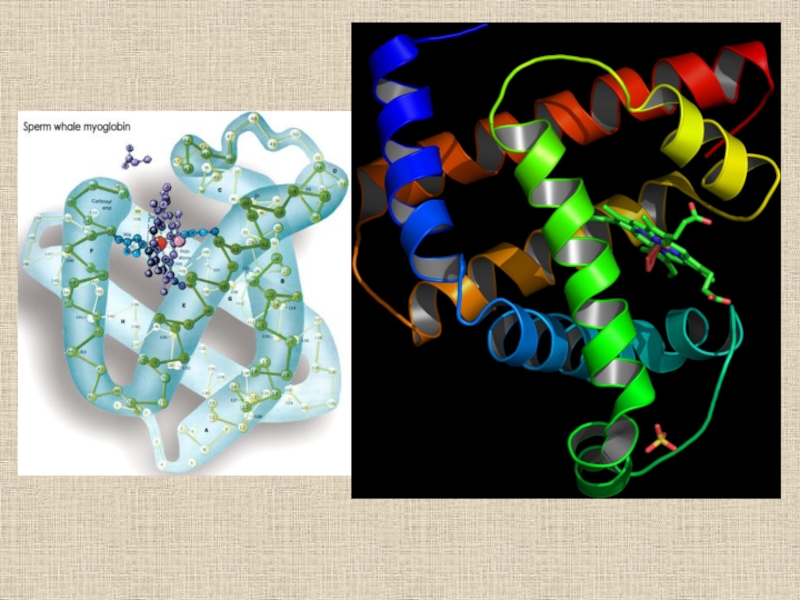
- 28. Пространственная структура миоглобина (кашалота) в проекции хуМиоглобин
- 29. Расщепление d-орбиталей в октаэдрическом комплексе (I): и
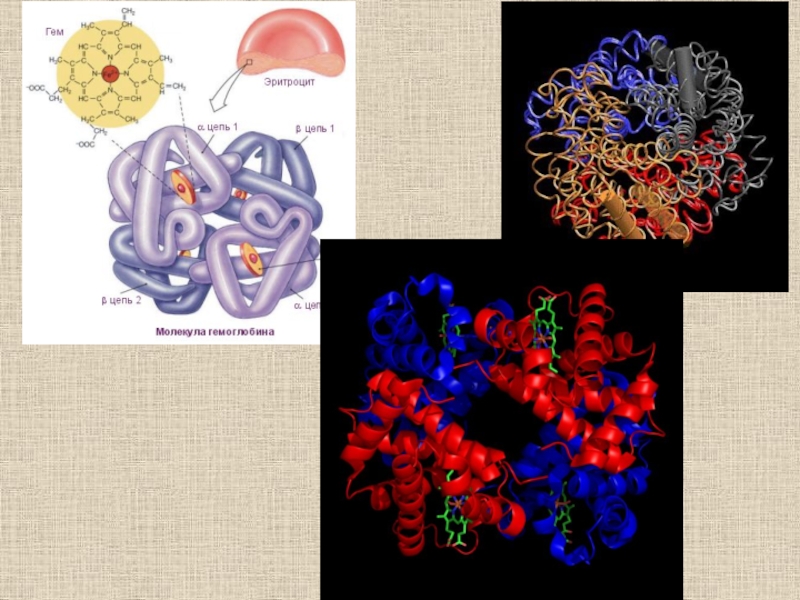
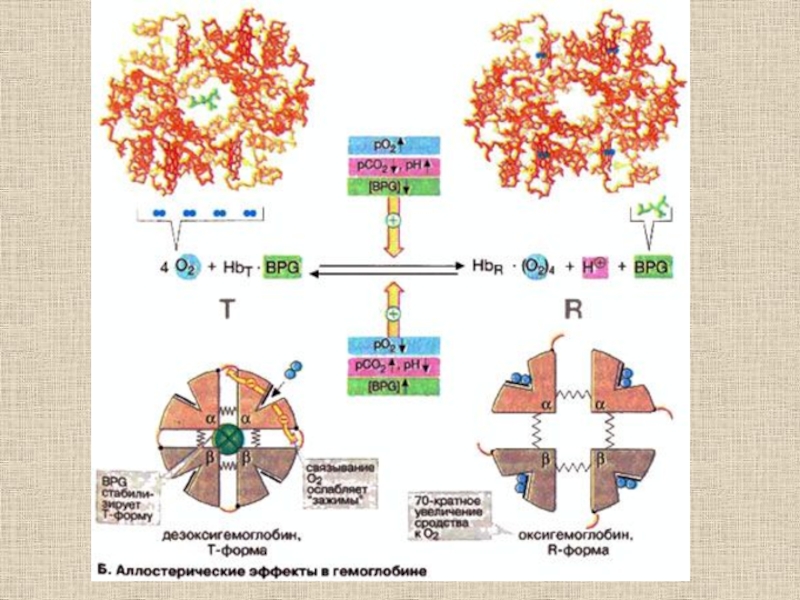
- 30. Структурные изменения, происходящие в гемоглобине при оксигенации (объяснение см. в тексте) (по Д. Мецлеру, 1980)
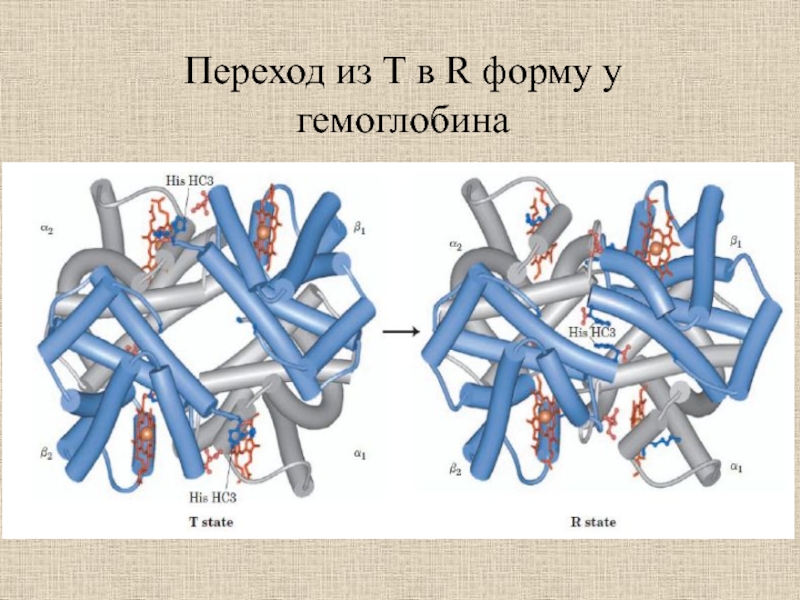
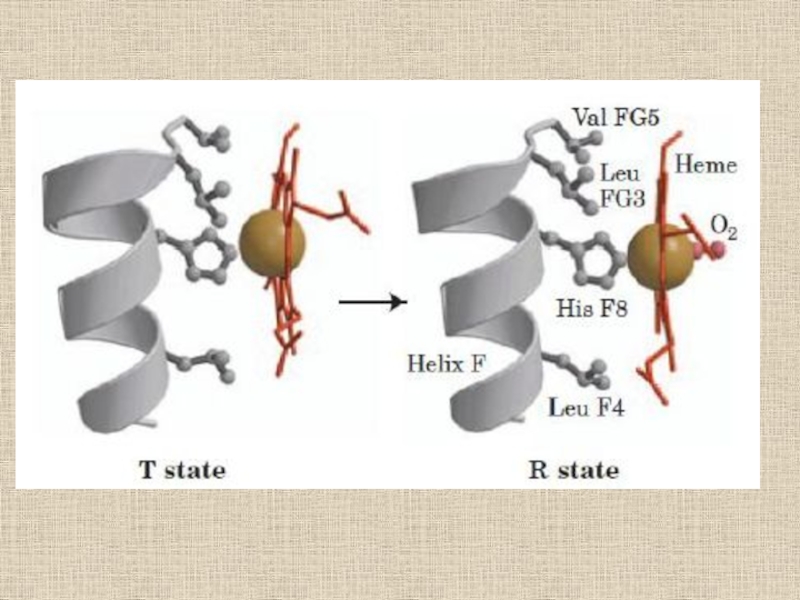
- 31. Переход из T в R форму у гемоглобина
- 32. Слайд 32
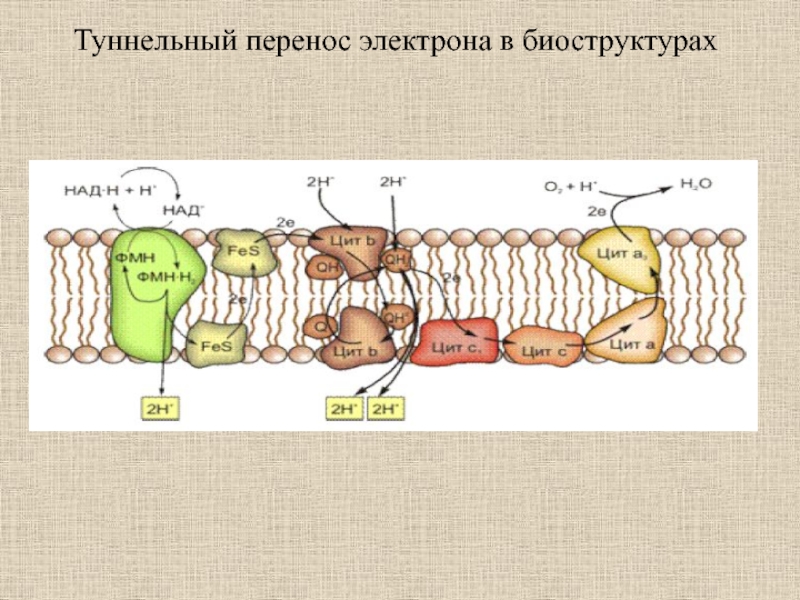
- 33. Туннельный перенос электрона в биоструктурах
- 34. Методы изучения подвижности белковЛюминесцентные методыЭПРЯМРЯГР спектроскопияМетод изотопного обмена
- 35. Кривые потенциальной энергии основного (So) и синглетного
- 36. Электронные уровни органической молекулы и переходы между
- 37. Люминесцентные методыИзмерение внутримолекулярной подвижности белка по зависимости
- 38. Зависимость положения спектра флуорисценции водного раствора (3-лактоглобулина
- 39. Методы радиоспектроскопии ЭПР и ЯМРРасщепление энергетических уровней электрона (протона) в магнитном поле (Н)
- 40. Энергетические уровни электрона в магнитном поле. А
- 41. Линия поглощения СВЧ- а) поля б) ее
- 42. Линия резонанса ЭПРШирина:Т1 – время передачи энергии
- 43. Схема парамагнитного фрагмента нитроксильного радикала
- 44. Спектр ЭПР парамагнитной метки, присоединенной к гис-15
- 45. ЯМР-спектроскопияИзмерение времени релаксации Т1 и Т2 по
- 46. Спектр ЯМР ацетальдегида СН3СНОСНО
- 47. ЯГР спектроскопияДает информацию не только о временных,
- 48. Эффект Мёссбауэра Уширение спектра обусловлено диффузией молекул белка. Изменение частоты уширения пропорционально скорости источника (v)
- 49. Слайд 49
- 50. Слайд 50
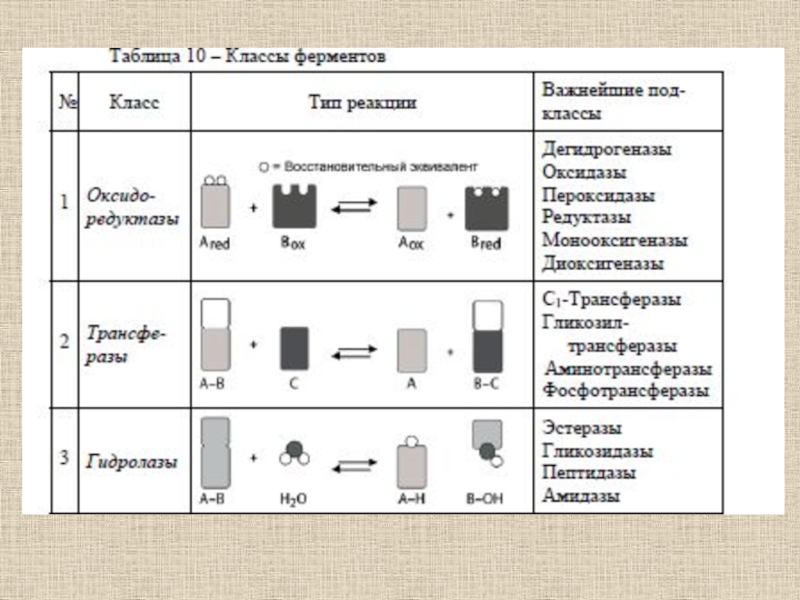
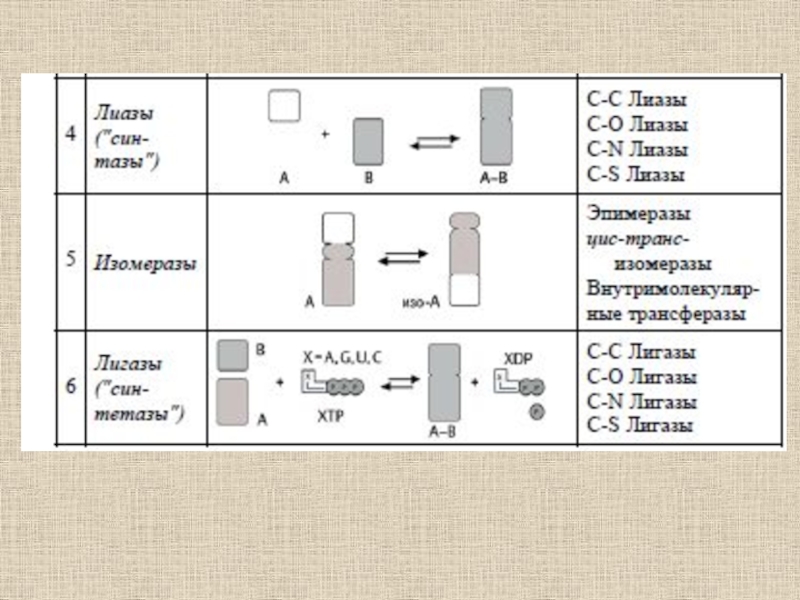
- 51. Ферментативный катализ
- 52. Ферменты (от латинского fermentum – закваска), энзимы
- 53. Ферменты отличаются от других катализаторов тремя уникальными свойствами:- высокой эффективностью действия,- специфичностью действия,- способностью к регуляции.
- 54. Слайд 54
- 55. Слайд 55
- 56. Слайд 56
- 57. Слайд 57
- 58. Слайд 58
- 59. Взаимодействия, которые играют главную роль при связывании
- 60. Слайд 60
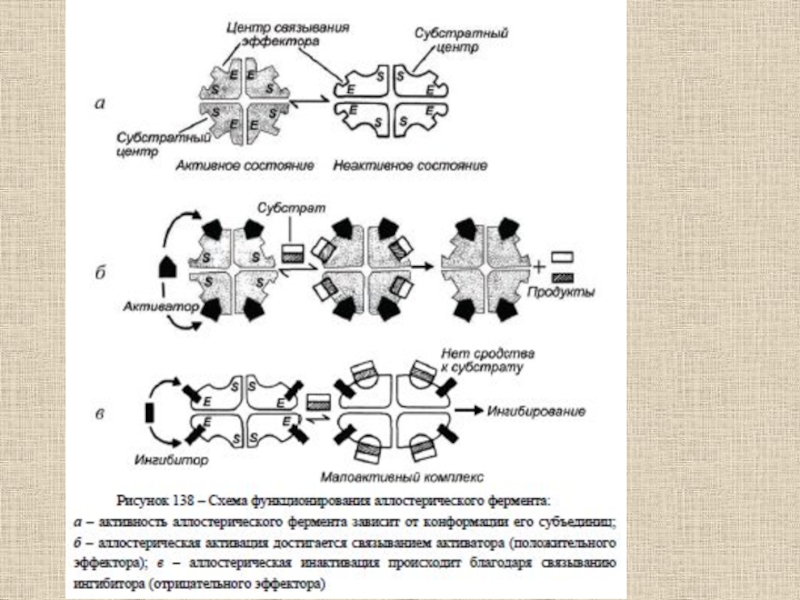
- 61. Основные механизмы управления каталитической активностью фермента связаны
- 62. Слайд 62
- 63. Слайд 63
- 64. Слайд 64
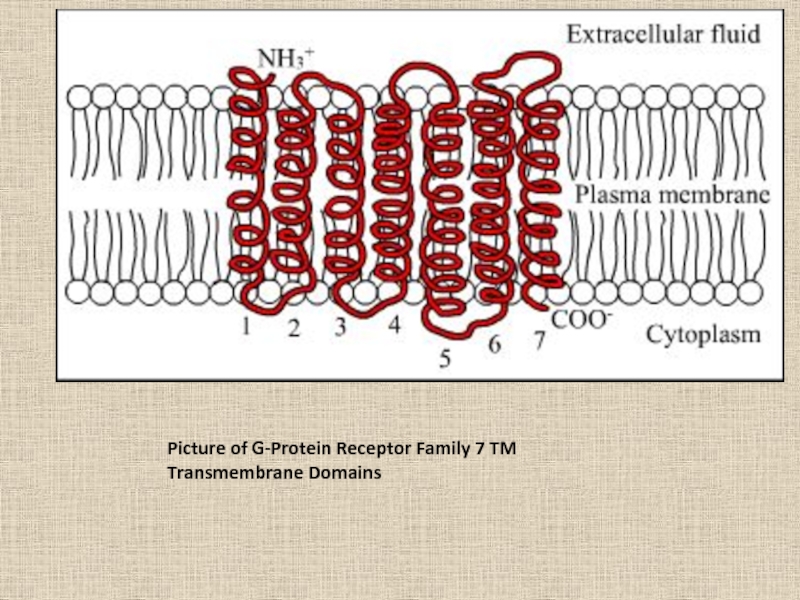
- 65. Picture of G-Protein Receptor Family 7 TM Transmembrane Domains
- 66. Слайд 66
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
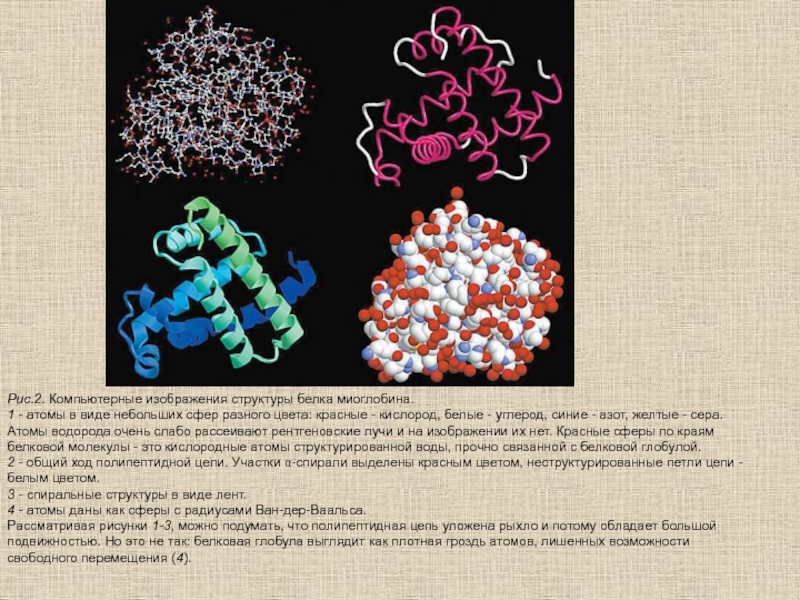
- 70. Рис.2. Компьютерные изображения структуры белка миоглобина.1 -
- 71. Скачать презентанцию
Слайды и текст этой презентации
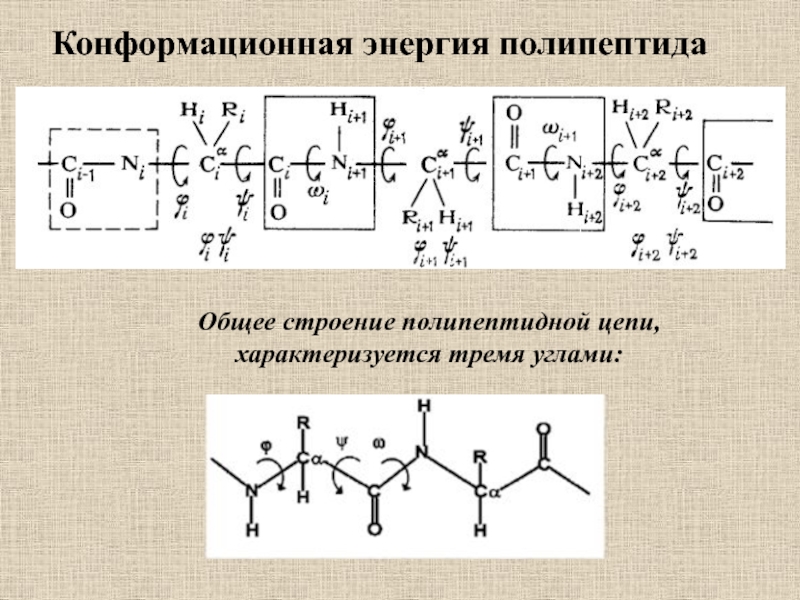
Слайд 2Конформационная энергия полипептида
Общее строение полипептидной цепи,
характеризуется тремя углами:
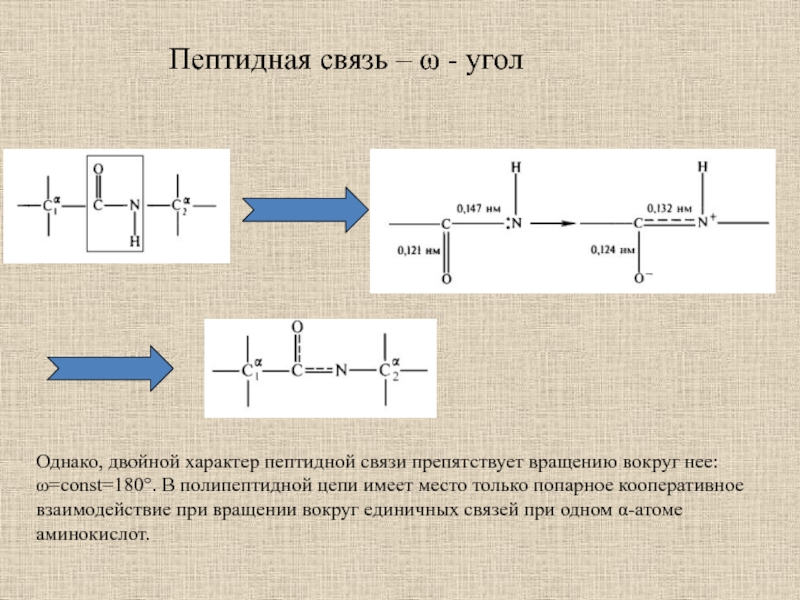
Слайд 4
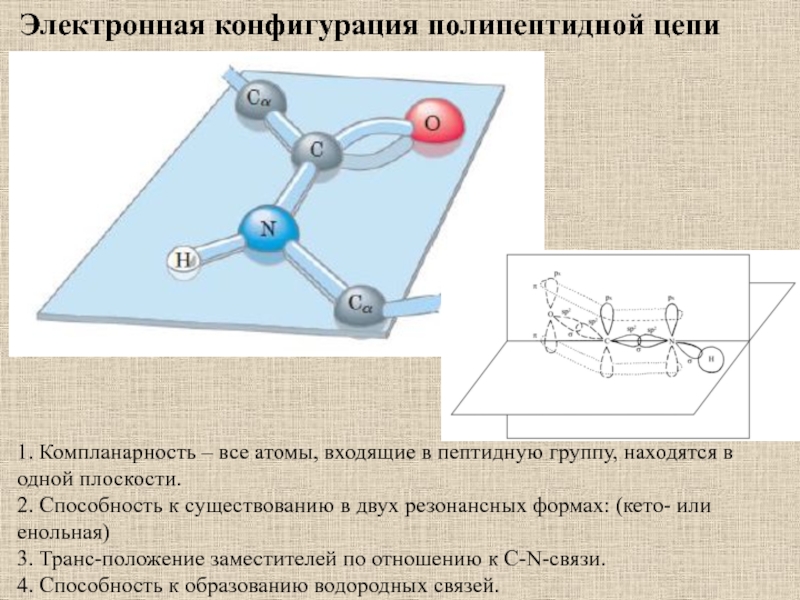
1. Компланарность – все атомы, входящие в пептидную группу, находятся
в одной плоскости.
2. Способность к существованию в двух резонансных
формах: (кето- или енольная) 3. Транс-положение заместителей по отношению к С-N-связи.
4. Способность к образованию водородных связей.
Электронная конфигурация полипептидной цепи
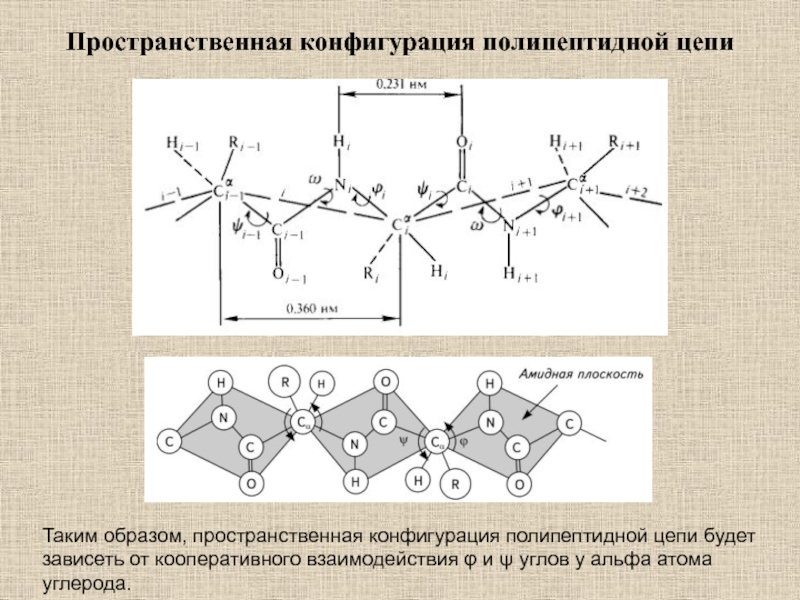
Слайд 5Пространственная конфигурация полипептидной цепи
Таким образом, пространственная конфигурация полипептидной цепи будет
зависеть от кооперативного взаимодействия φ и ψ углов у альфа
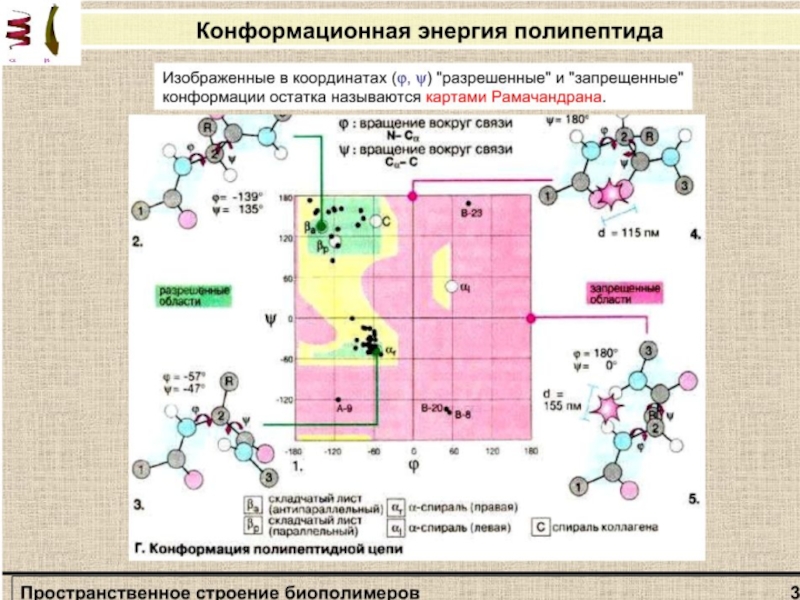
атома углерода.Слайд 6Не все значения углов ψ и φ допустимы вследствие возможного
стерического несоответствия двух соседних аминокислотных остатков. Индийский ученый Г. Рамачандран
рассчитал допустимые значения углов ψ и φ (углы отсчитываются от плоской транс-конформации полипептидной цени) и построил стерические карты, на которых но оси абсцисс откладываются значения углов φ от 0 до 360°, а по оси ординат - значения углов ψ. На карте отмечаются полностью разрешенные (при обычных межатомных расстояниях) и частично разрешенные (при минимальных межатомных расстояниях) области значений этих углов.Стерическая карта Рамачандрана для поли-L-аланина.
Сплошные линии обозначают границы полностью разрешенных областей; пунктирные - частично разрешенных. На карте указаны области значений углов ψ и φ для параллельной (βп„) и антипараллельной (βа) β-форм, спирали белка коллагена (К), правой (αR) и левой (αL) α -спиралей.
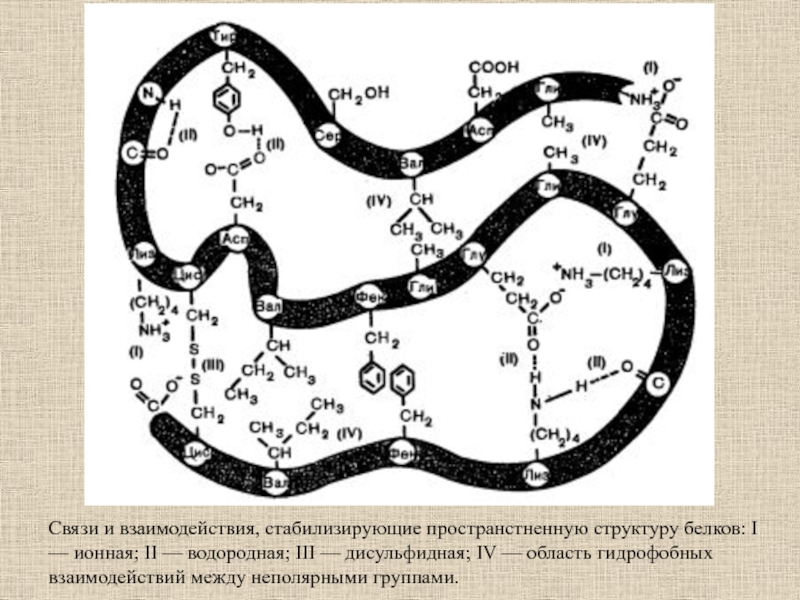
Слайд 13Связи и взаимодействия, стабилизирующие пространстненную структуру белков: I — ионная;
II — водородная; III — дисульфидная; IV — область гидрофобных
взаимодействий между неполярными группами.Слайд 28Пространственная структура миоглобина (кашалота) в проекции ху
Миоглобин (переносчик кислорода в
мышцах) содержит один гем и одну полипептидную цепь, включающую 153
остатка, которые распределены в основном по 8 а-спиральным участкам (А — Н). Гем, в центре которого расположен атом Fe, находится между спиралями Е и F.Слайд 29Расщепление d-орбиталей в октаэдрическом комплексе (I): и распределение d-электронов по
орбиталям высокоспинового (расщепление Δ мало) и низко спинового (расщепление Δ
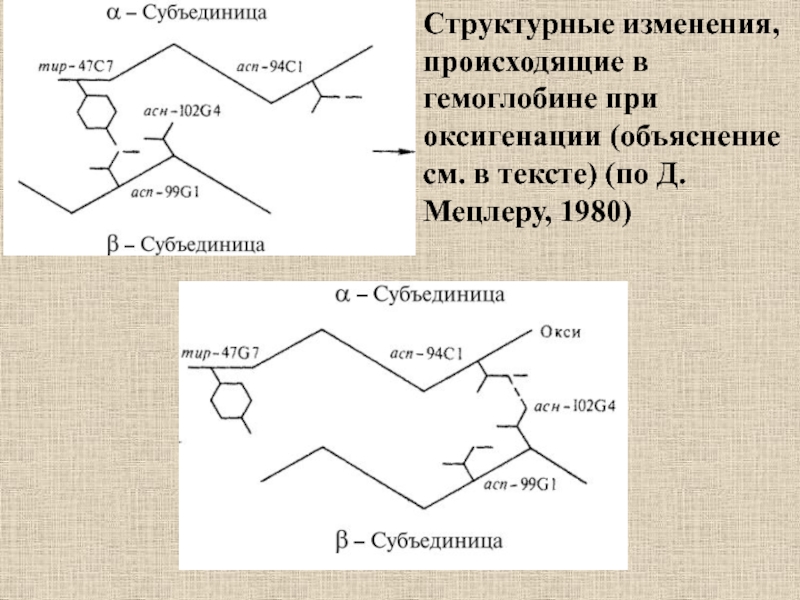
велико) состояний иона Fe2+ (II)Слайд 30Структурные изменения, происходящие в гемоглобине при оксигенации (объяснение см. в
тексте) (по Д. Мецлеру, 1980)
Слайд 34Методы изучения подвижности белков
Люминесцентные методы
ЭПР
ЯМР
ЯГР спектроскопия
Метод изотопного обмена
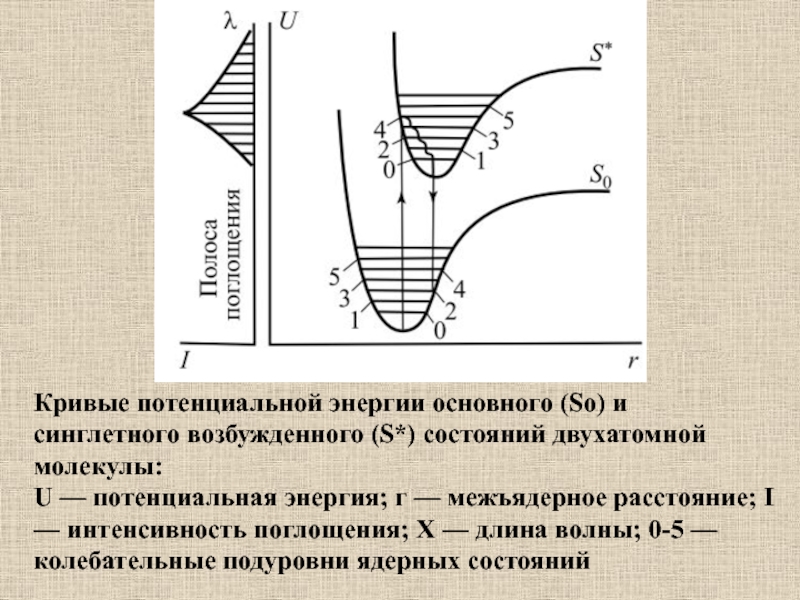
Слайд 35Кривые потенциальной энергии основного (So) и синглетного возбужденного (S*) состояний
двухатомной молекулы:
U — потенциальная энергия; г — межъядерное расстояние; I
— интенсивность поглощения; X — длина волны; 0-5 — колебательные подуровни ядерных состоянийСлайд 36Электронные уровни органической молекулы и переходы между ними (схема Яблонского):
р — вероятность переходов в единицу времени на основной уровень
с испусканием флуорисценции, qi—то же, без излучения; г — вероятность конверсии и триплетное состояние.Молекула обладает системой триплетных T1, Т2,... и синглетных возбужденных уровней S 1, S2,..., Sn. При переходе на один из высших возбужденных синглетных уровней избыток энергии быстро (10-12 с) диссипирует; молекула попадает на низший возбужденный синглетный уровень S1, с которого и происходит переход (S1 → S0) или внутримолекулярная конверсия (S1 → Т1). Суммарная вероятность (P) дезактивации определяется суммой величину, qi, r:
Р = р + qi + r
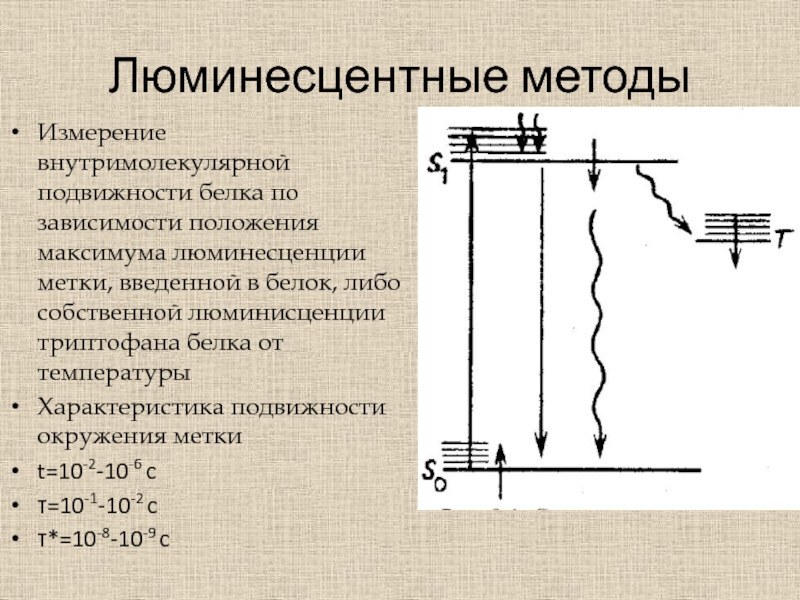
Слайд 37Люминесцентные методы
Измерение внутримолекулярной подвижности белка по зависимости положения максимума люминесценции
метки, введенной в белок, либо собственной люминисценции триптофана белка от
температурыХарактеристика подвижности окружения метки
t=10-2-10-6 c
=10-1-10-2 c
*=10-8-10-9 c
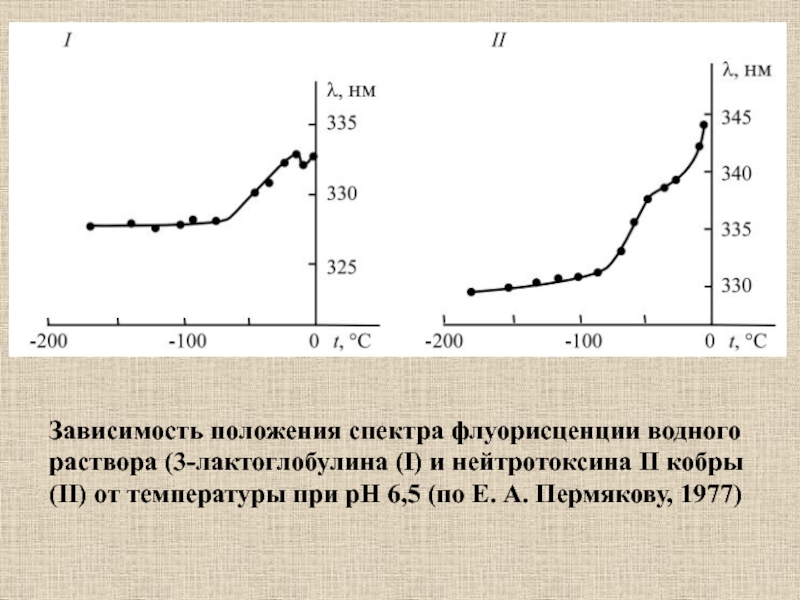
Слайд 38Зависимость положения спектра флуорисценции водного раствора (3-лактоглобулина (I) и нейтротоксина
II кобры (II) от температуры при рН 6,5 (по Е.
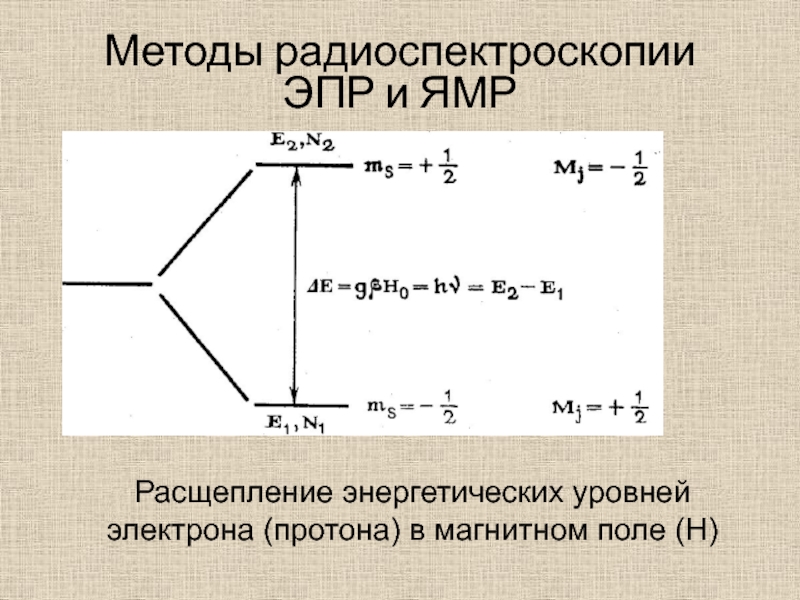
А. Пермякову, 1977)Слайд 39Методы радиоспектроскопии
ЭПР и ЯМР
Расщепление энергетических уровней электрона (протона) в магнитном
поле (Н)
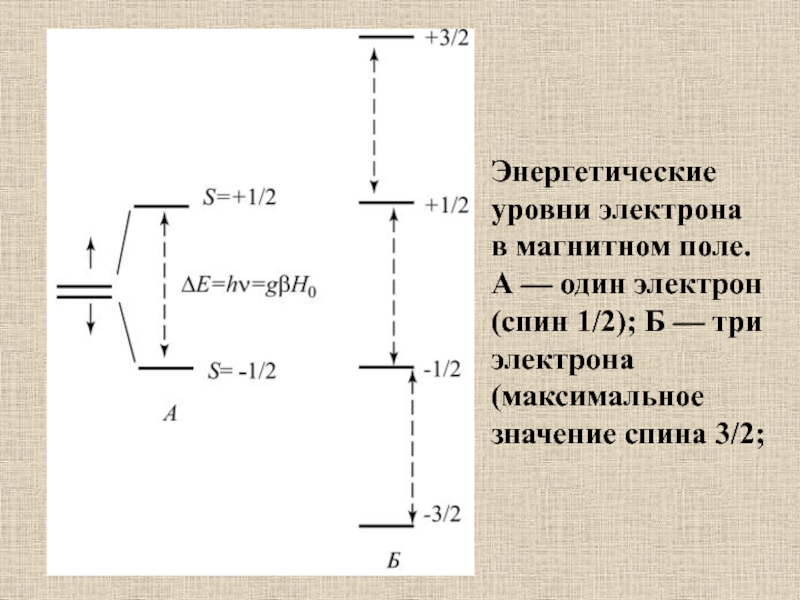
Слайд 40Энергетические уровни электрона в магнитном поле. А — один электрон
(спин 1/2); Б — три электрона (максимальное значение спина 3/2;
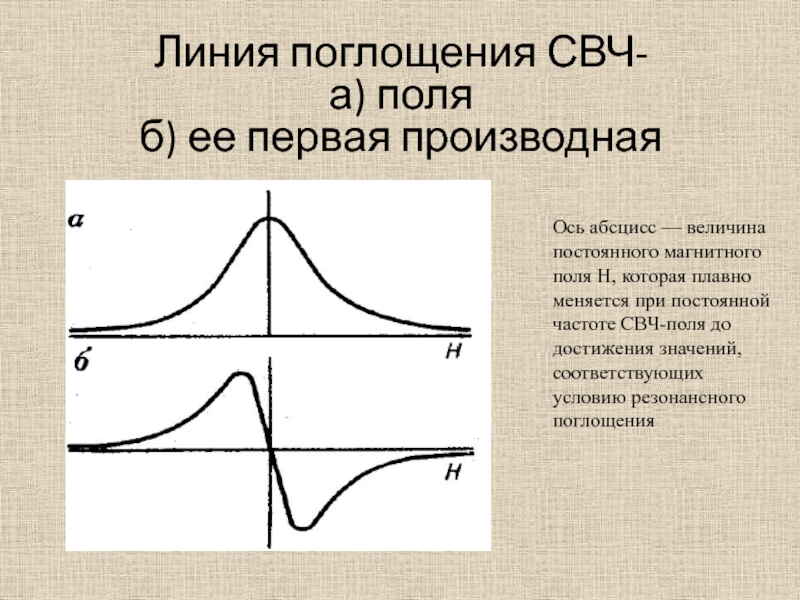
Слайд 41Линия поглощения СВЧ-
а) поля
б) ее первая производная
Ось абсцисс —
величина постоянного магнитного поля Н, которая плавно меняется при постоянной
частоте СВЧ-поля до достижения значений, соответствующих условию резонансного поглощенияСлайд 42Линия резонанса ЭПР
Ширина:
Т1 – время передачи энергии окружающей среде
Т2
– время спин-спинового взаимодействия
Для свободных радикалов: Т1 >> Т2
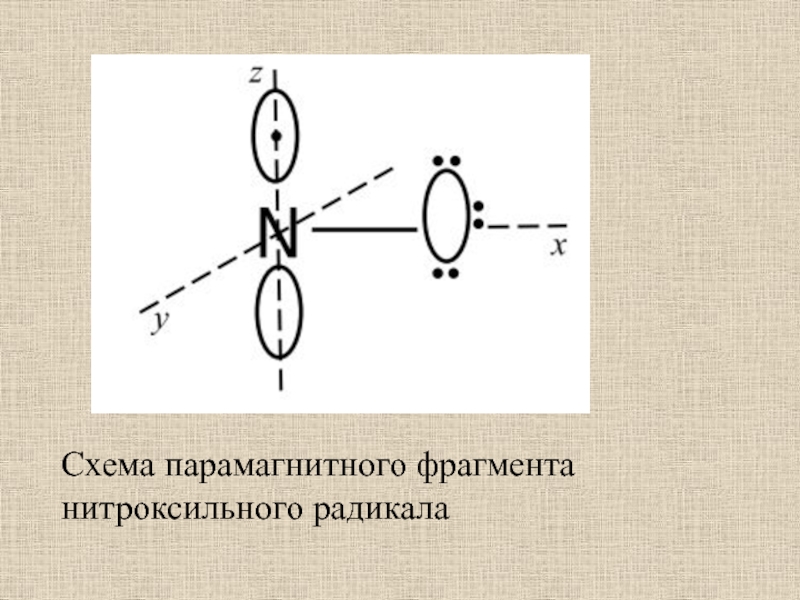
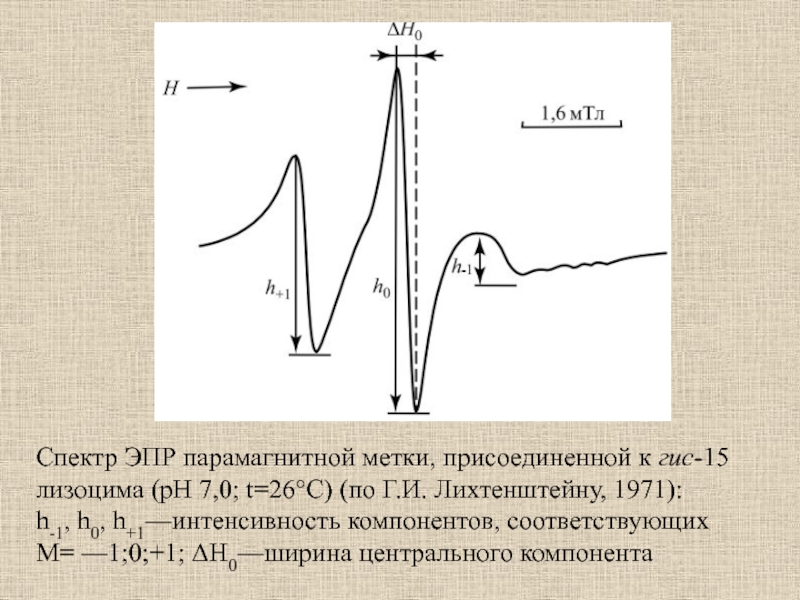
Слайд 44Спектр ЭПР парамагнитной метки, присоединенной к гис-15 лизоцима (рН 7,0;
t=26°C) (по Г.И. Лихтенштейну, 1971):
h-1, h0, h+1—интенсивность компонентов, соответствующих M=
—1;0;+1; ΔH0—ширина центрального компонентаСлайд 45ЯМР-спектроскопия
Измерение времени релаксации Т1 и Т2 по ширине линии резонанса.
Определение
времени вращения метки, на которой наблюдается резонанс
Оценка подвижности белковых структур
в состав которых входят «резонирующие» протоныИзучение некоторых видов внутримолекулярного движения в белках
Информация о химической структуре молекулы
Слайд 46Спектр ЯМР ацетальдегида СН3СНО
СНО химический сдвиг
СН3
по А.Керрингтону, Э. Мак-Лечлану, 1970
Слайд 47ЯГР спектроскопия
Дает информацию не только о временных, а также амплитудных
характеристиках движений в белке (средние величины смещений атомов в структуре
белка заt=10-7-10-9 c)
Основан на резонансном поглощении -квантов тяжелым ядром атома
Эффект Мёссбауэра
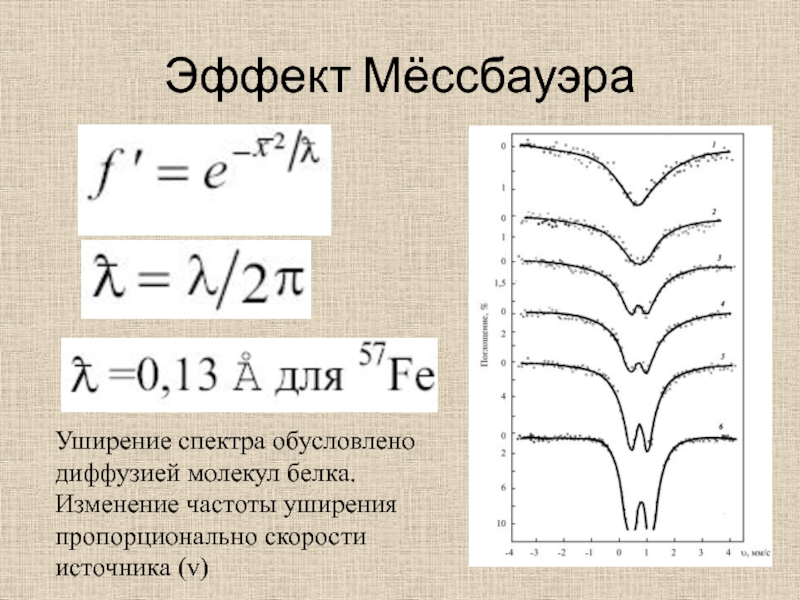
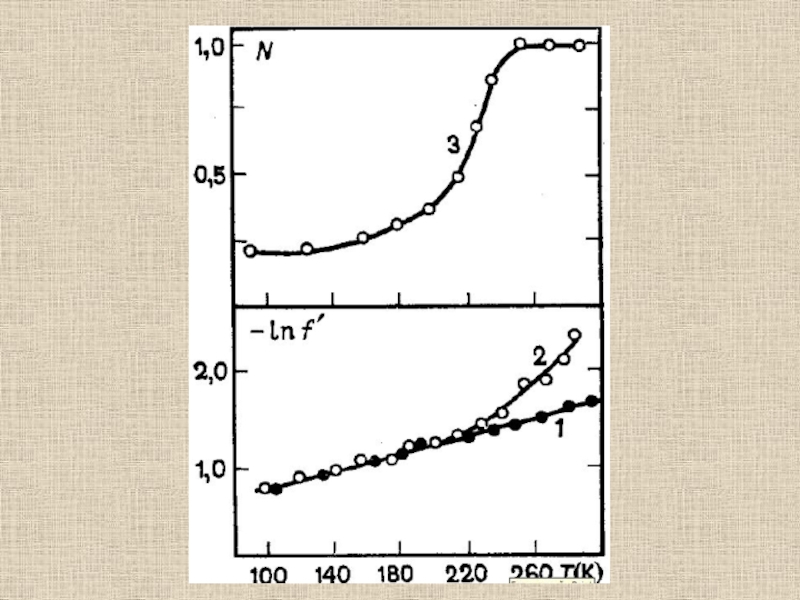
Слайд 48Эффект Мёссбауэра
Уширение спектра обусловлено диффузией молекул белка. Изменение частоты
уширения пропорционально скорости источника (v)
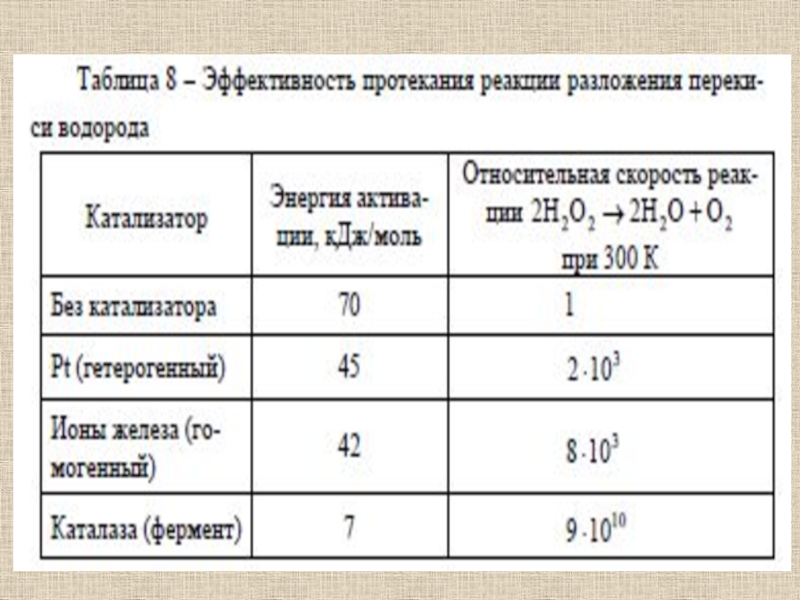
Слайд 52Ферменты (от латинского fermentum – закваска), энзимы (от греческого en
– "в" и zyme – "закваска") или биокатализаторы, – это
вещества биологического происхождения, ускоряющие химические реакцииСлайд 53Ферменты отличаются от других катализаторов тремя уникальными свойствами:
- высокой эффективностью
действия,
- специфичностью действия,
- способностью к регуляции.
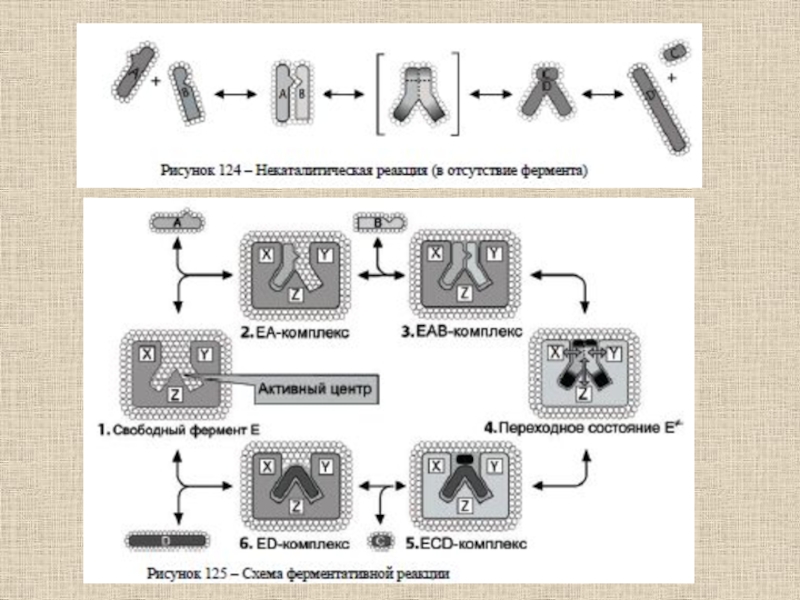
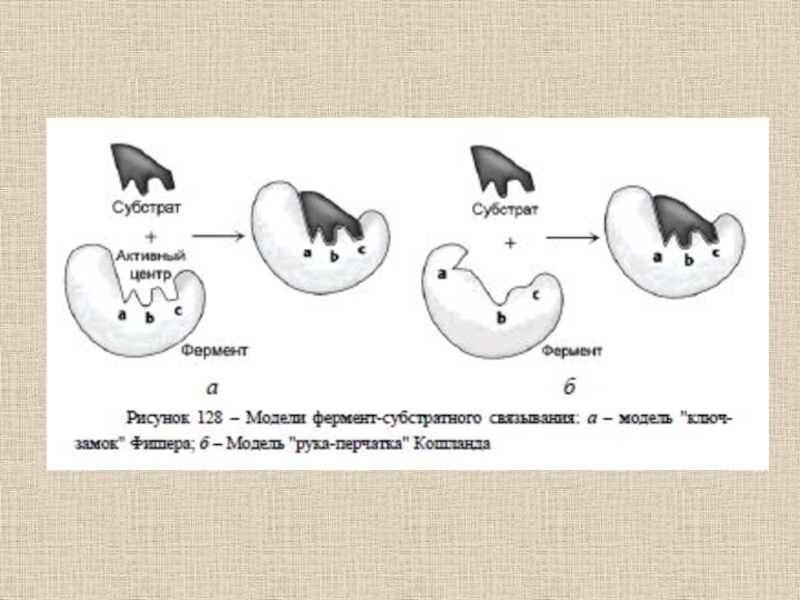
Слайд 59Взаимодействия, которые играют главную роль при связывании субстрата в активном
центре фермента и образовании комплекса фермент-субстрат в воде:
1) образование ковалентных
связей;2) гидрофобные взаимодействия между неполярными (углеводородными) фрагментами субстратной молекулы и дегидратированными (хотя бы частично) областями поверхностного слоя глобулы;
3) электростатические взаимодействия между заряженными группами субстрата и ионизованными аминокислотными остатками полипептидных цепей;
4) образование водородных связей.
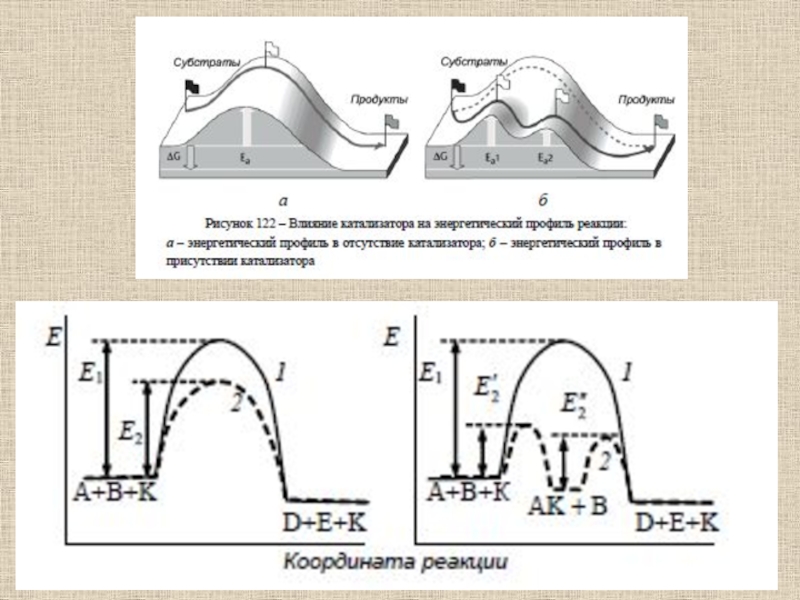
Слайд 61Основные механизмы управления каталитической активностью фермента связаны со следующими явлениями
и процессами:
1) аллостерия;
2) кооперативность;
3) связывание с лигандами (ингибиторами, активаторами, эффекторами,
индукторами);4) существование белковых переключателей.
Слайд 70Рис.2. Компьютерные изображения структуры белка миоглобина.
1 - атомы в виде
небольших сфер разного цвета: красные - кислород, белые - углерод,
синие - азот, желтые - сера. Атомы водорода очень слабо рассеивают рентгеновские лучи и на изображении их нет. Красные сферы по краям белковой молекулы - это кислородные атомы структурированной воды, прочно связанной с белковой глобулой.2 - общий ход полипептидной цепи. Участки a-спирали выделены красным цветом, неструктурированные петли цепи - белым цветом.
3 - спиральные структуры в виде лент.
4 - атомы даны как сферы с радиусами Ван-дер-Ваальса.
Рассматривая рисунки 1-3, можно подумать, что полипептидная цепь уложена рыхло и потому обладает большой подвижностью. Но это не так: белковая глобула выглядит как плотная гроздь атомов, лишенных возможности свободного перемещения (4).