Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции, применяемые в синтезах гетероциклов
Содержание
- 1. Реакции, применяемые в синтезах гетероциклов
- 2. Кислотный и основной катализ реакцииПротонирование С=О группы
- 3. Альдольная и кротоновая конденсацииразновидность нуклеофильного присоединения по
- 4. Альдольная и кротоновая конденсацииАльдольная конденсация идет в
- 5. Кротоновая конденсация Кротоновую конденсацию между ароматическими альдегидами
- 6. Взаимодействия нуклеофила с ацильными соединениями (SNAE)Реакционная способность
- 7. Сложноэфирная конденсация Кляйзенаидет между эфирами карбоновых кислот,
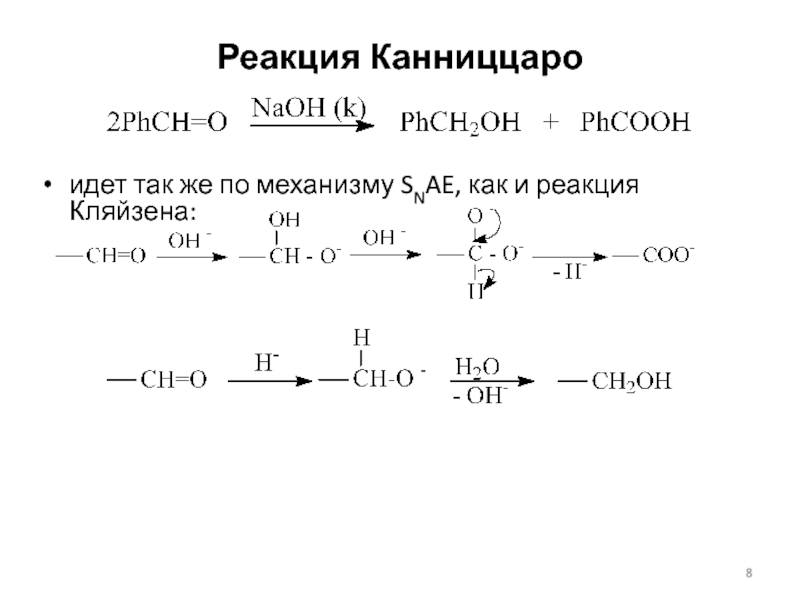
- 8. Реакция Канниццаро идет так же по механизму SNAE, как и реакция Кляйзена:
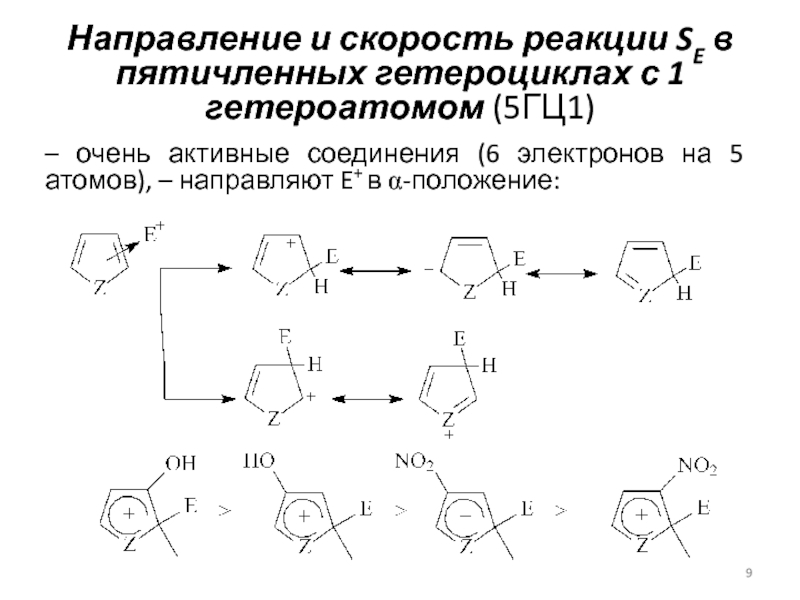
- 9. Направление и скорость реакции SE в пятичленных
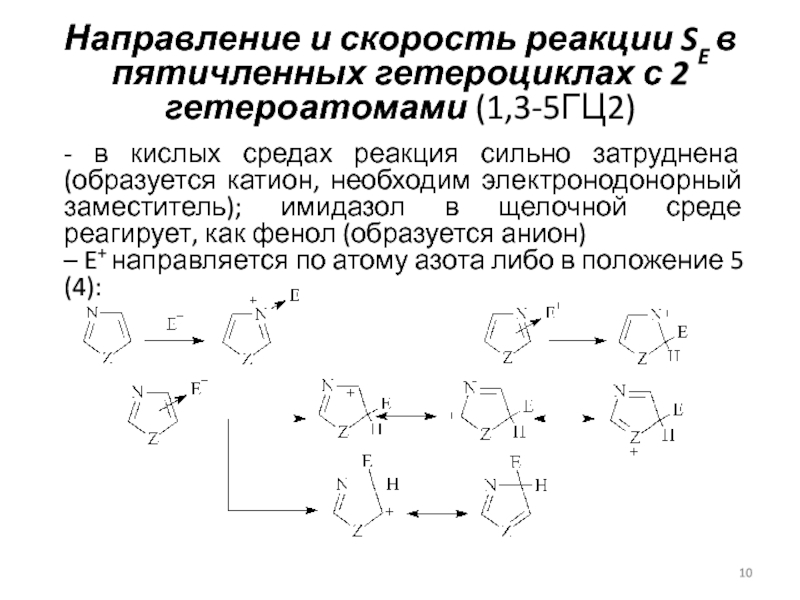
- 10. Направление и скорость реакции SE в пятичленных
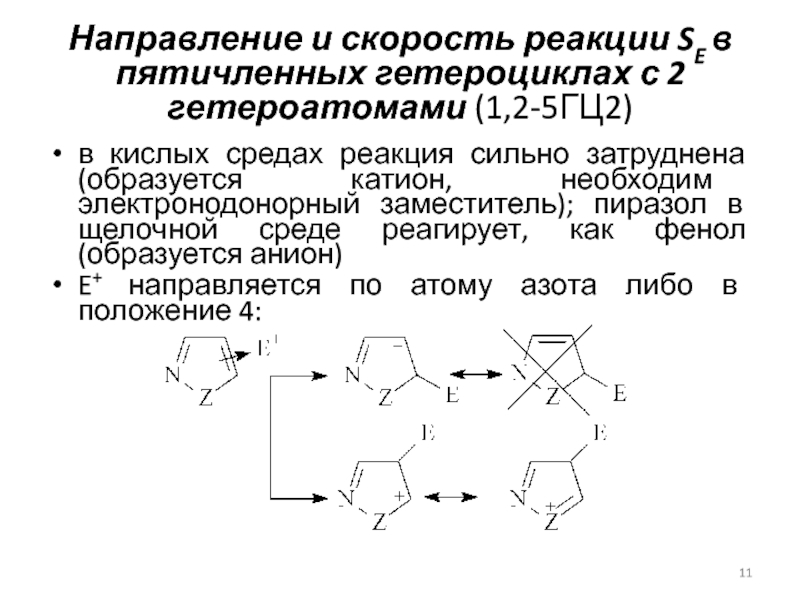
- 11. Направление и скорость реакции SE в пятичленных
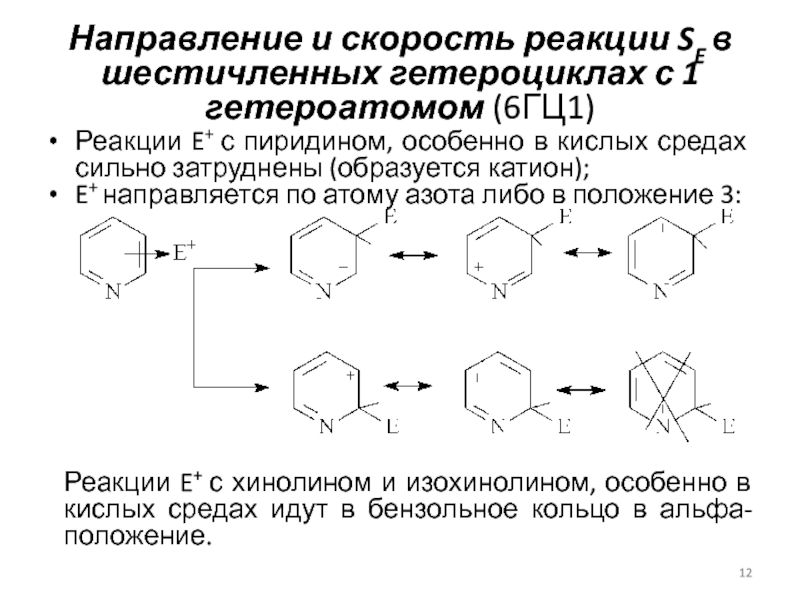
- 12. Направление и скорость реакции SE в шестичленных
- 13. Особенности нуклеофильного замещения в шестичленных гетероциклахПиридин можно
- 14. Особенности нуклеофильного замещения в шестичленных гетероциклахВ диазинах
- 15. Скачать презентанцию
Кислотный и основной катализ реакцииПротонирование С=О группы приводит к увеличению положительного заряда на атоме углерода и способности атома кислорода принимать электроны. Используют, как правило, органические кислоты, т.к. нуклеофилы с минеральными кислотами
Слайды и текст этой презентации
Слайд 1Реакции, применяемые в синтезах гетероциклов
1. Реакции нуклеофила с альдегидами и
кетонами
атоме углерода С=О группы и пространственных препятствий. В связи с этим альдегиды реагируют с нуклеофилами значительно активнее, чем кетоны.Слайд 2Кислотный и основной катализ реакции
Протонирование С=О группы приводит к увеличению
положительного заряда на атоме углерода и способности атома кислорода принимать
электроны. Используют, как правило, органические кислоты, т.к. нуклеофилы с минеральными кислотами образуют соли, которые нуклеофилами не являются. Поэтому при понижении рН скорость реакции сначала повышается, а затем уменьшается.Основной катализ связан с активацией нуклеофилов.
2,3-Непредельные карбонильные соединения реагируют как по 1,2-, так и по 1,4-механизму (для кетонов в основном по 1,4-):
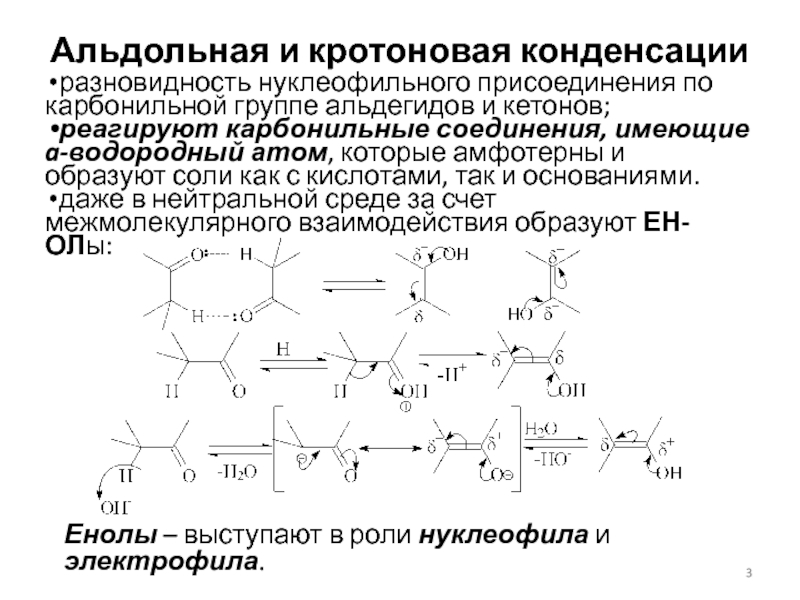
Слайд 3Альдольная и кротоновая конденсации
разновидность нуклеофильного присоединения по карбонильной группе альдегидов
и кетонов;
реагируют карбонильные соединения, имеющие a-водородный атом, которые амфотерны и
образуют соли как с кислотами, так и основаниями. даже в нейтральной среде за счет межмолекулярного взаимодействия образуют ЕН-ОЛы:
Енолы – выступают в роли нуклеофила и электрофила.
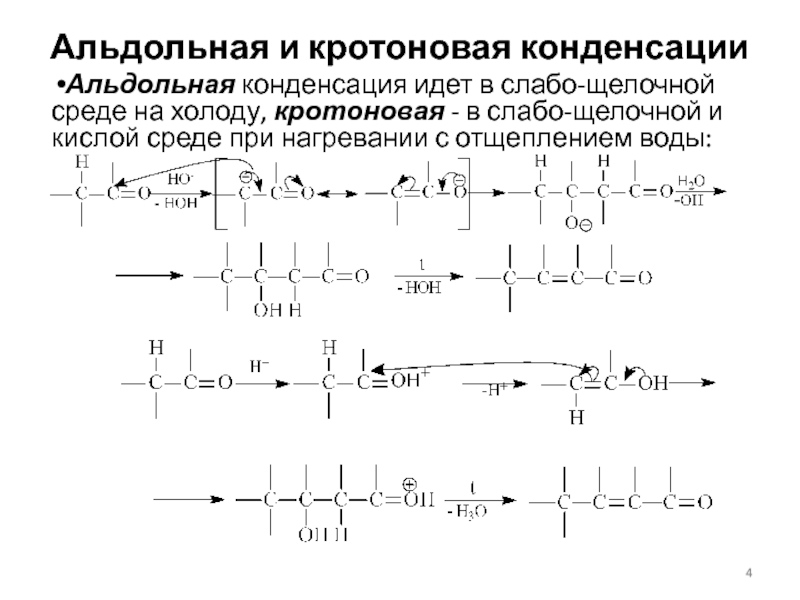
Слайд 4Альдольная и кротоновая конденсации
Альдольная конденсация идет в слабо-щелочной среде на
холоду, кротоновая - в слабо-щелочной и кислой среде при нагревании
с отщеплением воды:Слайд 5Кротоновая конденсация
Кротоновую конденсацию между ароматическими альдегидами и кетонами и
алифатическими альдегидами, кетонами, сложными эфирами и ангидридами алифатических карбоновых кислот
называют конденсациями Кляйзена, Перкина и др.Слайд 6Взаимодействия нуклеофила с ацильными соединениями (SNAE)
Реакционная способность ацильных соединений зависит
от величины положительного заряда и пространственных факторов (как и у
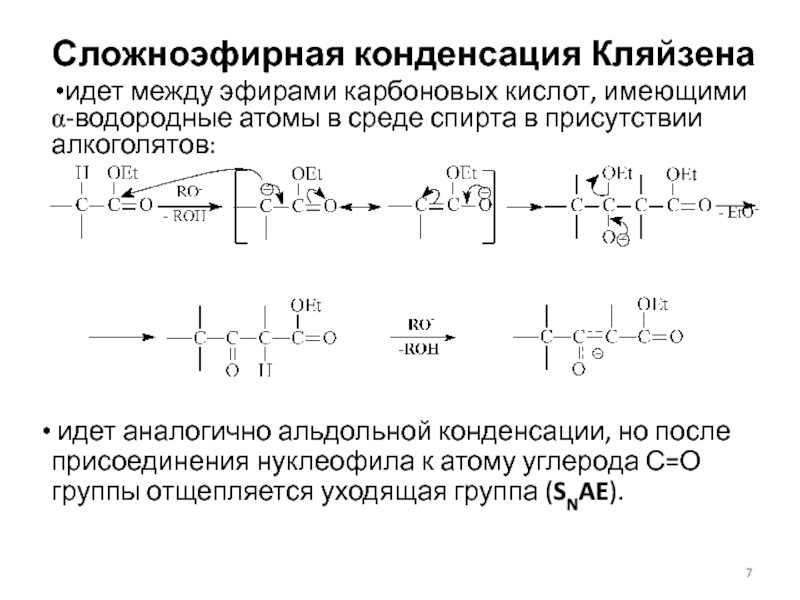
альдегидов и кетонов, т.к. реакция одна и та же), а также от способности уходящей группы «уходить», т.к. весь процесс состоит из двух стадий: присоединение и отщепление.Слайд 7Сложноэфирная конденсация Кляйзена
идет между эфирами карбоновых кислот, имеющими a-водородные атомы
в среде спирта в присутствии алкоголятов:
идет аналогично альдольной конденсации,
но после присоединения нуклеофила к атому углерода С=О группы отщепляется уходящая группа (SNAE). Слайд 9Направление и скорость реакции SE в пятичленных гетероциклах с 1
гетероатомом (5ГЦ1)
– очень активные соединения (6 электронов на 5 атомов),
– направляют E+ в a-положение:Слайд 10Направление и скорость реакции SE в пятичленных гетероциклах с 2
гетероатомами (1,3-5ГЦ2)
- в кислых средах реакция сильно затруднена (образуется катион,
необходим электронодонорный заместитель); имидазол в щелочной среде реагирует, как фенол (образуется анион)– E+ направляется по атому азота либо в положение 5 (4):
Слайд 11Направление и скорость реакции SE в пятичленных гетероциклах с 2
гетероатомами (1,2-5ГЦ2)
в кислых средах реакция сильно затруднена (образуется катион, необходим
электронодонорный заместитель); пиразол в щелочной среде реагирует, как фенол (образуется анион)E+ направляется по атому азота либо в положение 4:
Слайд 12Направление и скорость реакции SE в шестичленных гетероциклах с 1
гетероатомом (6ГЦ1)
Реакции E+ с пиридином, особенно в кислых средах сильно
затруднены (образуется катион); E+ направляется по атому азота либо в положение 3:
Реакции E+ с хинолином и изохинолином, особенно в кислых средах идут в бензольное кольцо в альфа-положение.
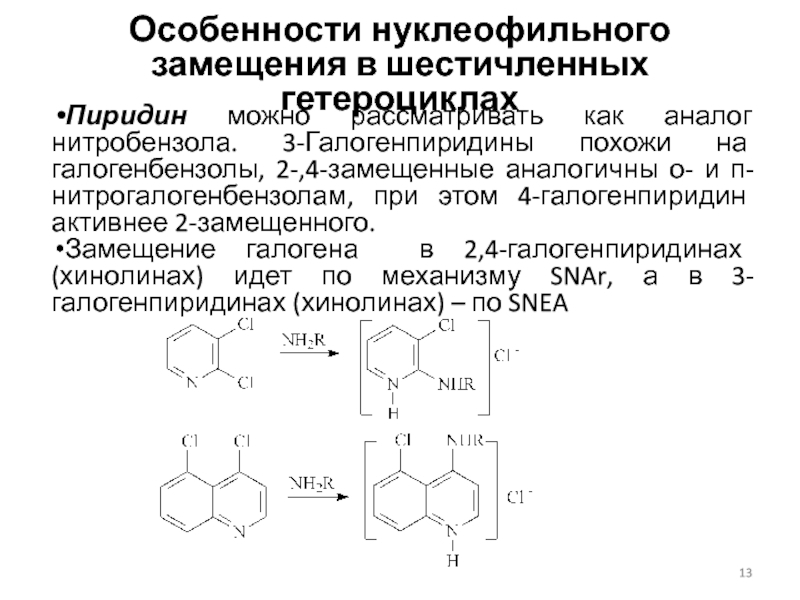
Слайд 13Особенности нуклеофильного замещения в шестичленных гетероциклах
Пиридин можно рассматривать как аналог
нитробензола. 3-Галогенпиридины похожи на галогенбензолы, 2-,4-замещенные аналогичны о- и п-нитрогалогенбензолам,
при этом 4-галогенпиридин активнее 2-замещенного.Замещение галогена в 2,4-галогенпиридинах (хинолинах) идет по механизму SNAr, а в 3-галогенпиридинах (хинолинах) – по SNEA
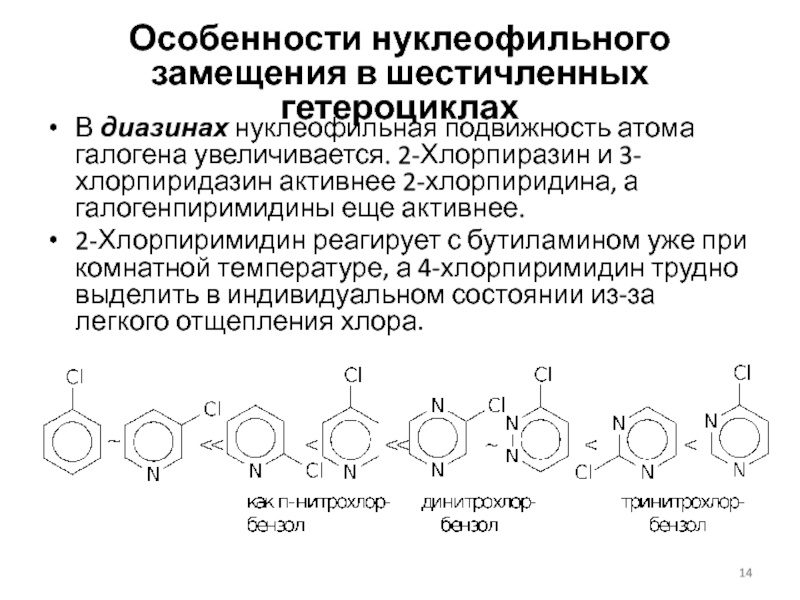
Слайд 14Особенности нуклеофильного замещения в шестичленных гетероциклах
В диазинах нуклеофильная подвижность атома
галогена увеличивается. 2-Хлорпиразин и 3-хлорпиридазин активнее 2-хлорпиридина, а галогенпиримидины еще
активнее.2-Хлорпиримидин реагирует с бутиламином уже при комнатной температуре, а 4-хлорпиримидин трудно выделить в индивидуальном состоянии из-за легкого отщепления хлора.