Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляция экспрессии генов
Содержание
- 1. Регуляция экспрессии генов
- 2. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ:«Регуляция экспрессии генов»
- 3. Дайте сравнительную характеристику биологического значения регуляции экспрессии генов у про- и эукариот.
- 4. Посредством контроля экспрессии генов про- и эукариотические
- 5. В геноме кишечной палочки содержится
- 6. Механизмы регуляции экспрессии генов играют большую роль
- 7. В основе процессов дифференциации и специализации клеток
- 8. В механизме регуляции активности
- 9. Белки - репрессоры,
- 10. Белки - активаторы , взаимодействуя с регуляторными
- 11. К негенетическим факторам регуляции
- 12. Характеристика генетических и негенетических факторов регуляции экспрессии генов у прокариот
- 13. Слайд 13
- 14. Охарактеризуйте строение оперона у прокариот, функционирование Lac-оперона кишечной палочки
- 15. Опероном называют группу структурных генов, работа которых
- 16. Структура lac-оперона кишечной палочкиLac - оперон Е.
- 17. Слайд 17
- 18. Регуляция lac-оперона посредством негативной индукции РНК
- 19. При выращивании E.coli на среде, содержащей только
- 20. Слайд 20
- 21. При культивировании кишечной палочки на среде, содержащей
- 22. Двойной контроль lac-оперона позволяет кишечной палочке не
- 23. При наличии в среде глюкозы и
- 24. У кишечной палочки регуляция экспрессии генов осуществляется
- 25. Объясните функционирование Тrp-оперона кишечной палочки
- 26. Полипептиды, необходимые для синтеза триптофанаа)Триптофана нет, репрессор
- 27. Регуляторный ген Тrp-оперона контролирует синтез неактивного белка
- 28. Особенности регуляции экспрессии генов
- 29. Слайд 29
- 30. Регуляции активности генов на предтранскрипционном этапеИзменение компактизации
- 31. Регуляция экспрессии генов на предтранскрипционном этапе осуществляется
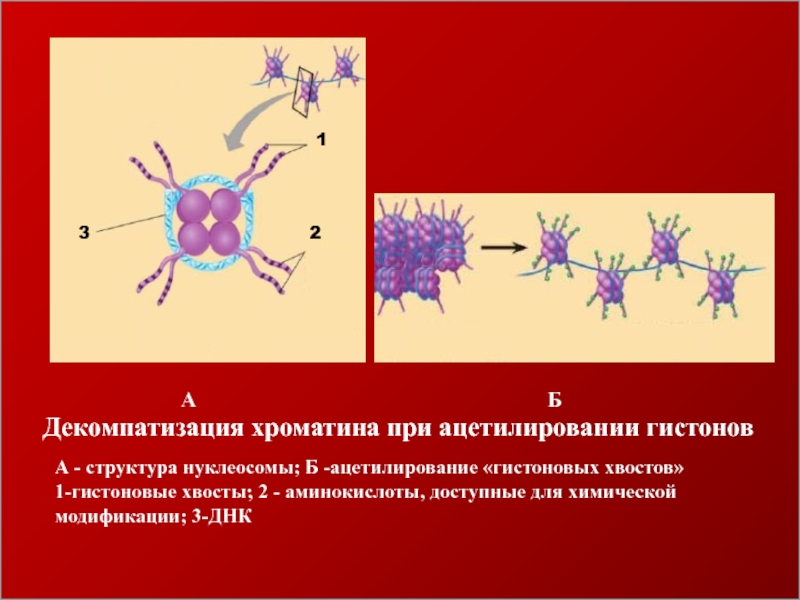
- 32. 123А - структура нуклеосомы; Б -ацетилирование «гистоновых
- 33. Фундаментальный принцип регуляции экспрессии генов на этапе
- 34. Специфическая комбинация контролирующих элементов, присущая каждому эукариотическому
- 35. Слайд 35
- 36. Модель, иллюстрирующая транскрипцию генов типоспецифических белков в клетках печени и хрусталика
- 37. Активация гена фактором роста1- неактивный транскрипционный фактор; 2 – активный транскрипционный фактор
- 38. Альтернативный сплайсинг. Схема транскрипции гена кальцитонина
- 39. На этапе трансляции регуляция экспрессии генов эукариот
- 40. Наличие в трейлерных участках мРНК –АУУУА- последовательностей
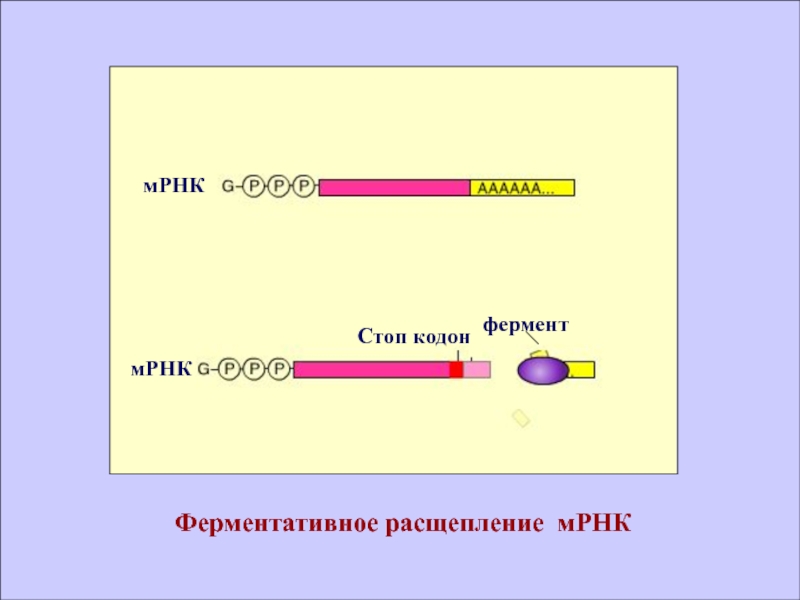
- 41. Ферментативное расщепление мРНК
- 42. В клетках эукариот функционирует механизм разрушения мРНК
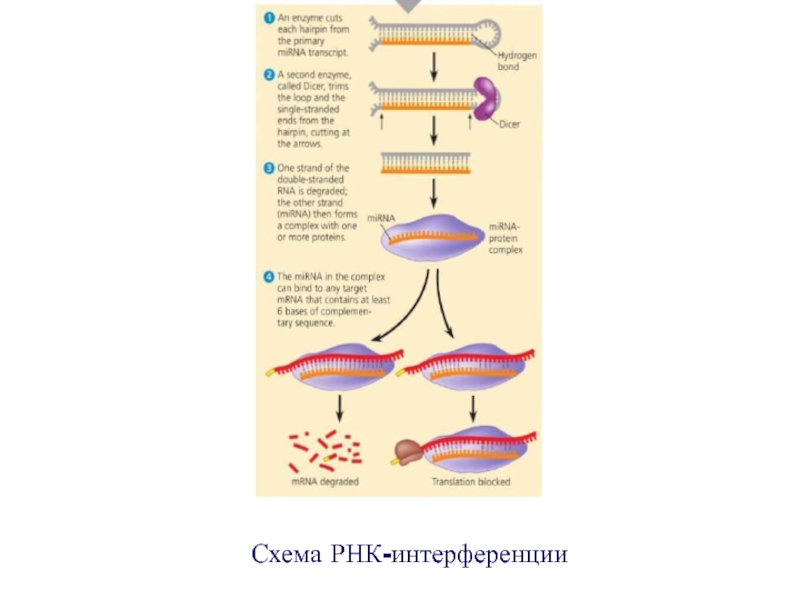
- 43. Схема РНК-интерференции
- 44. Процесс образования миРНК транскрипция молекулы-предшественника миРНК,
- 45. Регуляция скорости синтеза белков на рибосомах осуществляется на стадии инициации трансляции.
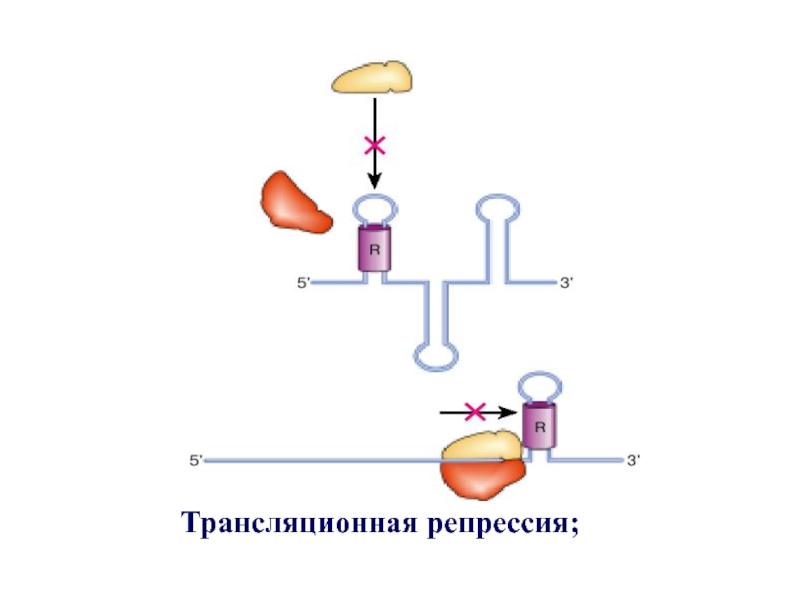
- 46. Трансляционная репрессия;
- 47. Железо входит в состав активных центров
- 48. Регуляция синтеза ферритина
- 49. мРНК ферритина регуляторный элемент
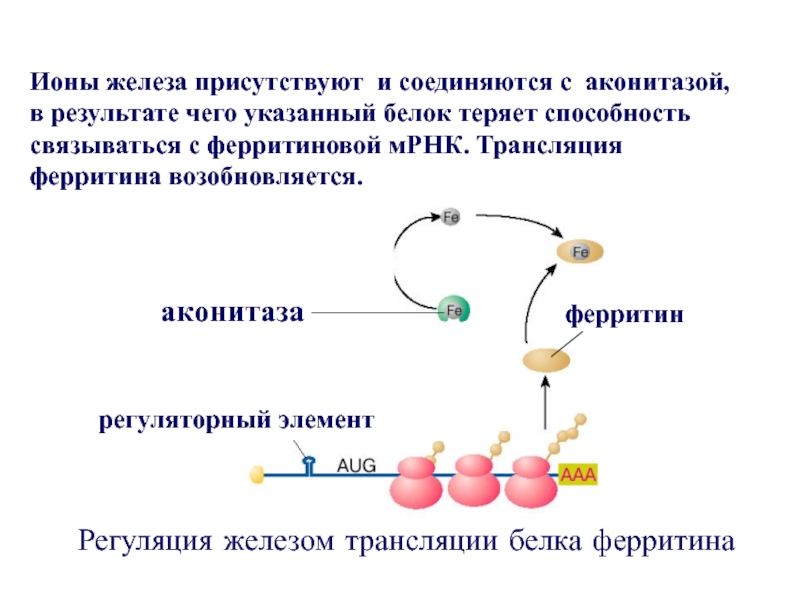
- 50. Регуляция железом трансляции белка ферритина
- 51. Регуляция экспрессии генов на этапе пострансляционных преобразований
- 52. Время функционирования разных белков в клетке
- 53. Деградация «короткоживущих» белков, выполняющих регуляторные функции, часто
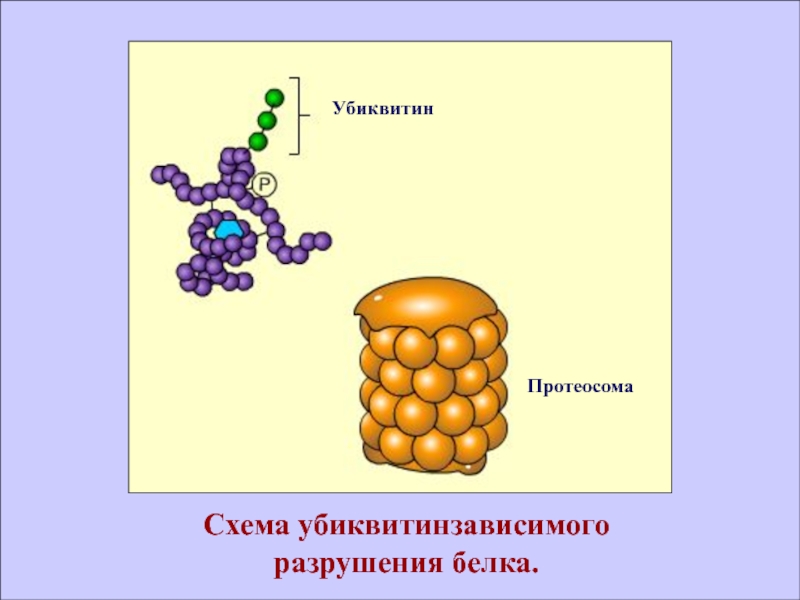
- 54. УбиквитинПротеосомаСхема убиквитинзависимого разрушения белка.
- 55. Протеолитическая деградация белка в протеосомах
- 56. КОНТРОЛЬНО-ОБУЧАЮЩИЕ ВОПРОСЫ1. Дайте сравнительную характеристику механизмов положительной
- 57. КОНТРОЛЬНО-ОБУЧАЮЩИЕ ТЕСТЫ1. Процесс экспрессии генов включает а)
- 58. 3. Гены в составе lac-оперона а) активируются
- 59. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Дайте сравнительную характеристику биологического значения регуляции экспрессии генов у про-
и эукариот.
Слайд 4
Посредством контроля экспрессии генов про- и эукариотические организмы адаптируются к
изменяющимся условиям окружающей среды. Отражением этого служит то, что
лишь небольшая часть белков, которые закодированы в генах клетки или организма синтезируются ими в данное время.Слайд 5
В геноме кишечной палочки содержится более 4000 белок
– кодирующих генов, однако в каждый данный момент в клетке
синтезируется и активно функционирует не более 600-800 белков, необходимых ей для обеспечения жизнедеятельности в конкретных условиях. Остальные гены находятся в репрессированном, «выключенном» состоянии и их «включение» осуществляется лишь в ответ на изменения, возникающие в окружающей среде.Слайд 6
Механизмы регуляции экспрессии генов играют большую роль в процессах дифференциации
и специализации клеток многоклеточных организмов в ходе их развития.
Слайд 7
В основе процессов дифференциации и специализации клеток лежит дифференцированная экспрессия
генов в клетках, относящихся к разным типам. В результате, несмотря
на наличие общей генетической программы и единого генома во всех клетках организма, каждый тип клеток характеризуется своим уникальным набором активно функционирующих белков и, как следствие этого, присущими только ему морфологическими и функциональными признаками.Слайд 8
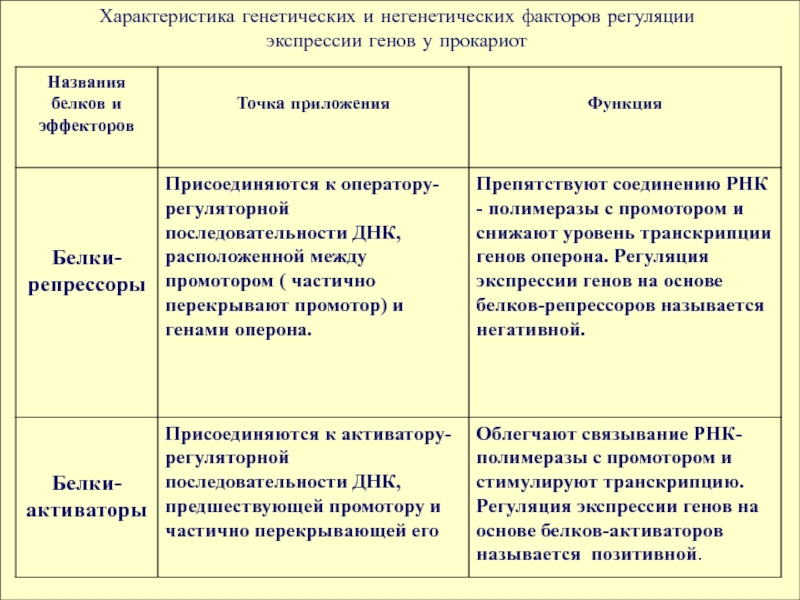
В механизме регуляции активности генов у прокариот
большую роль играют гены-регуляторы, контролирующие синтез регуляторных белков.
По своим функциям различают два вида регуляторных белков: белки - репрессоры и белки – активаторы, или апоиндукторы.Слайд 9
Белки - репрессоры, присоединяясь к регуляторным
полинуклеотидным последовательностям гена ( оперона), препятствуют присоединению РНК - полимеразы
к промотору и снижают уровень транскрипции.Регуляция активности генов на основе белков-репрессоров называется негативной.
Слайд 10
Белки - активаторы , взаимодействуя с регуляторными нуклеотидными последовательностями гена
( оперона) облегчают связывание РНК-полимеразы с промотором и стимулируют транскрипцию.
Регуляция действия генов с помощью белков-активаторов называется позитивной регуляцией.Слайд 11
К негенетическим факторам регуляции экспрессии генов, или
эффекторам относятся вещества небелковой природы, которые, взаимодействуя с регуляторными белками,
изменяют их биологическую активность.Различают два вида эффекторов: индукторы, «включающие» транскрипцию, и корепрессоры, «выключающие» ее.
Слайд 12
Характеристика генетических и негенетических факторов регуляции экспрессии генов у прокариот
Слайд 15
Опероном называют группу структурных генов, работа которых контролируется одним оператором.
Объединение разных генов в один оперон позволяет осуществлять координированный контроль
экспрессии генов, путем одновременного их «включения» или «выключения».Слайд 16
Структура lac-оперона кишечной палочки
Lac - оперон Е. соli включает следующие
элементы:
структурные гены, кодирующие белки ферменты: галактозидазу, пермеазу и
трансацетилазу, участвующие в метаболизме лактозы и транспорте ее в клетку;промотор - последовательность нуклеотидов, с которой связывается РНК полимераза;
оператор - последовательность нуклеотидов для связывания белка- репрессора;
последовательность нуклеотидов для связывания белка активатора;
терминатор- последовательность нуклеотидов, которая служит сигналом окончания транскрипции.
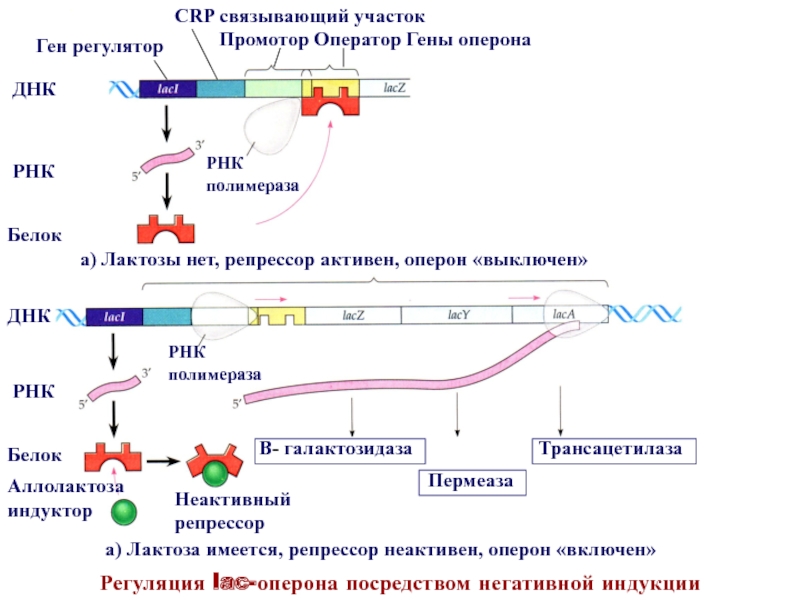
Слайд 18Регуляция lac-оперона посредством негативной индукции
РНК
Промотор Оператор Гены оперона
Ген регулятор
ДНКБелок
РНК полимераза
Белок
ДНК
РНК
Аллолактоза индуктор
Неактивный репрессор
а) Лактозы нет, репрессор активен, оперон «выключен»
а) Лактоза имеется, репрессор неактивен, оперон «включен»
В- галактозидаза
РНК полимераза
Пермеаза
Трансацетилаза
СRP связывающий участок
Слайд 19
При выращивании E.coli на среде, содержащей только глюкозу ген- регулятор
lac-оперона синтезирует активный белок-репрессор, который, взаимодействуя с оператором, «выключает» транскрипцию
структурных генов, кодирующих ферменты, необходимые для усвоения лактозы.Если клетки E.coli перенести на среду, содержащую только лактозу, то проникая внутрь клеток небольшая часть ее превращается в аллолактозу. Аллолактоза, связываясь с белком репрессором, инактивирует его. В результате РНК-полимераза осуществляет транскрипцию полицистронной мРНК для синтеза всех ферментов, необходимых для транспорта и метаболизма лактозы . В данном случае осуществляется регуляция активности генов lac-оперона на основе негативной индукции. При этом аллолактоза служит индуктором генов lac-оперона, кодирующих белки, участвующие в транспорте и метаболизме лактозы. Опероны, регулируемые подобным образом, получили название индуцибельных, или индуцируемых оперонов.
Слайд 20
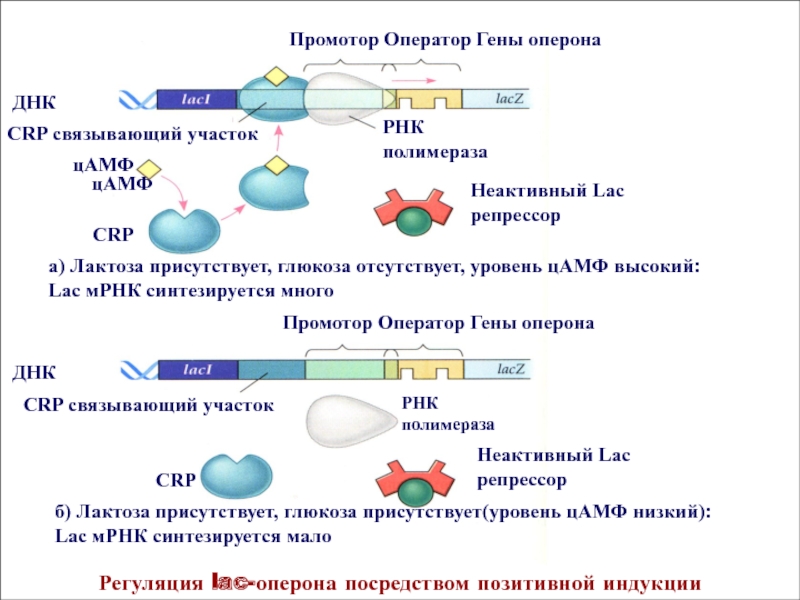
Промотор Оператор Гены
оперона ДНК
ДНК
Промотор Оператор Гены оперона
а) Лактоза присутствует, глюкоза отсутствует, уровень цАМФ высокий: Lac мРНК синтезируется много
б) Лактоза присутствует, глюкоза присутствует(уровень цАМФ низкий): Lac мРНК синтезируется мало
РНК полимераза
Неактивный Lac репрессор
Неактивный Lac репрессор
РНК полимераза
цАМФ
цАМФ
СRP связывающий участок
СRP связывающий участок
СRP
СRP
Регуляция lac-оперона посредством позитивной индукции
Слайд 21
При культивировании кишечной палочки на среде, содержащей как лактозу, так
и глюкозу бактерии утилизируют только глюкозу. Подобная избирательность в выборе
субстрата обусловливается наличием у Е. соli механизма положительной регуляции активности генов lac-оперона . Роль активатора lac-оперона играет СRP –белок, который сам по себе неактивен и не может связываться с регуляторными последовательностями ДНК промотора. Эту способность СRP-белок приобретает лишь в комплексе с низко молекулярным соединением - циклическим аденозин монофосфатом (цАМФ), который накапливается в клетках кишечной палочки при отсутствии в культуральной среде, где они выращиваются, глюкозы.* Белок CRP в составе комплекса с цАМФ взаимодействует с регуляторной последовательностью ДНК промотора и облегчает присоединение к нему РНК-полимеразы, стимулируя тем самым транскрипцию генов, кодирующих ферменты, участвующие в утилизации лактозы. В то же время, при наличии в среде глюкозы и лактозы гены lac-оперона практически не транскрибируются. Это связано с низким аффинитетом фермента РНК-полимеразы к промотору lac-оперона, который способен связываться с промотором лишь при наличии активного активатора.Слайд 22
Двойной контроль lac-оперона позволяет кишечной палочке не только быстро перестраивать
свой метаболизм в изменяющихся условиях среды, поскольку содержимое кишечника человека,
где эта бактерия обитает, характеризуется большим непостоянством, но и осуществлять биологически оправданный выбор субстрата для реакции брожения.Слайд 23
При наличии в среде глюкозы и лактозы, бактерии кишечной
палочки утилизируют только глюкозу, достигая этим наиболее экономного расходования имеющихся
у них энергетических ресурсов. Объясняется это тем, что в отличие от глюкозы, использование в качестве энергетического субстрата лактозы, требует предварительного расщепления молочного сахара на глюкозу и галактозу, что сопряжено с дополнительными затратами энергии.Слайд 24
У кишечной палочки регуляция экспрессии генов осуществляется не только на
основе негативной индукции, но и посредством негативной репрессии. Примером такой
регуляции служит функционирование триптофанового (trp) оперона, содержащего 5 структурных генов, кодирующих ферменты, необходимые для синтеза аминокислоты триптофана из ее предшественников.Слайд 26Полипептиды, необходимые для синтеза триптофана
а)Триптофана нет, репрессор неактивен, оперон «включен»
Белок
Триптофан
корепрессор
РНК
Активный репрессор
ДНК
б)Триптофан имеется, репрессор активен, оперон «выключен»
Триптофановый оперон Промотор Оператор Гены оперона
Нективный репрессор
ДНК
РНК
Белок
Регуляция trp-оперона посредством негативной репресии
Слайд 27
Регуляторный ген Тrp-оперона контролирует синтез неактивного белка репрессора. Если же
в клетке E. coli возникает избыток триптофана, например, в результате
снижения скорости синтеза белков клеткой, то триптофан, действуя как корепрессор, связывается с белком-репрессором и активирует его. Активированный белок-репрессор взаимодействует с оператором и «выключает» оперон. В результате синтез триптофана прекращается.Слайд 28
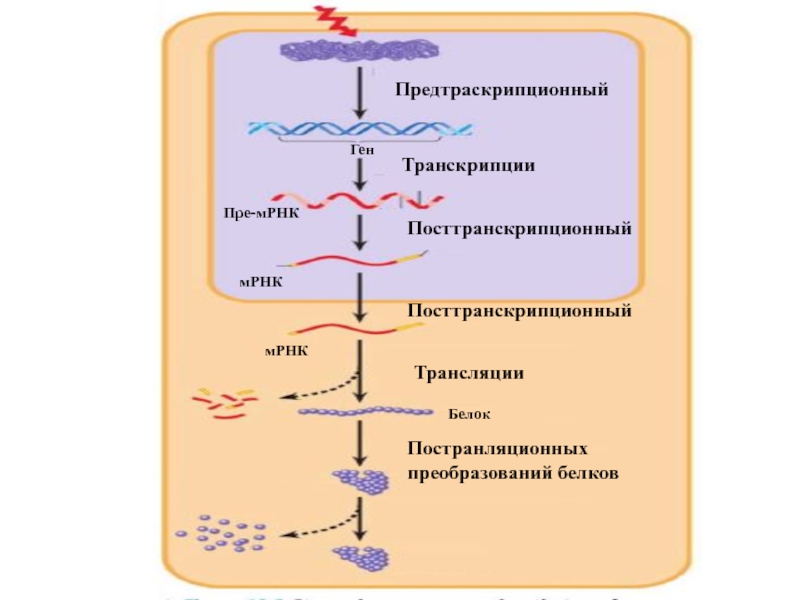
Особенности регуляции экспрессии генов эукариот
транскрипция эукариотических
генов возможна лишь при декомпактизации хроматина;
регуляция экспрессии генов у
эукариот осуществляется на предтранскрипционном этапе, в ходе транскрипции и на всех других этапах процесса реализации генетической информации, заключенной в гене: посттранскрипционном, трансляционном и посттрансляционном; активность каждого структурного гена контролируется многими генами-регуляторами, а эффекторами часто служат гормоны.
Слайд 30
Регуляции активности генов на предтранскрипционном этапе
Изменение компактизации ДНК:
- ацетилирование
гистоновых белков;
Изменение химической структуры ДНК:- метилирование цитозиновых оснований ДНК;
Слайд 31
Регуляция экспрессии генов на предтранскрипционном этапе осуществляется посредством структурной
модификации хроматина связанной с химическими преобразованиями белков-гистонов( ацетилирование, метилирование, фосфорилирование,
убиквитинилирование и др) , а также нулеотидов молекулы ДНК ( метилирование цитозиновых оснований).Слайд 32
1
2
3
А - структура нуклеосомы; Б -ацетилирование «гистоновых хвостов»
1-гистоновые хвосты; 2
- аминокислоты, доступные для химической
модификации; 3-ДНК
А
Б
Декомпатизация хроматина при ацетилировании
гистоновСлайд 33
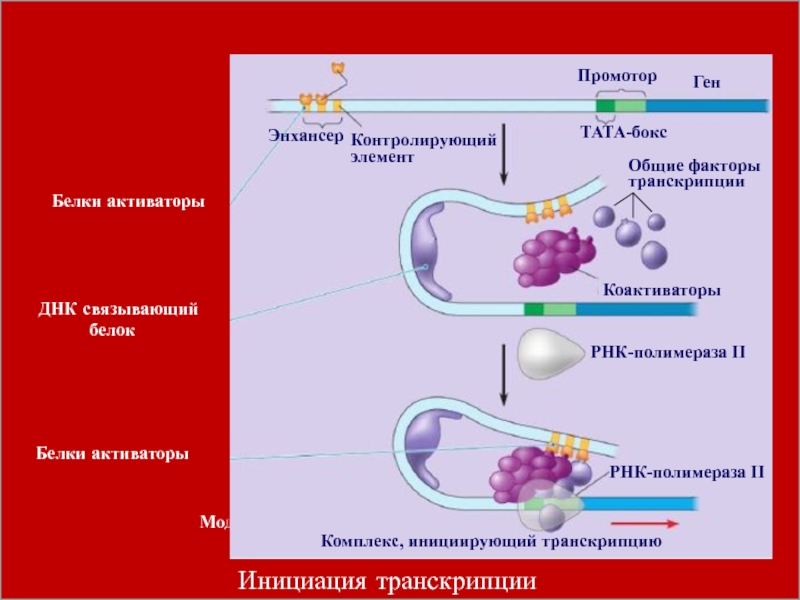
Фундаментальный принцип регуляции экспрессии генов на этапе транскрипции, заключается в
том, что она является комбинационной. Это означает, что каждый эукариотический
ген имеет свою специфическую комбинацию контролирующих элементов, с которыми непосредственно связываются белки, регулирующие экспрессию гена.Слайд 34
Специфическая комбинация контролирующих элементов, присущая каждому эукариотическому гену, служит основой
координированной регуляции генов, благодаря чему достигается «включение» или «выключение» их
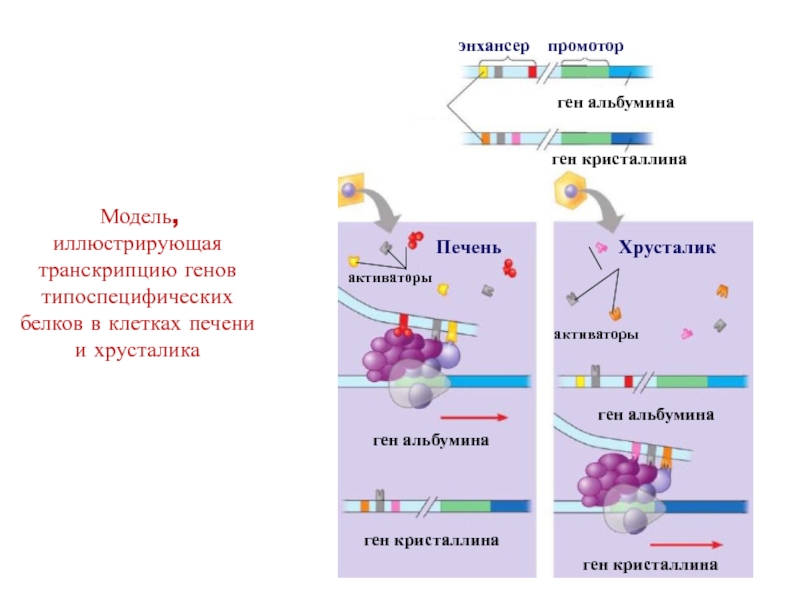
в определенное время.Слайд 36 Модель, иллюстрирующая транскрипцию генов типоспецифических белков в клетках печени
и хрусталика
Слайд 37
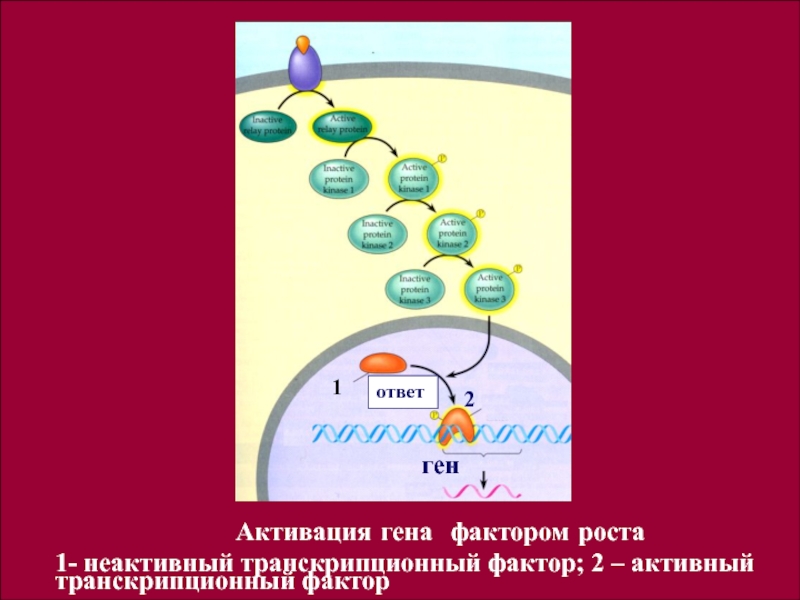
Активация гена фактором роста
1- неактивный транскрипционный фактор;
2 – активный транскрипционный фактор
Слайд 39
На этапе трансляции регуляция экспрессии генов эукариот осуществляется посредством контроля
времени функционирования молекул мРНК и скорости трансляции белков на рибосомах.
Слайд 40
Наличие в трейлерных участках мРНК –АУУУА- последовательностей или мотивов нестабильности,
называемых также ARE- элементами, повышает чувствительность мРНК к расщеплению рибонуклеазами.
Например, перенос таких участков из короткоживушей мРНК фактора роста тромбоцитов в стабильные молекулы глобиновых РНК вызывает быструю деградацию последних.
Слайд 42
В клетках эукариот функционирует механизм разрушения мРНК и блокады трансляции,
получивший название интерференции, или РНК сайленсинга, связанный с недавно отрытыми
молекулами микроРНК (миРНК) и маленьких интерфирирующих РНК (си РНК).Слайд 44
Процесс образования миРНК
транскрипция молекулы-предшественника миРНК, содержащей «шпилькообразные» структуры;
вырезание
«шпильки» из общего предшественника с образованием короткой двухцепочечной молекулы пре-миРНК
длиной ~60–70 нуклеотидов;транспорт пре- миРНК из ядра в цитоплазму;
разрезание пре-миРНК под действием фермента дисера (от англ. dicer) на духцепочечные фрагменты, состоящие примерно из 20 пар нуклеотидов;
образование комплекса миРНК – белок (RISK)
связывание миРНК с молекулой мРНК и разрушение мРНК
Слайд 45
Регуляция скорости синтеза белков на рибосомах осуществляется на стадии инициации
трансляции.
Слайд 47 Железо входит в состав активных центров многих белков (гемоглобин,
миоглобин, цитохромы), однако ионы свободного железа токсичны для клетки. Поэтому
они связываются и переводятся в нетоксичную форму белком ферритином.Синтез ферритина в клетке, в свою очередь, зависит от уровня свободного железа: в присутствии железа ферритин синтезируется, при недостатке железа синтез ферритина останавливается.
Регуляция железом трансляции белка ферритина
Слайд 48
Регуляция синтеза ферритина осуществляется белком –аконитазой,
который при низкой концентрации ионов железа связывается с последовательностью, образующей
шпилечную структуру в 5'-НТО мРНК ферритина, что блокирует трансляцию.При увеличении концентрации ионов железа аконитаза соединяется с ними и теряет способность связываться с ферритиновой мРНК. В результате на матрице ферритиновой мРНК происходит трансляция ферритина.
Слайд 49 мРНК ферритина
регуляторный элемент
аконитаза
ферритин аконитаза
Ионы железа отсутствуют. Аконитаза связывается с полинуклеотидной последовательностью, образующей шпилечную структуру в 5'-нетранслируемом участке ( лидере) ферритиновой мРНК , в результате чего трансляция ферритина блокируется.
регуляторный элемент
Регуляция железом трансляции белка ферритина
Слайд 50
Регуляция железом трансляции белка ферритина
аконитаза
регуляторный элемент
Ионы железа присутствуют и соединяются с аконитазой,
в результате чего указанный белок теряет способность связываться с ферритиновой мРНК. Трансляция ферритина возобновляется. ферритин
Слайд 51
Регуляция экспрессии генов на этапе пострансляционных преобразований белков включает:
фолдинг
полипептидов;
химические модификации полипептидов ;
транспорт полипептидов к местам назначения;
избирательную деградацию белков с участием протеаз. Слайд 52
Время функционирования разных белков в клетке варьирует в широких
пределах. Одни белки выполняют свои функции на протяжении нескольких месяцев
и даже лет, тогда как другие - в течение нескольких минут или часов.Слайд 53
Деградация «короткоживущих» белков, выполняющих регуляторные функции, часто осуществляется посредством ферментативного
присоединения к ним белка– убиквитина, состоящего из 76 аминокислот. Белки,
несущие на себе «убиквитиновые метки», распознаются специфическими крупномолекулярными комплексами - протеосомами, и затем разрушаются в протеосомах под действием протеосомных протеаз.Слайд 56КОНТРОЛЬНО-ОБУЧАЮЩИЕ ВОПРОСЫ
1. Дайте сравнительную характеристику механизмов
положительной и отрицательной регуляции
экспрессии генов
у прокариот на примере lac- и trp-оперонов кишечной
палочки.2. Объясните сущность комбинационного принципа
регуляции экспрессии генов эукариот на уровне транскрипции.
3. Объясните различие механизмов координированной
регуляции экспрессии генов на уровне транскрипции
у про- и эукариот.
4. Охарактеризуйте регуляцию экспрессии генов
у эукариот на претранскрипционном этапе,
этапе трансляции и этапе посттрансляционных
преобразований синтезированных белков .
Слайд 57КОНТРОЛЬНО-ОБУЧАЮЩИЕ ТЕСТЫ
1. Процесс экспрессии генов включает
а) транскрипцию;
б) трансляцию;
в) посттрансляционные преобразования белков;
г) все указанные процессы.
2. Структурно-функциональные различия
между клетками печени и клетками поджелудочной железы обусловлены
главным образом тем, что указанные клетки
а) экспрессируют разные гены;
б) содержат разные гены;
в) используют разные генетические коды;
г) имеют специфичные для них рРНК;
д) имеют специфичные для них тРНК.
Слайд 58
3. Гены в составе lac-оперона
а) активируются всегда вместе друг
с другом,
а репрессируются независимо друг от друга;
б)
активируются независимо друг от друга, а репрессируются вместе друг с другом;
в) активируются и репрессируются только вместе друг с другом.
4. При катаболитной репрессии trp-оперона избыток триптофана
а) активирует ферменты расщепления триптофана;
б) активирует белок-корепрессор;
в) инактивирует белок-репрессор;
г) активирует белок-репрессор;
д) инактивирует белок-репрессор.