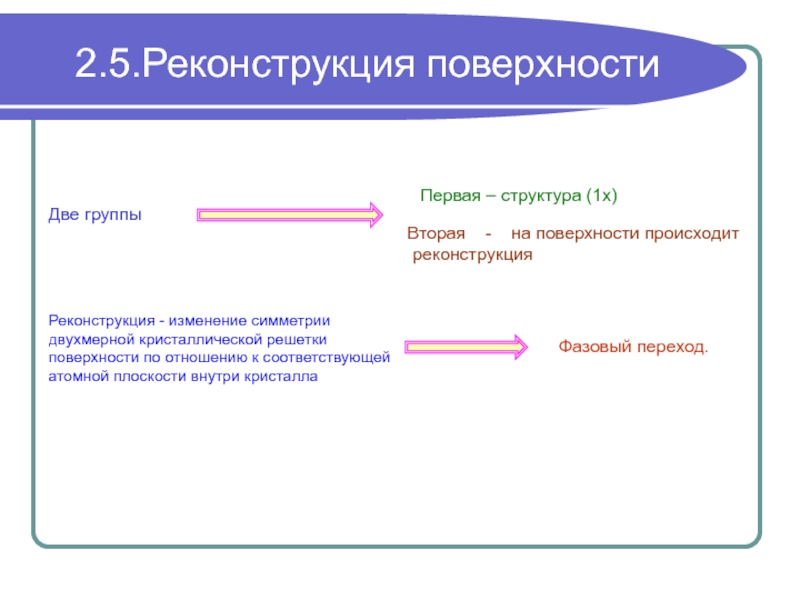
реконструкция поверхности?
Более общий - почему атомы данного
элемента кристаллизуются
в данную структуру.
Ответ может быть получен в результате рассмотрения полной энергии системы
Изменению структуры химической связи может сопутствовать перераспределение
электронного заселения орбиталей, что может приводить к появлению
локализованных электронных состояний (поверхностные состояния)
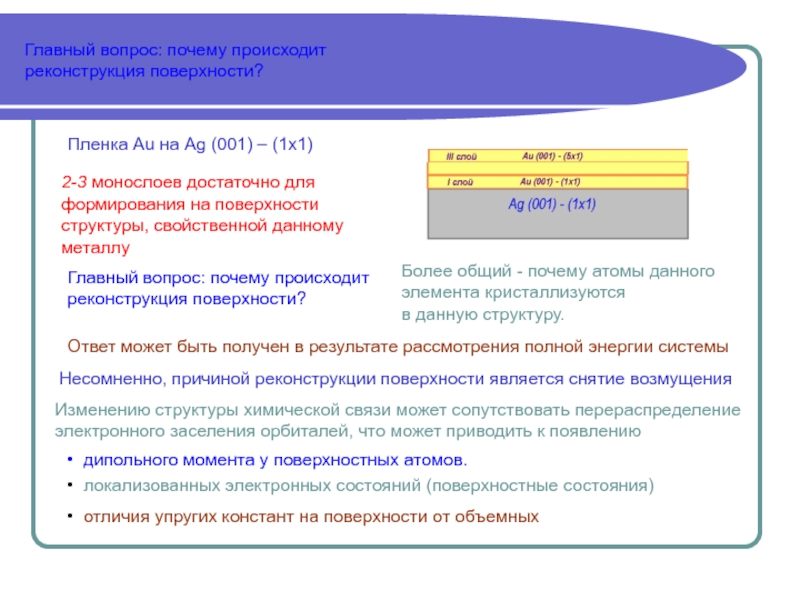
Пленка Au на Ag (001) – (1x1)
2-3 монослоев достаточно для
формирования на поверхности
структуры, свойственной данному
металлу
Несомненно, причиной реконструкции поверхности является снятие возмущения
дипольного момента у поверхностных атомов.
отличия упругих констант на поверхности от объемных


![Реконструкция поверхности Корреляция Энгеля Натрий Электронная конфигурация1s22s2p63s1 ≡ [Ne]3s1 Один валентный электрон Корреляция Энгеля Натрий Электронная конфигурация1s22s2p63s1 ≡ [Ne]3s1 Один валентный электрон Связь с восьмью атомами Объемоцентрированная кубическая](/img/thumbs/70303d21390bd9d03ddfcdb52eb9bcde-800x.jpg)
![Реконструкция поверхности Алюминий. Алюминий. [Ne]3s2p1 В образовании связи может принять участие только один Алюминий. Алюминий. [Ne]3s2p1 В образовании связи может принять участие только один р-электрон, ~83 ккал/моль В образовании связи](/img/thumbs/6fdd76463de1a9c8fb8ed864277bca98-800x.jpg)





















