Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Самопроизвольные процессы
Содержание
- 1. Самопроизвольные процессы
- 2. Второй закон термодинамикиВ изолированной системе самопроизвольный процесс
- 3. Энергия Гиббса (р, Т = const)Два фактораэнергия
- 4. II закон т.д. для химических процессовΔH <
- 5. Изменение энергии ГиббсаПримерВычислить стандартное изменение энергии Гиббса
- 6. Лекция № 4Кинетика химических реакций
- 7. Термодинамика и кинетика2NO (г) + O2(г) =
- 8. Химическая кинетикаизучает скорости химических реакций, их зависимость
- 9. РеакцииПростые– элементарные акты взаимодействия частиц, протекают в одну стадиюСложные– разнотипные элементарные акты, протекают в несколько стадийпараллельныепоследовательныецепные
- 10. Скорость реакцииизменение концентрации реагентов или продуктов реакции
- 11. Скорость реакции зависитот природы реагирующих веществот температурыот
- 12. Основной постулат химической кинетики1867 г. Гульдберг, Вааге
- 13. Влияние температуры на скоростьПравило Вант-Гоффа – при
- 14. Уравнение АррениусаЭнергия активации – минимальная энергия, которой
- 15. Теория активных соударений (ТАС)Три постулатапротекание реакции обусловлено
- 16. Стерический фактор (Р)Z – число всех соударенийP
- 17. Теория активированного комплекса (ТАК)Превращение исходных веществ в
- 18. Энтальпийные профили реакций
- 19. Сложные реакцииПараллельные реакции: несколько процессов с участием
- 20. Сложные реакцииПоследовательные реакции: образование конечных продуктов происходит
- 21. Цепные реакции– реакции, которые вызываются свободными радикалами,
- 22. Цепные реакцииРазветвленные ц. р.Зарождение цепи (инициирование): Развитие
- 23. Полуостров воспламененияВерхний и нижний пределы самовоспламенения
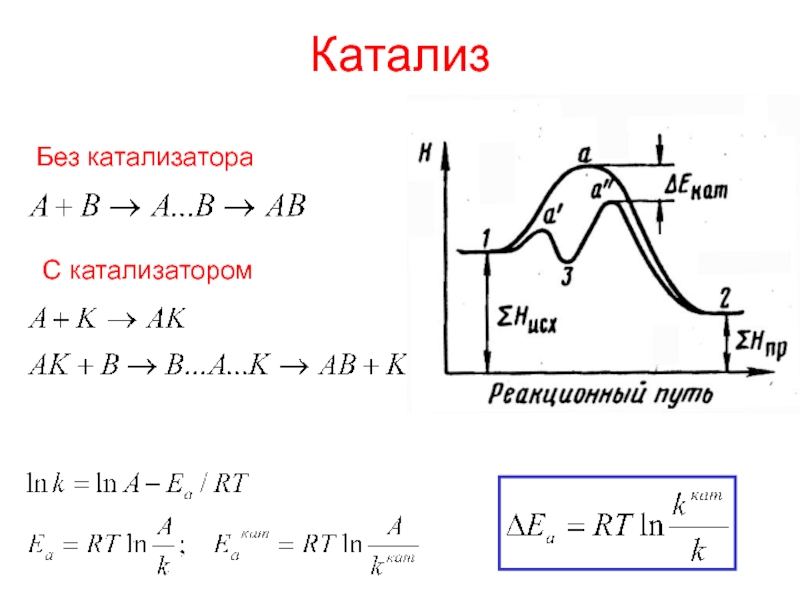
- 24. КатализКатализаторы – вещества, ускоряющие химическую реакцию.Ингибиторы –
- 25. КатализБез катализатораС катализатором
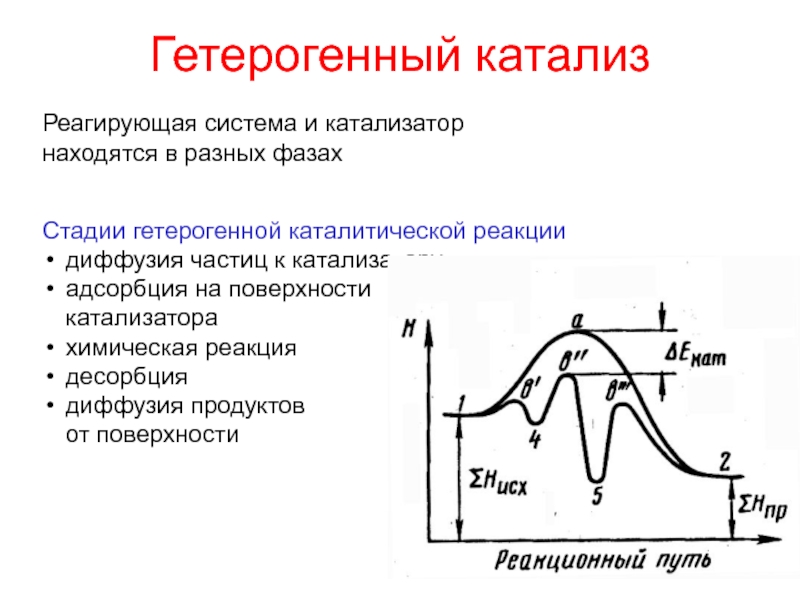
- 26. Гетерогенный катализРеагирующая система и катализатор находятся в
- 27. Химическое равновесие– для растворов– для газовКонстанта равновесия
- 28. Константа равновесия и т.д. величины– изотерма Ванта-Гоффа
- 29. Принцип Ле-ШательеЕсли на систему, находящуюся в состоянии
- 30. Влияние внешних условий на равновесиеКонцентрацияВ систему добавлено
- 31. Влияние внешних условий на равновесиеОбщее давление (для
- 32. Влияние внешних условий на равновесиеТемпература– изобара Вант-Гоффа
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Самопроизвольные процессы
Принцип Бертло-Томсена. Самопроизвольный химический процесс должен сопровождаться выделением тепла.
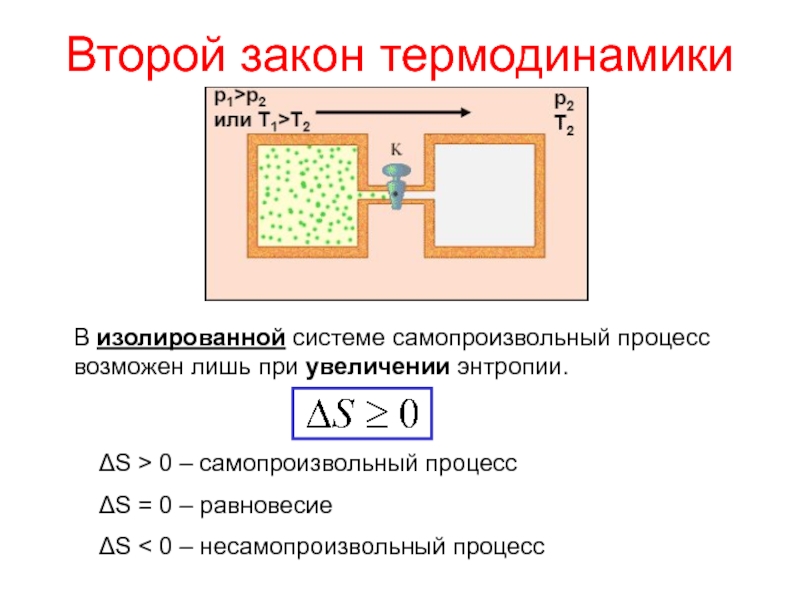
Слайд 2Второй закон термодинамики
В изолированной системе самопроизвольный процесс возможен лишь при
увеличении энтропии.
ΔS > 0 – самопроизвольный процесс
ΔS = 0 –
равновесиеΔS < 0 – несамопроизвольный процесс
Слайд 3Энергия Гиббса (р, Т = const)
Два фактора
энергия – энтальпийный фактор
Qp
= ΔH
энтропия– энтропийный фактор
TΔS
Энергия Гиббса
(изобарно-изотермический потенциал: р, Т =
const)ΔG < 0 – самопроизвольный процесс
ΔG = 0 – равновесие
Слайд 4II закон т.д. для химических процессов
ΔH < 0, ΔS >
0 – самопроизвольный процесс.
2С(тв.) + О2(г) = 2СО(г)
ΔH >
0, ΔS < 0 – несамопроизвольный процесс.
3О2(г) = 2О3(г) (эл. разряд)ΔH > 0, ΔS > 0 – процесс протекает при |ΔH| < |TΔS| 2Сu2O(тв.) = 4Cu(тв) + O2(г)
ΔH < 0, ΔS < 0 – процесс протекает при |ΔH| > |TΔS| 2NO2(г) = N2O4(г)
Химическая реакция протекает самопроизвольно в том направлении, при котором происходит уменьшение энергии Гиббса:
Слайд 5Изменение энергии Гиббса
Пример
Вычислить стандартное изменение энергии Гиббса при 25 °С
для термического разложения CaCO3, если ΔH0 = +178 кДж\моль, ΔS0
= +161 Дж\мольК.Может ли эта реакция протекать самопроизвольно при 25 °С?
При какой температуре становится возможным самопроизвольное протекание реакции?
Слайд 7Термодинамика и кинетика
2NO (г) + O2(г) = 2NO2 (г); ΔG0298=
-70 кДж
2H2 (г) + O2(г) = 2H2O(г); ΔG0298 = -447
кДжСлайд 8Химическая кинетика
изучает скорости химических реакций, их зависимость от различных факторов
и механизмы реакций
Механизм реакции – последовательность и характер стадий химической
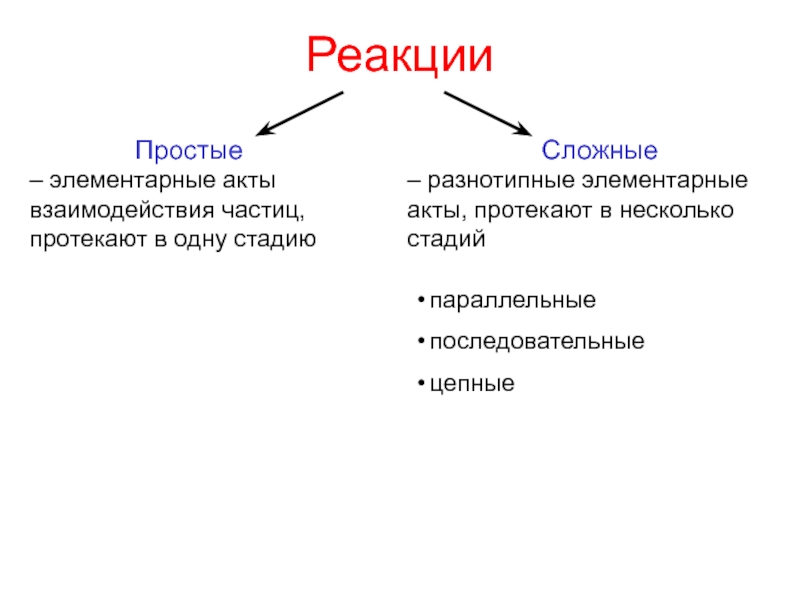
реакцииСлайд 9Реакции
Простые
– элементарные акты взаимодействия частиц, протекают в одну стадию
Сложные
– разнотипные
элементарные акты, протекают в несколько стадий
параллельные
последовательные
цепные
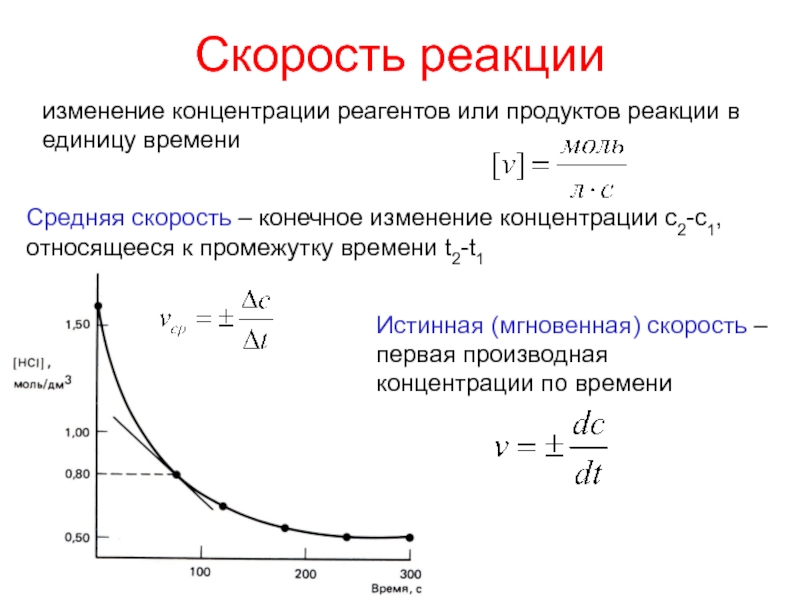
Слайд 10Скорость реакции
изменение концентрации реагентов или продуктов реакции в единицу времени
Средняя
скорость – конечное изменение концентрации с2-с1, относящееся к промежутку времени
t2-t1Истинная (мгновенная) скорость – первая производная концентрации по времени
Слайд 11Скорость реакции зависит
от природы реагирующих веществ
от температуры
от концентрации
от давления (для
газов)
от катализатора
от площади соприкосновения (для гетерогенных реакций)
от среды (для реакций
в растворах)от формы сосуда (для цепных реакций)
Слайд 12Основной постулат
химической кинетики
1867 г. Гульдберг, Вааге – закон действующих масс:
скорость
элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях их
стехиометрических коэффициентовaA + bB → сС + dD
Слайд 13Влияние температуры на скорость
Правило Вант-Гоффа – при увеличении температуры на
10 °С скорость реакции увеличивается в 2-4 раза.
Слайд 14Уравнение Аррениуса
Энергия активации – минимальная энергия, которой должны обладать молекулы,
чтобы их столкновение могло привести к химическому взаимодействию
Слайд 15Теория активных соударений (ТАС)
Три постулата
протекание реакции обусловлено столкновениями между частицами
к
реакции приводит только эффективное столкновение – между частицами, обладающими избытком
энергиистолкновение приводит к реакции только, если частицы определенным образом ориентированы в пространстве
Слайд 16Стерический фактор (Р)
Z – число всех соударений
P – стерический фактор,
доля соударений, благоприятных в пространственном отношении (для осуществления реакции д.б.
определенная ориентация молекул)exp (-Ea/RT) – доля соударений, благоприятных в энергетическом отношении
Слайд 17Теория активированного комплекса (ТАК)
Превращение исходных веществ в продукты реакции идет
через образование промежуточного активированного комплекса (переходного состояния)
Слайд 19Сложные реакции
Параллельные реакции: несколько процессов с участием одних и тех
же исходных веществ
Скорость определяется наиболее быстрой стадией
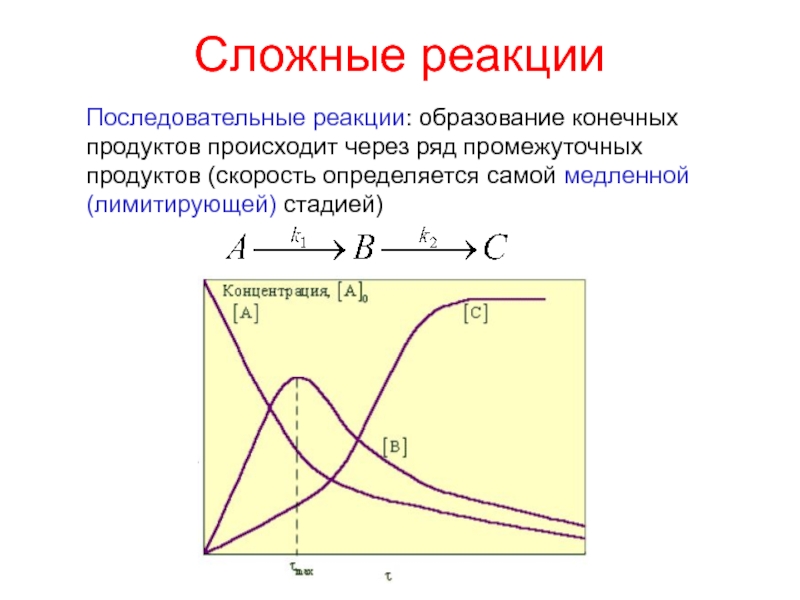
Слайд 20Сложные реакции
Последовательные реакции: образование конечных продуктов происходит через ряд промежуточных
продуктов (cкорость определяется самой медленной (лимитирующей) стадией)
Слайд 21Цепные реакции
– реакции, которые вызываются свободными радикалами, под действием которых
неактивные молекулы превращаются в активные
Неразветвленные ц. р.
Зарождение цепи (инициирование):
Развитие
цепи:Обрыв цепи:
H2 + Cl2 → 2HCl
Cl2 → 2Cl•
H2 + Сl• → HCl + H•
H• + Cl2 → HCl + Cl•
H• + H• → H2
H• + Cl• → HCl
Слайд 22Цепные реакции
Разветвленные ц. р.
Зарождение цепи (инициирование):
Развитие цепи:
Разветвление цепи:
Обрыв цепи
(в
том числе на стенке сосуда):
H2 + O2 → 2H2O
H2 +
O2 → 2HO•H2 + HO• → H2O + H•
H• + O2 → HO• + O••
O•• + H2 → H• + HO•
H• + HO• → H2O
Нобелевская премия Н.Н. Семенов и С. Хиншельвуд
Слайд 24Катализ
Катализаторы – вещества, ускоряющие химическую реакцию.
Ингибиторы – вещества, замедляющие химическую
реакцию.
Катализ – изменение скорости реакции под действием катализатора.
Катализатор
ускоряет как прямую
реакцию, так и обратную,
не смещает равновесие, но способствует его установлениюне расходуется в реакции
Слайд 26Гетерогенный катализ
Реагирующая система и катализатор
находятся в разных фазах
Стадии гетерогенной
каталитической реакции
диффузия частиц к катализатору
адсорбция на поверхности
катализатора
химическая реакция
десорбция
диффузия продуктов
от
поверхностиСлайд 27Химическое равновесие
– для растворов
– для газов
Константа равновесия (К) –
мера глубины
протекания процесса
(степени превращения исходных веществ в конечные)
aA +bB ⮀ cC
+ dDСлайд 29Принцип Ле-Шателье
Если на систему, находящуюся в состоянии равновесия, оказывается внешнее
воздействие,
то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
(качественная оценка
смещения равновесия)Слайд 30Влияние внешних условий
на равновесие
Концентрация
В систему добавлено исходное вещество: равновесие смещается
вправо
В систему добавлен продукт реакции: равновесие смещается влево
Слайд 31Влияние внешних условий
на равновесие
Общее давление (для газовых реакций)
Увеличение общего давления
смещает равновесие в сторону процесса, идущего с уменьшением числа молей
газообразных веществN2 + 3H2 ⮀ 2NH3 p↑ →
CH4 + 2H2O(г) ⮀ CO2 + 4H2 p↑ ←