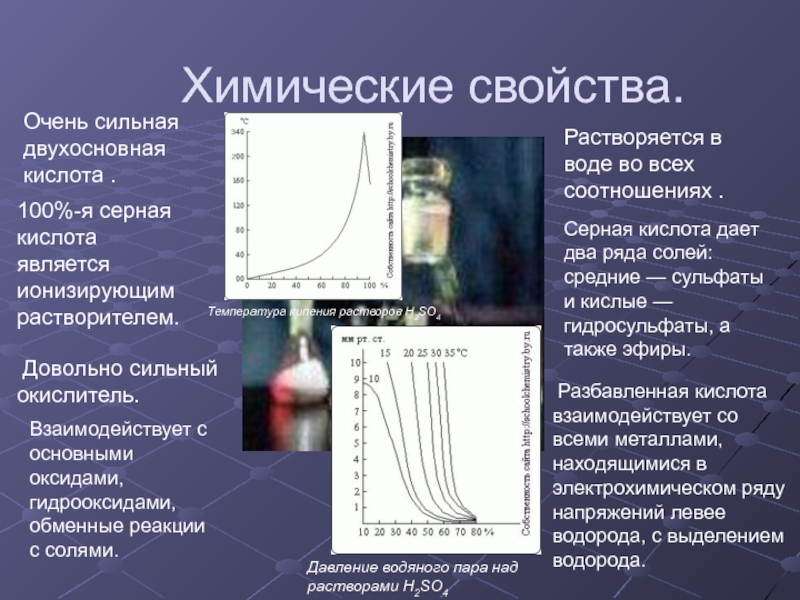
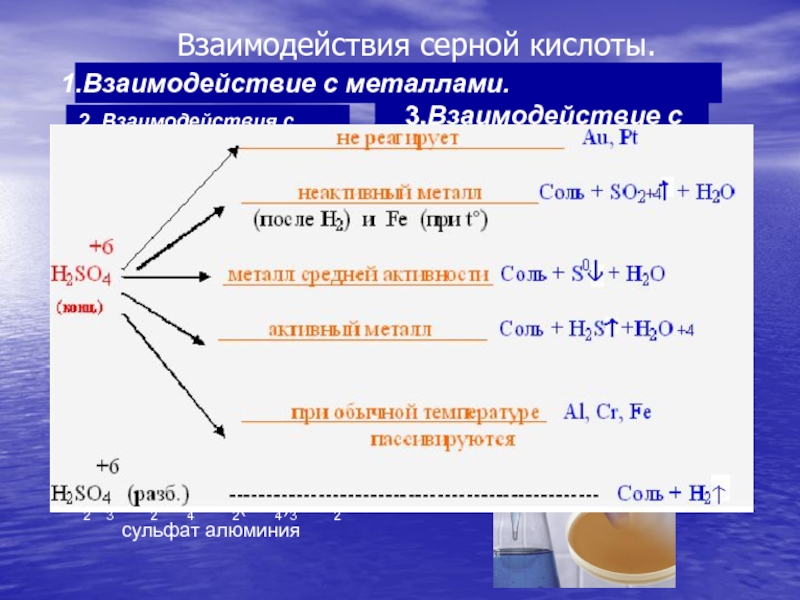
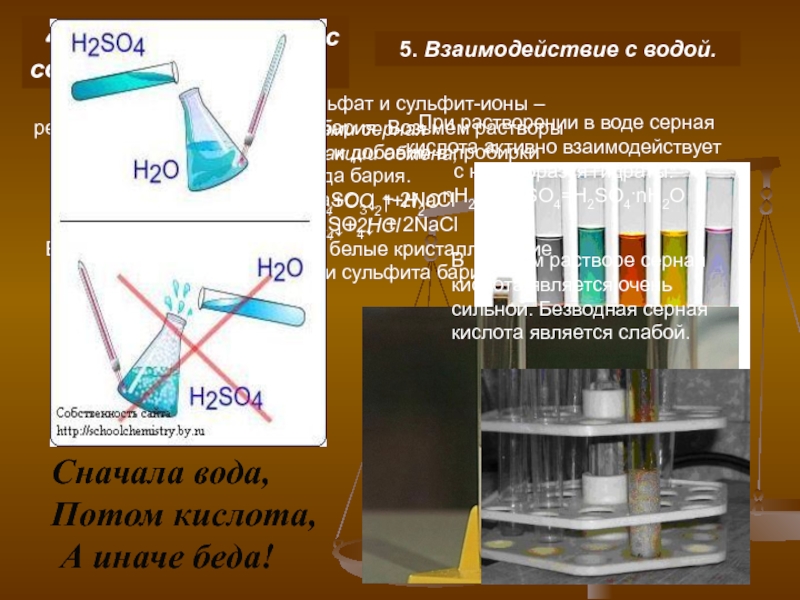
ибн Хайяну (Геберу), жившему в VIII–IX вв. До XIV в.
Пирит в природе
под действием кислорода и воды постепенно окисляется и образует сульфаты двух- и трехвалентного железа и серную кислотуИз сернокислого железа готовили чернила, использовали его при крашении тканей, в иконописи, при золочении, обработке кожи и в медицине.
На Руси серная кислота появилась в XVII в.
Она производилась для нужд аптек и алхимических лабораторий.
Впервые разрешение на производство серной кислоты и "духа купоросного", т.е. серного ангидрида, было дано Петром I в 1718 г.
Первые заводы по производству квасцов были построены на Руси в XVIII веке.
В конце XVIII в. отдельные заводы изготовляли в год по 1-2т.
Первое современное промышленное производство серной кислоты "контактным методом" было создано в России на Тентелевском химическом заводе в Санкт-Петербурге в 1903 году