Слайд 1Система
мессенджеров
в сигнальной
трансдукции
ЛЕКЦИЯ 6
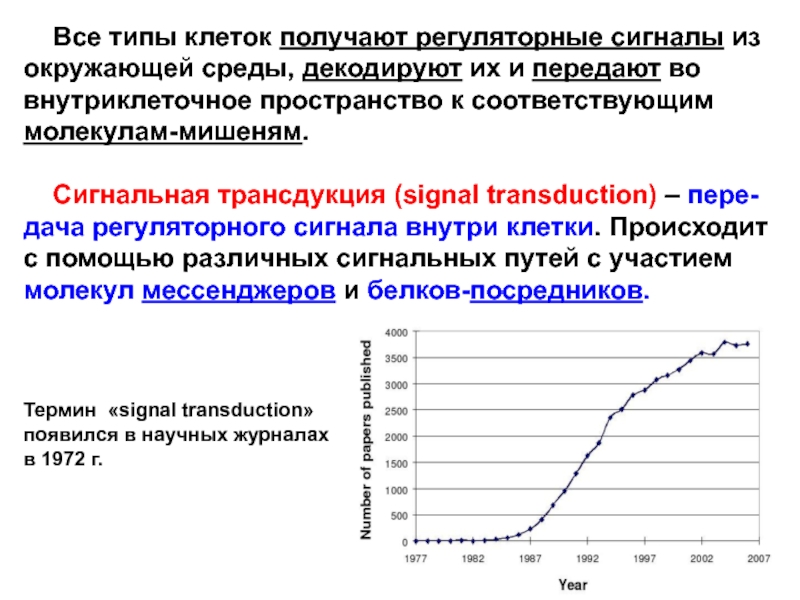
Слайд 2 Все типы клеток получают регуляторные сигналы из окружающей
среды, декодируют их и передают во внутриклеточное пространство к соответствующим
молекулам-мишеням.
Сигнальная трансдукция (signal transduction) – пере-дача регуляторного сигнала внутри клетки. Происходит с помощью различных сигнальных путей с участием молекул мессенджеров и белков-посредников.
Термин «signal transduction»
появился в научных журналах
в 1972 г.
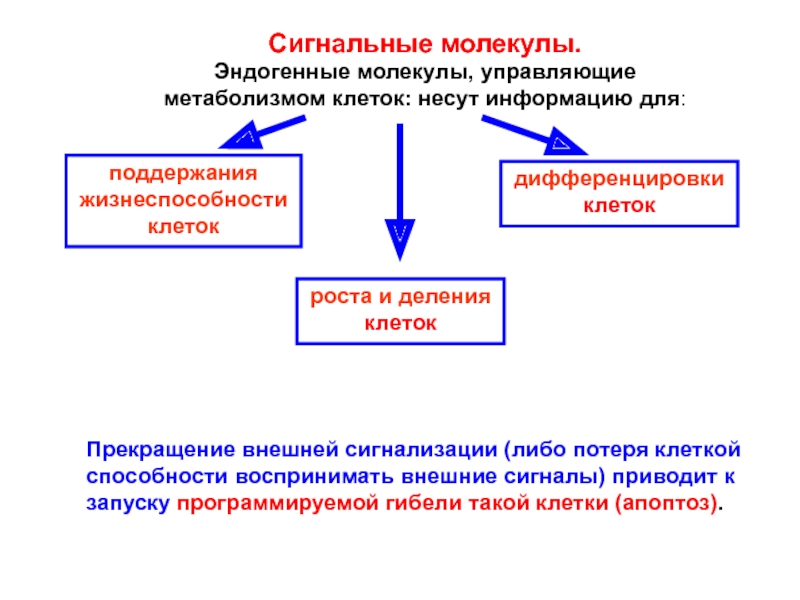
Слайд 3Сигнальные молекулы.
Эндогенные молекулы, управляющие
метаболизмом клеток: несут информацию для:
поддержания
жизнеспособности
клеток
роста и деления
клеток
дифференцировки
клеток
Прекращение внешней сигнализации (либо потеря клеткой
способности воспринимать внешние сигналы) приводит к запуску программируемой гибели такой клетки (апоптоз).
Слайд 4 Регуляторные (управляющие) сигналы поступают в
двух направлениях:
1. Снаружи ? внутрь.
Метаболизм
каждого типа клеток определяет комплект рецепторов, воспринимающих сигналы, предназначенные именно этому типу клеток (в соот-ветствии с её функциональной специализацией).
2. Изнутри ? к наружи.
Определенные типы клеток сами секретируют сиг-нальные молекулы. Эти молекулы действуют на:
близлежащие клетки (цитокины, парактринный эф-
фект);
на большие расстояния (гормоны, эндокринный эф-
фект).
Слайд 5 Каждый тип клеток имеет специфический набор (комплект,
паттерн) рецепторов. Это даёт возмож-ность каждому типу клеток специфически отвечать
на одновременное воздействие нескольких типов сиг-нальных молекул, «выбирая» из этого потока сигна-лов только те, которые важны для её жизнедеятель-ности.
Комплект рецепторов для данного типа клеток – величина постоянная (сформировался в ходе эволю-ции). Число рецепторов и их аффинность к лигандам может изменяться (элемент регуляции метаболизма).
Слайд 6 Внеклеточные сигнальные молекулы (первичные мессенджеры) действуют как
на коротких, так и на длинных дистанциях:
Короткие дистанции:
- прямой контакт клеточных мембран;
паракринная сигнализация: одни клетки секретируют сигналь-
ные молекулы, которые действует на соседние однотипные
клетки (сигнальные молекуы не поступают в кровоток);
аутокринная сигнализация – передача сигнальной молекулы
самой себе - посредством рецепторов к этой молекуле,
которые клетка несёт на своей собственной поверхности.
Длинные дистанции:
синаптическая передача эл. сигнала вдоль аксона с высвобож-
дением в синапсе нейромедиатора/нейротрансмиттера;
эндокринная сигнализация: химический сигнал (лиганд) – син-
тезируется в эндокринных железах и секретируется в кровоток,
с помощью которого лиганд доставляется к клеткам-мишеням.
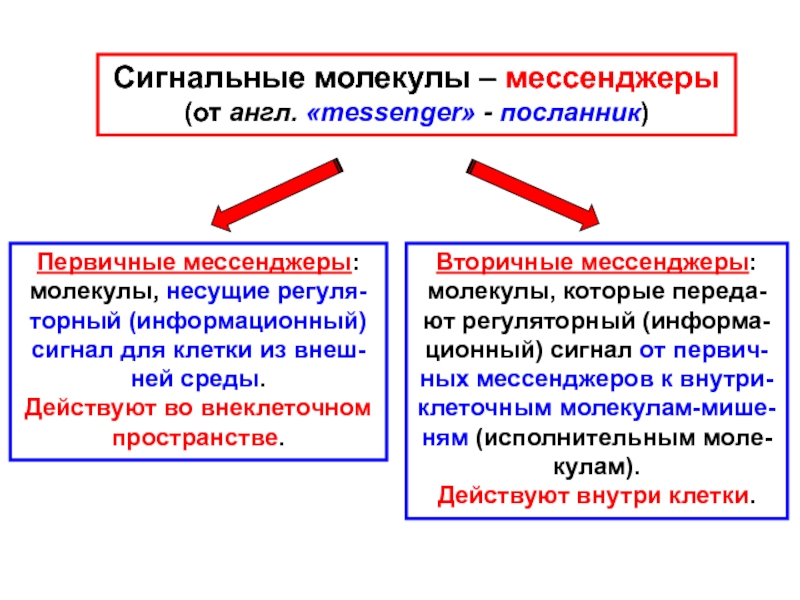
Слайд 7Сигнальные молекулы – мессенджеры
(от англ. «messenger» - посланник)
Первичные мессенджеры:
молекулы,
несущие регуля-
торный (информационный)
сигнал для клетки из внеш-
ней среды.
Действуют во
внеклеточном
пространстве.
Вторичные мессенджеры:
молекулы, которые переда-
ют регуляторный (информа-
ционный) сигнал от первич-
ных мессенджеров к внутри-
клеточным молекулам-мише-
ням (исполнительным моле-
кулам).
Действуют внутри клетки.
Слайд 8 Эрл Уилбур Сазерленд
(Earl Wilbur Sutherland)
1915-1974
Концепция первичных
и вторичных
мессенджеров была сформулирована
в первой половине 60-х годов ХХ
в.
в ходе изучения молекулярных меха-
низмов передачи регуляторного сиг-
нала от глюкагона или адреналина на
внутриклеточный ферментативный
каскад гликогенфосфорилазы печени
и мышц.
Нобелевская премия по физиологии
и медицине (1971 г.) «… за открытия,
касающиеся механизмов действия
гормонов».
Э. Сазерленд открыл «посредниче-
скую» роль цАМФ во внутриклеточной
передаче сигала от рецепторов глюка-
гона и адреналина к гликогенфосфо-
рилазе: цАМФ активирует протеинкин-
азу, которая переводит фермент в
активную форму.
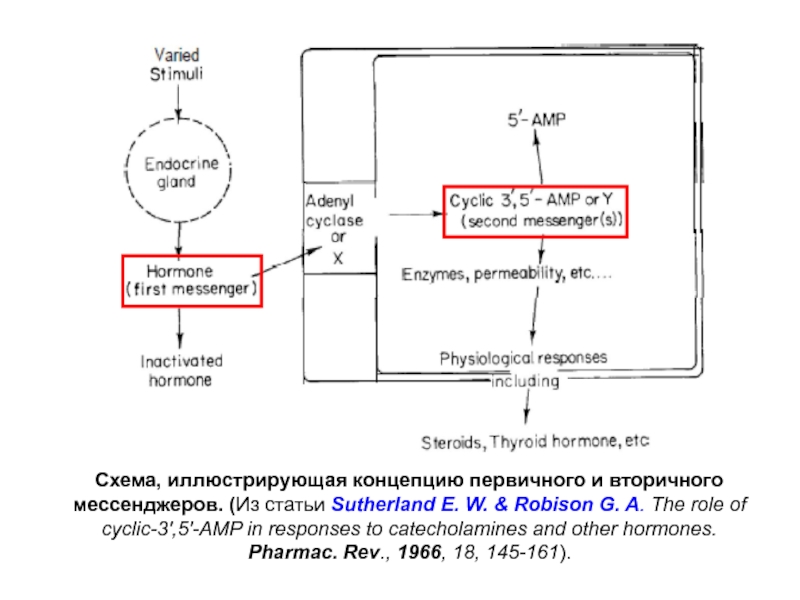
Слайд 9Схема, иллюстрирующая концепцию первичного и вторичного мессенджеров. (Из статьи Sutherland
E. W. & Robison G. A. The role of cyclic-3',5'-AMP
in responses to catecholamines and other hormones. Pharmac. Rev., 1966, 18, 145-161).
Слайд 10 Первичные мессенджеры – группа эндогенных сигнальных биомолекул (лигандов),
имеющих различ-ное химическое строение, действующие на клетку путем высокоаффинного связывания
со специфичес-кими рецепторами (поверхностными или внутрикле-точными) и способные активировать механизм пере-дачи регуляторного сигнала внутрь клетки. Внутрь клетки не проникают.
Основные группы первичных мессенджеров:
1. Гормоны. Синтезируются специализировнными органами или клетками, отдаленными от клеток-мише-ней. Транспортируются от места синтеза к местам действия по крови. Действуют посредством высоко-аффинного связывания со специфическими рецепто-рами.
Слайд 11 2. Факторы роста. Несут митогенный сигнал - стиму-лируют
митоз и деление клеток. Для факторов роста у клеток есть
специфические рецепторы. Факторы роста способны инициировать апоптоз и дифферен-цировку клеток. Действуют, как правило, на неболь-шом расстоянии – на соседние клетки (паракринно).
В отличие от гормонов, эффекты факторов роста могут длиться несколько суток.
3. Цитокины (IL, IFN, TNF, CSF). Внеклеточные, срав-нительно небольшой массы белки (10 – 30 кДа). Регу-лируют: функции клеток иммунной и гемопоэтической систем, переносят межклеточные сигналы в очаге вос-паления, участвуют в эмбриональном развитии мно-гих тканей. Действуют, в основном, паракринно, но могут и эндокринно.
Слайд 12 4. Нейромедиаторы (нейротрансмиттеры) . Их выде-
ление и связывание
происходит внутри синаптической
щели. Эффект медиатора (возбуждающий или тормозя-
щий), определяется
природой ионного канала, сопря-
женного с рецептором нейромедиатора.
5. Вазоактивные агенты. Гистамин, серотонин и бра-
дикинина, а также эйкозаноиды: простагландины,
тромбоксаны и лейкотриены. Все они служат для по-
вышения проницаемости стенок сосудов в очаге вос-
паления для проникновения из кровотока лейкоцитов.
Действуют паракринно и аутокринно.
Слайд 13 Вторичные мессенджеры – малые гидрофильные молекулы, быстро
и в больших количествах синтези-руются внутри клетки в ответ на
активацию рецептора первичными мессенджерами.
Служат для внутриклеточной передачи и усиления сигнала. Действуют в течение короткого времени и инактивируются различными способами.
Основные свойства вторичных мессенджеров:
имеют относительно небольшую молекулярную мас-
су, что позволяет мессенджеру быстро диффундиро-
вать по цитоплазме;
способны быстро разрушаться (в соответствии со
временем передачи сигнала), либо, как ионы Са2+,
быстро откачиваться из цитоплазмы до исходной
концентрации: 10-7 М.
Слайд 14 Семейство вторичных мессенджеров
1. цАМФ.
Синтезируется с участием аденилатцикла-зы из АТФ. Синтез происходит быстро, но
непродол-жительно. цАМФ – аллостерический активатор цАМФ-зависимой протеинкиназы А (ПКА).
2. цГМФ. Синтезируется двумя разновидностями гуанилатциклазы - мембранной и растворимой в цито-плазме.
Мембранный фермент активируется артериальным натрийуретичеcким фактором и кишечным пептидом – гуанилином. Активатор растворимой формы фер-мента – внутриклеточный оксид азота (NO).
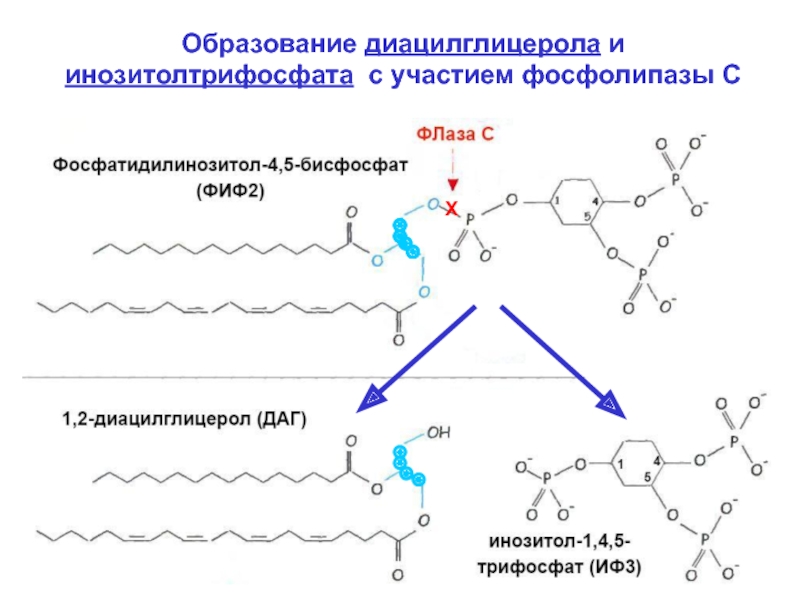
Слайд 15 3. Диацилглицерол (ДАГ). Является первым продук-
том действия
фосфолипазы С (ФЛазы С) на мембран-
ный (минорный) фосфолипид фосфатидилинозитол-2-
фосфат (ФИФ2).
Будучи гидрофобным, ДАГ остаётся во
внутреннем слое плазматической мембраны. Там ДАГ
взаимодействует с серин-треониновой протеинкина-
зой С (ПКС) и активирует её.
4. Инозитол-3-фосфат (ИФ3) – второй продукт, обра-
зуемый ФЛазой С. Является отщепленным головным
концом ФИФ2. Благодаря отрицательному заряду, ИФ3
гидрофилен. Он диффундирует по цитоплазме и свя-
зывается с ИФ3-активируемыми Са2+-каналами мембран
ЭР, чем стимулирует выход Са2+ в цитоплазму. Увели-
чение [Ca2+] также необходимо для активации ПКС: не-
активная ПКС локализована в цитоплазме. Присоеди-
нив Са2+, ПКС встраивается в цитоплазматическую ме-
мбрану, связываясь с заряженной головкой ФС (-q).
Слайд 16Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С
Х
Слайд 17 5. Ионы Са2+. В цитоплазме нестимулированной
клетке [Ca2+]
= 10-7 М. Во всех клетках повышение
[Ca2+] до величины
10-6 М, происходит в ответ на сти-
муляцию рецепторов, сопряженных с G-белком, что
приводит к образованию ИФ3 (см. выше). Ионы Са2+
действуют:
а). прямо cо специфическими сайтами в молекулах
ПК, образующих определенное семейство (напри-
мер: ПКС);
б). опосредованно, c Са2+-связывающим белком каль-
модулином. Комплекс Са2+-кальмодулин (связыва-
ет 4 иона Са2+) активирует ПК, принадлежащие к
другому семейству: к кальмоулин-зависимым ПК.
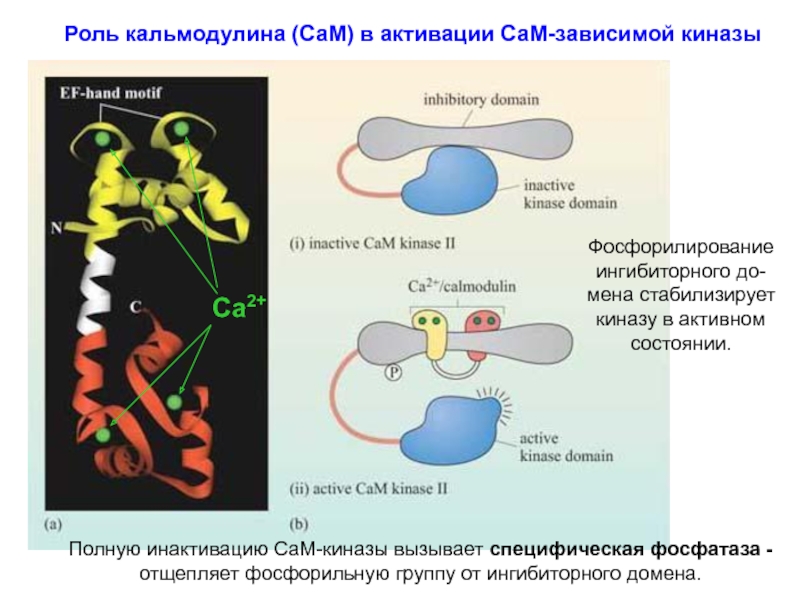
Слайд 18 Роль кальмодулина (СаМ) в активации СаМ-зависимой киназы
Фосфорилирование ингибиторного до-мена стабилизирует киназу в активном состоянии.
Полную инактивацию
СаМ-киназы вызывает специфическая фосфатаза -
отщепляет фосфорильную группу от ингибиторного домена.
Са2+
Слайд 19 6. Оксид азота (NO). Это газообразное соединение,
являющееся
свободным радикалом (имеет неспарен-
ный электрон), что придает ему высокую реакционную
способность: время жизни < 6-10 с. NO самая «малень-
кая» молекула среди известных вторичных мессендже-
ров.
NO синтезируется из аргинина с участием фермента
NO-синтазы. Три изоформы NO-синтазы: две формы
конститутивные: еNOS (эндотелий сосудов) и nNOS
(нервная система) и одна форма – индуцибелная (iNOS).
iNOS появляется при воспалении, иммунных и некото-
рых других реакциях в макрофагах и в ряде других
клетках (гепатоцитах). NO легко проникает через мемб-
рану и влияет на соседние клетки без участия рецепто-
ров. NO может действовать как аутокринно (в той же
клетке), так и паракринно (диффундировать к сосед-
ним клеткам).
Слайд 20 Мишень NO - растворимая (цитоплазматическая) гуанилатциклаза. Необычность этого
фермента: он катализирует образование вторичного мессенджера – цГМФ, но активируется
другим вторичным мессенджером – NO. Мишенью цГМФ является протеинкиназа G (ПКG).
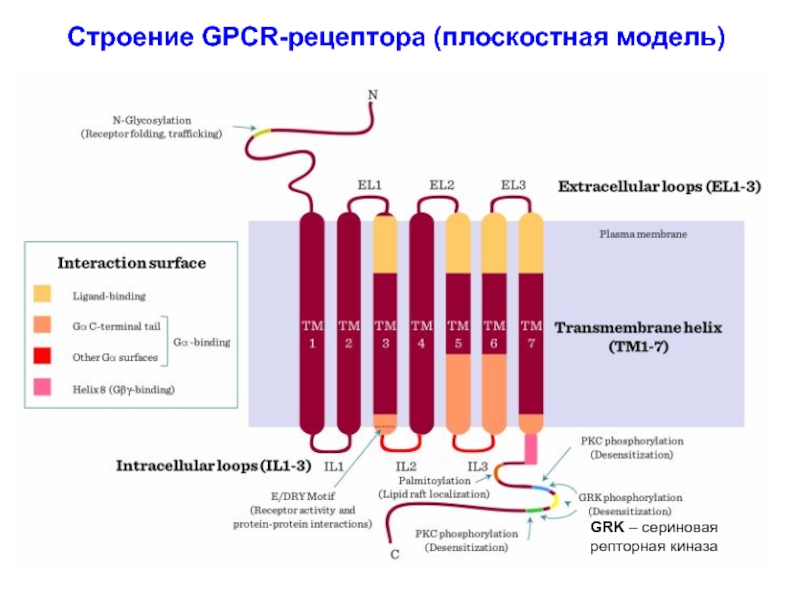
Слайд 21I. Основные структурные элементы мембранных рецепторов (рецепторов клеточной поверхности
Рецепторы - гликопротеиды. Распознав специфический лиганд (первичный мессенджер) и связавшись
с ним, рецептор изменяет свою конформацию, что необходимо для передачи сигнала внутрь клетки на молекулу-мишень, часто с помощью вторичного мессенджера.
Внеклеточный домен. Его формирует N-конец цепи, функция – распо-знать и связаться с молекулой первичного мессенджера.
Трансмембранный домен. Состоит из одной или нескольких α-спиралей (ацетилхолиновый рецептора формирует трансмембранную пору или ионный канал). При связывания лиганда домен меняет свою конформа-цию, влияя на конформацию внутриклеточного домена, либо пропускает специфический ион.
Внутриклеточный (цитоплазматический) домен. Формирует С-конец цепи, функция - передача сигнал от первичного мессенджера внутрь клетки. Два пути:
- домен связывается с внутриклеточными сигнальными белками (посредниками), которые доставляют сигнал к месту - молекуле-мишени;
- домен может сам обладать ферментативной активностью, либо связы-вается с внутриклеточным ферментом и активирует его.

Слайд 22Классификация
рецепторов клеточной поверхности
(рецепторов клеточной мембраны)
Рецепторы, сопряженные с
G белками (G-protein
coupled receptors – GPCR) или семиспиральные
рецепторы.
2. Каталитические рецепторы – обладают собствен-
ной тирозин- и серин/треонин-протеинкиназной
активностью, либо гуанилатциклазной активностью.
3. Рецепторы не каталитические – после активации
лигандом приобретают способность взаимодейст-
вовать с цитозольными тирозиновыми протеин-
киназами, активируя их.
4. Регулируемые ионные каналы (лиганд-активируе-
мые ионные каналы).
Слайд 231. Рецепторы, сопряженные с G белками (G-protein
coupled receptors
– GPCR) или семиспиральные
рецепторы.
Образованы
одной полипептидной цепью, 7 раз пронизываю-щей мембрану. Трансмембранные фрагменты – α-спирали (20-28 гидрофобных аминокислот).
Самый эволюционно древний класс рецепторов, известно около тысячи различных лигандов (в т.ч. к этому классу относят-ся «орфан-рецепторы»). Типичные лиганды: адреналин, норадре-налин, пептидные гормоны (в т.ч глюкагон) - действуют через β-адренорецепторы, а также нейропептиды, дофамин, опиоиды.
После активации рецепторы обретают способность взаимо-действовать с гетеротримерными G-белками, которые связаны с внутренним липидным слоем плазматической мембраны. G-бел-ки состоят из трех субъединиц: α-, β- и γ-. Их активация приводит к диссоциации α-субъединцы от β,γ −димера. Основной эффект оказывает α-субъединица (её разновидности):
а). влияет на активность аденилатциклазы, которая синтезирует
цАМФ (Gs и Gi-белки, содержащие Gαs- и Gαi – субъединицы).
б). активирует ФЛазу Сγ : синтез ДАГ и И3Ф (Gαq-белки).
Слайд 24Строение GPCR-рецептора (плоскостная модель)
GRK – сериновая
репторная киназа
Слайд 253D-модель GPCR - рецептора
Плоскость слайда – соответствует наружной поверхности клеточной
мембраны.
Красным цветом обозначены участки пептидной цепи, обращенные во внекле-
точное
пространство. Зеленые цилиндры – трансмембранные α-спиральные
участки белковой цепи.
Молекула адреналина,
связавшаяся с рецептором
Синим цветом обозначе-
ны участки пептидной цепи,
обращенные в сторону цитоплазмы.
Слайд 262. Каталитические рецепторы – обладают собственной
тирозин- или серин/треонин-протеинкиназной
актив-
ностью (рецептор-ассоциированные киназы) и гуа-
нилатциклазной активностью.
Вторая по численности группа рецепторов после GPCR. Рецеп-торы имеют один трансмембранный домен. В результате связы-вания с лигандом, конформация всей молекулы рецептора меня-ется, что приводит к димеризации рецептора и «включению» во внутриклеточных доменах собственной ферментативной активности:
2.а. протеинкиназной (ПК) активности (тирозинкиназной активности);
2.б. гунилатциклазной (ГЦ) активности.
Слайд 27 2.а. Рецепторы с тирозинкиназной активностью.
Важнейшие лиганды: инсулин и различные факторы роста.
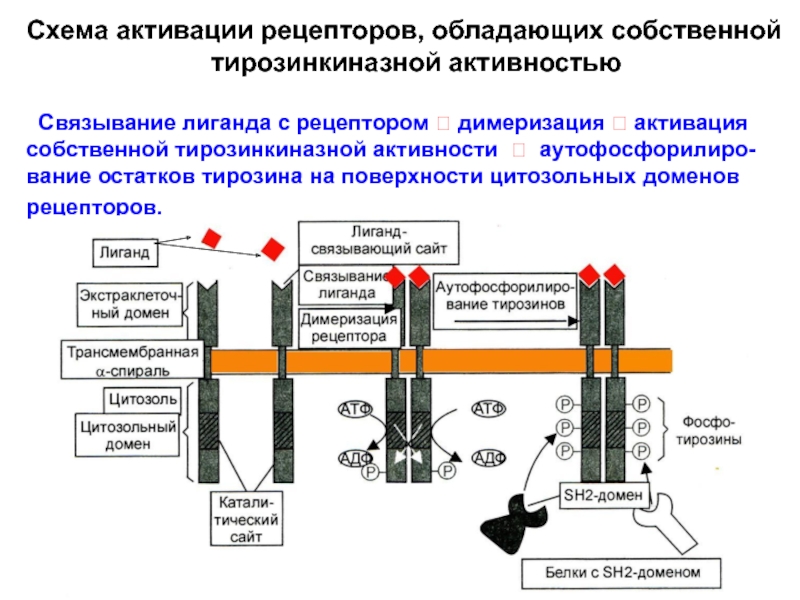
Характерное проявление их активации и изменения конформа-ции – образование димеров. Как гомодимеров (простое усиление сигнала), так и гетеродимеров - два разных рецептора из этого же класса (увеличение числа внутриклеточных сигнальных путей, запускаемых одним лигандом).
В результате димеризации рецепторов, в их цитозольных до-менах «включается» тирозинкиназная активность. Благодаря ей происходит аутофосфорилирование остатков тирозина цито-зольных доменов - на их поверхности появляются фосфотиро-зины (докинг-участки), по которым связываются различные внутриклеточные сигнальные белки – посредники, содержащие SH2-домены.
Слайд 28Схема активации рецепторов, обладающих собственной
тирозинкиназной активностью
Связывание лиганда с рецептором ? димеризация ? активация собственной тирозинкиназной активности ? аутофосфорилиро-вание остатков тирозина на поверхности цитозольных доменов рецепторов.
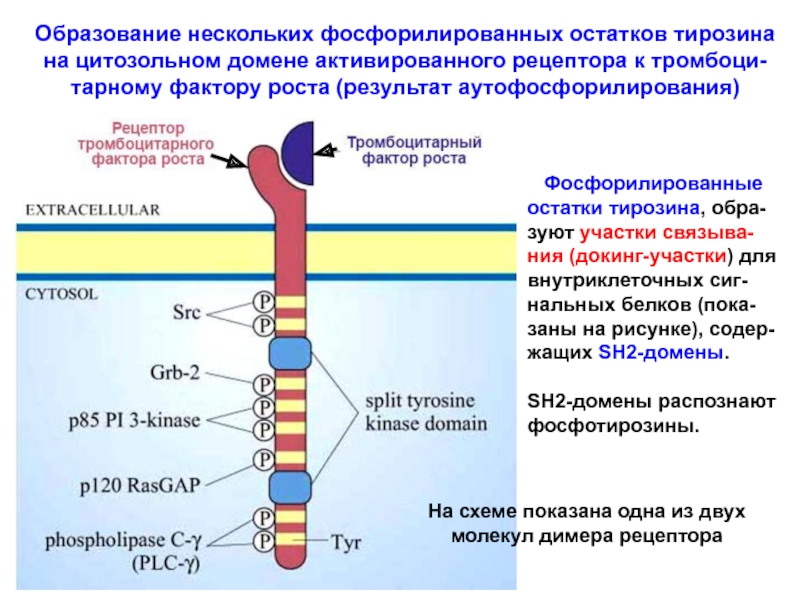
Слайд 29Образование нескольких фосфорилированных остатков тирозина
на цитозольном домене активированного рецептора
к тромбоци-
тарному фактору роста (результат аутофосфорилирования)
Фосфорилированные
остатки тирозина,
обра-зуют участки связыва-ния (докинг-участки) для внутриклеточных сиг-нальных белков (пока-заны на рисунке), содер-жащих SH2-домены.
SH2-домены распознают
фосфотирозины.
На схеме показана одна из двух
молекул димера рецептора
Слайд 30 Пример гетеродимера: классический рецептор к фактору роста
эпидермиса (ФРЭ) + его разновидность (ErbB-3) = ФРЭ + ErbB-3.
Фосфотирозины в ErbB-3 распознаются SH2–доменами в составе фосфатидилинозитол-3-киназы, которая при этом акти-вируется: два пути, включаемые одним лигандом – вактором роста эпидермиса.
NB: Тирозинкиназная активность м.б. «выключена» в резуль-тате фосфорилирования внутриклеточного домена рецептора по остаткам серина и треонина под действием ПКА и ПКС.
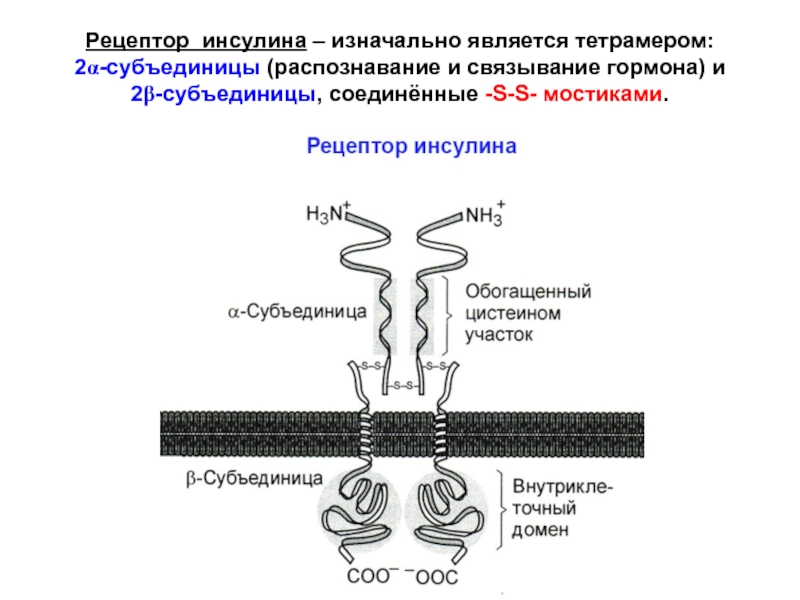
Слайд 31Рецептор инсулина – изначально является тетрамером:
2α-субъединицы (распознавание и связывание
гормона) и
2β-субъединицы, соединённые -S-S- мостиками.
Слайд 32 2.б. Рецепторные гуанилатциклазы (ГЦ) – катализируют синтез вторичного
мессенджера цГМФ (гуанозин-3’5’-монофос-фата)
Рецептор локализован в цитоплазматической мембране.
Цито-зольный домен обладает активностью ГЦ: ГТФ ? цГМФ
Рецептор имеет две изоформы.
1 изоформа: лиганд - артериальный натрийуретичеcкий фактор (АНФ). АНФ высвобождается из эндотелиоцитов предсердий, когда существенно увеличивается объем перекачиваемой серд-цем крови. АНФ действует на клетки собирательных трубочек почек и увеличивает в них концентрацию цГМФ. В результате почки усиливают выделение ионов Na+ (и воды). Потеря воды снижает объем крови, что ослабляет стимул, вызвавший выделе-ние АНФ.
В кровеносных сосудах цГМФ действует на гладкую мускула-туру цГМФ, вызывает вазодилатацию.
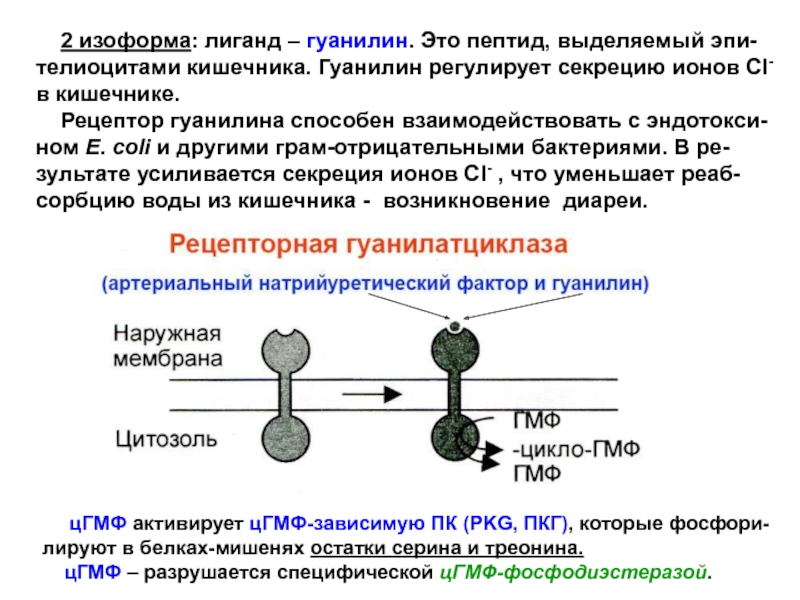
Слайд 33 2 изоформа: лиганд – гуанилин. Это пептид, выделяемый
эпи-телиоцитами кишечника. Гуанилин регулирует секрецию ионов Cl- в кишечнике.
Рецептор гуанилина способен взаимодействовать с эндотокси-ном E. coli и другими грам-отрицательными бактериями. В ре-зультате усиливается секреция ионов Cl- , что уменьшает реаб-сорбцию воды из кишечника - возникновение диареи.
цГМФ активирует цГМФ-зависимую ПК (PKG, ПКГ), которые фосфори-лируют в белках-мишенях остатки серина и треонина.
цГМФ – разрушается специфической цГМФ-фосфодиэстеразой.
Слайд 343. Рецепторы не каталитические – после активации
лигандом приобретают
способность взаимодейст-
вовать с цитозольными тирозиновыми протеин-
киназами.
Рецептор рекрутирует внутриклеточные
киназы. (Рецепторы цитокинов)
Связывание лиганда с рецептором изменяет его конформа-цию и вызывает димеризацию. Типичные лиганды этого класса рецепторов: цитокины. Цитозольные домены рецептора приобрета-ют способность нековалентно взаимодействовать с внутрикле-точными протеинкиназами и активировать их:
- с тирозиновой киназой Src (прикрепелена к внутреннему слою плазматической мембраны);
- с тирозиновой киназой Янус-киназой (JAK, растворима в цито-плазме, содержит два активных центра: киназный и псевдокиназ-ный).
Обе киназы фосфорилируют остатки тирозина в составе цито-зольных доменов рецептора. Фосфотирозины нужны для связы-вания внутриклеточных белков-посредников (имеющих SH2-до-мены), которые передают сигнал «вниз по течению» к молекулам-мишеням.
Слайд 35 JAK действуют посредством транскрипционных факторов:
STAT - signal transducers
and activation transcription ). Неактив-ный STAT находится цитоплазме. Связывание STAT
с фосфоти-розином рецептора создаёт условия для его фосфорилирования с участием JAK. [JAK сначала фосфорилирует остатки тиро-зина в рецепторе, затем в STAT]. Активный (фосфорилирован-ный) STAT образует гомодимер, который проникает в ядро и вызывает экспрессию специфических генов.
Важно: к фосфотирозинам цитозольного домена рецептора цитоки-на эритропоэтина (образовавшимся с участием JAK) может также присоединяться белок Gbr2 (Growth factor receptor-bound protein 2) . После фосфорилирования с участием JAK, Gbr2 запускает MAPK-каскад (подобно инсулину), что также изменяет экспрессию специфических генов. Ещё один пример того, как один цитокин может одновременно запускать два сигнальных внутриклеточных пути: JAK-STAT-путь и МАРК-каскад.
Слайд 36Схема инициации двух сигнальных путей эритропоэтином
путём образования гетеродимера из
рецепторов с различными
свойствами
Путь а) – активирует синтез белков,
необходимых
для созревания эритро-
цитов.
Путь б) – JAK активирует белок Grb-2,
что запускает МАРК-каскад
Слайд 374. Регулируемые ионные каналы (лиганд-активируе-
мые ионные каналы или
каналы, сопряженные с ре-
цептором).
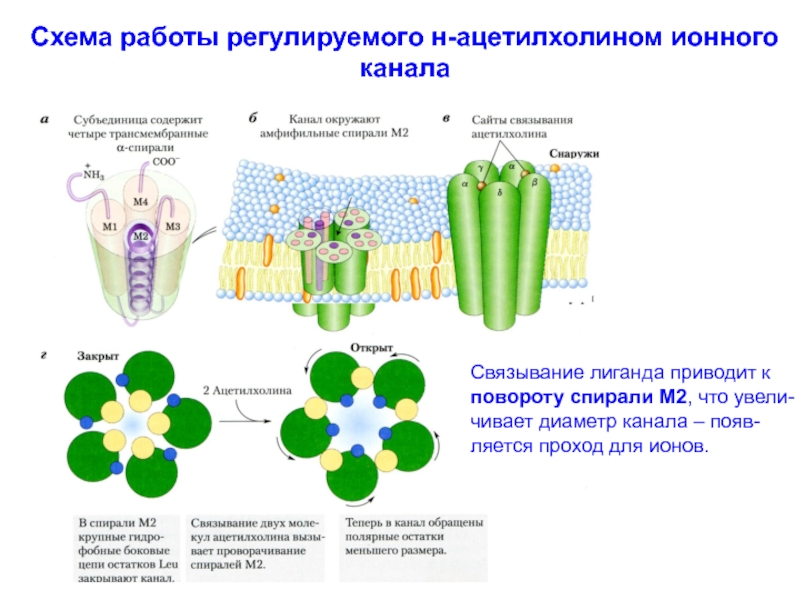
Типичный пример: н-ацетилхолиновый рецептор.
Молекула рецептора имеет бочкообраный силуэт и образована пятью субъединицами (2α, β −, γ− и δ- субъединицы). В состав каждой субъединицы входит по 4 α-спирали. Их С- и N- концы обращены в цитоплазму. Субъединицы окружают одну трансмем-бранную пору. Есть два участка для связывания двух молекул ацетилхолина, расположенных на двух α-субъединицах со стороны поры. Ниже расположена «заслонка», образуемая α-спиралью. При связывании с ацетилхолином, рецептор претерпе-вает конформационную перестройку, что вызывает смещение «заслонки» - пора открывается и ионы Na+ входят в цитоплазму.
Ионные каналы открываются на несколько миллисекунд, но за это время через канала проходит поток ионов, V=10 млн. ионов/с.
Слайд 38Схема работы регулируемого н-ацетилхолином ионного
канала
Связывание лиганда приводит к
повороту спирали
М2, что увели-
чивает диаметр канала – появ-
ляется проход для ионов.
Слайд 39Четыре основных класса рецепторов
цитоплазматической мембраны
Слайд 40 Основные механизмы
активации мембранных
рецепторов
Конформационная перестройка (рецепторы-ионные каналы и
GPCR);
Димеризация (рецепторы с собственной ферментативной активностью и рецепторы, рекрутирующие внутриклеточные ферменты).
Основные механизмы инактивации мембранных
рецепторов
1. Деградация лиганда. Холинэстераза разрушает ацетилхолин, связанный со своим рецептором.
2. Секвестрация лиганда. Лиганд связывается с внеклеточным белком, содержащим лиганд-связывающий домен. Такой белок удаляет лиганд с рецептора.
3. Десенситизация рецептора. GPCR может быть фосфорилиро-ван по остаткам серина в цитозольном домене при помощи внутриклеточной ПКС. По этим участкам связывается внутриклеточный белок аррестин. Комплекс рецептор-аррес-тин уже не способен передавать сигнал «низ по течению». Комплекс рецептор-аррестин поглощается путём эндоцитоза.
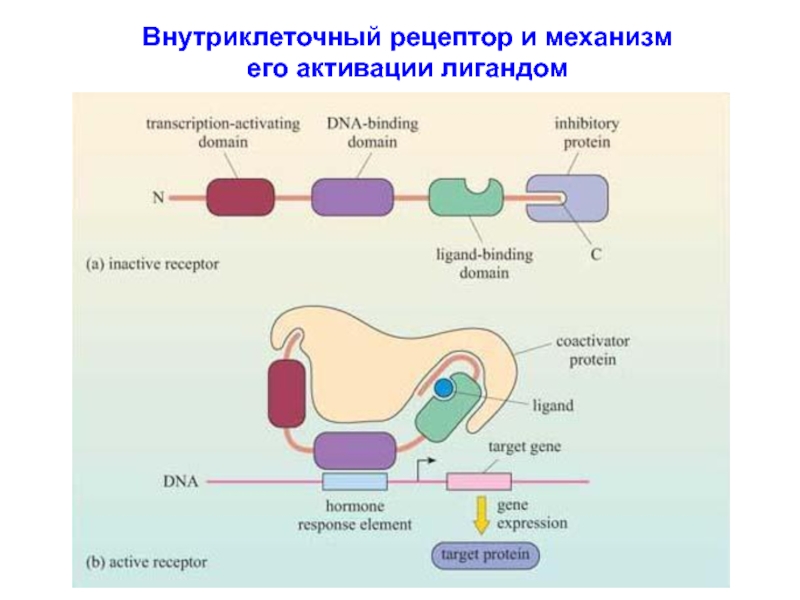
Слайд 41 II. Внутриклеточные рецепторы
Связывают малые, липофильные молекулы, которые легко преодале-вают барьер цитоплазматической
мембраны: стероидные и тиреидные гормоны, а также витамин Д. Локализация: цитоплазма, поверхность ядра и внутри ядра.
Строение рецептора:
домен для распознавания и связывания лиганда
ДНК-связывающий домен
домен активации транскрипции
В отстутствии лигандов, рецепторы находятся в неактивной конформа-ции (поддерживается с помощью ингибирующих белков – шаперонов/Hsp). Связывание лиганда индуцирует активную конформацию рецептора, что сопровождается диссоциацией ингибирующего белка. Активированный лиганд-рецепторный комплекс диффундирует в ядро где связываться с участком ДНК посредством своего ДНК-связывающего домена. Помимо этого, лиганд-рецепторный комплекс способен связываться с другими белками: белками-коактиваторами транскрипции.
Участок ДНК, с которым связывается комплекс лиганд-рецептор, явля-ется промотер-регионом таргетного гена и называется гормон-респонсив-ным элементом = hormone response element (HRE).

Слайд 42Внутриклеточный рецептор и механизм
его активации лигандом
Слайд 43ТРАНСДУКЦИЯ СИГНАЛА ВНУТРИ КЛЕТКИ
ПОСРЕДСТВОМ ВТОРИЧНОГО МЕССЕНДЖЕРА - цАМФ
Гормоны, увеличивающие внутриклеточную концентрацию
цАМФ: адреналин (мышцы) и глюкагон (печень,
адипоциты).
В адипоцитах глюкагон стимулирует липолиз (гидролиз ТАГ с учас-
тием гормончувствительной ТАГ-липазы).
Адренаин действуют посредством β-адренорецепторов (разно-
видность GPCR). Глюкагон – посредством другой разновидности
GPCR.
Активированный лигандом GPCR, изменяет конформацию, что
сообщает его цитозольному домену способность взаимодейство-
вать с гетеротрименым G-белком и активировать его. Известны:
Gαs и Gαi-белки (стимуляторы и ингибиторы аденилатциклазы, АЦ),
а также Gαq-белки – активаторы ФЛазы С-γ. Иными словами, акти-
вация GPCR запускает не менее 2-х сигнальных путей:
путь цАМФ;
путь Са2+/фосфатидилинозитола.
Слайд 44 α-субъединица в составе G-белков содержит нуклеотид-свя-зы-вающий сайт для
гуаниновых нуклеотидов (ГДФ/ГТФ). Активация Gs-белка состоит в замене ГДФ на
ГТФ в этом сайте, что происходит благодаря контакту с цитозольным доменом активированного рецептора GPCR. Комплекс ГТФ-α-субъедини-ца отделяется от β,γ-димера и активирует АЦ (синтез цАМФ происходит в пределах нескольких секунд).
G-белки обладают собственной ГТФазной активностью:
ГТФ ? ГДФ. Спустя несколько минут после активации АЦ, собственная ГТФаза в составе активной α-субъединицы превра-щает ГТФ в ГДФ. Это индуцирует «самосборку» гетеротример-ного G-белка (неактивного) и проведение сигнала от гормона прерывается – самовыключение G-белка.
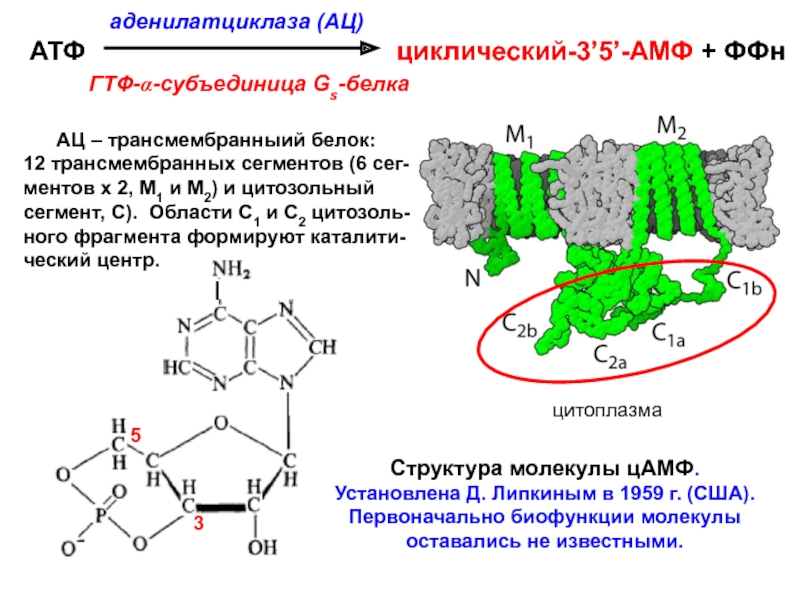
Слайд 45Структура молекулы цАМФ. Установлена Д. Липкиным в 1959 г. (США).
Первоначально биофункции молекулы оставались не известными.
аденилатциклаза (АЦ)
АТФ циклический-3’5’-АМФ + ФФн
ГТФ-α-субъединица Gs-белка
АЦ – трансмембранныий белок:
12 трансмембранных сегментов (6 сег-
ментов х 2, М1 и М2) и цитозольный
сегмент, С). Области С1 и С2 цитозоль-
ного фрагмента формируют каталити-
ческий центр.
цитоплазма
3
5
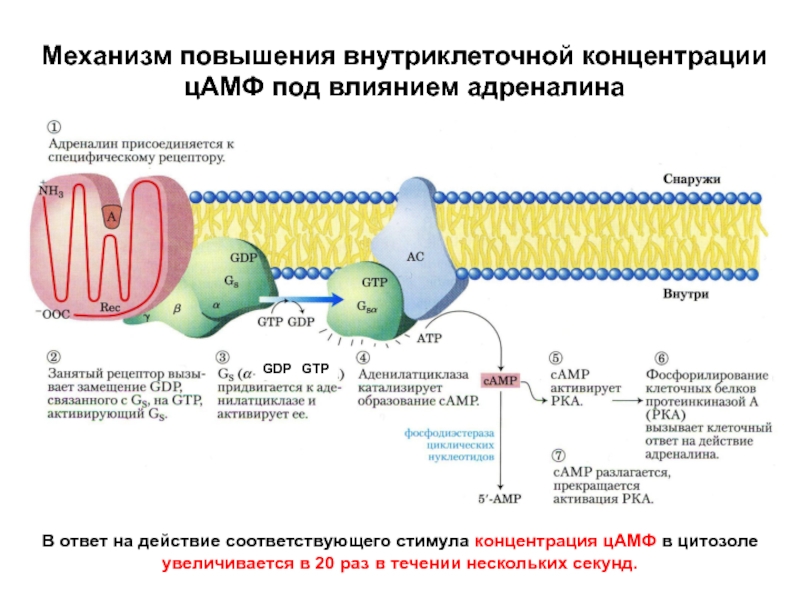
Слайд 46Механизм повышения внутриклеточной концентрации
цАМФ под влиянием адреналина
GDP GTP
В
ответ на действие соответствующего стимула концентрация цАМФ в цитозоле увеличивается
в 20 раз в течении нескольких секунд.
Слайд 47Строение и функционирование ПКА
Молекула ПКА состоит из 2
регуляторных (R) и 2 каталитичес-ких (C) субъединиц.
Тетрамерный
комплекс 2R2C неактивен: аутоингибирующий домен в R - субъединице занимает субстратсвязывающие центры в каждой из С – субъединиц.
В результате связывания двух молекул цАМФ с каждой из R –субъединиц, последние претерпевают конформационные изменения в результате которых комплекс 2R2C диссоциирует, осовобождая две активированные каталитические С – субъеди-ницы.
Активированная ПКА распознает в белках-мишенях особые, консенсусные последовательности аминокислот и фосфори-лирует там остатки серина и треонина.
Слайд 48
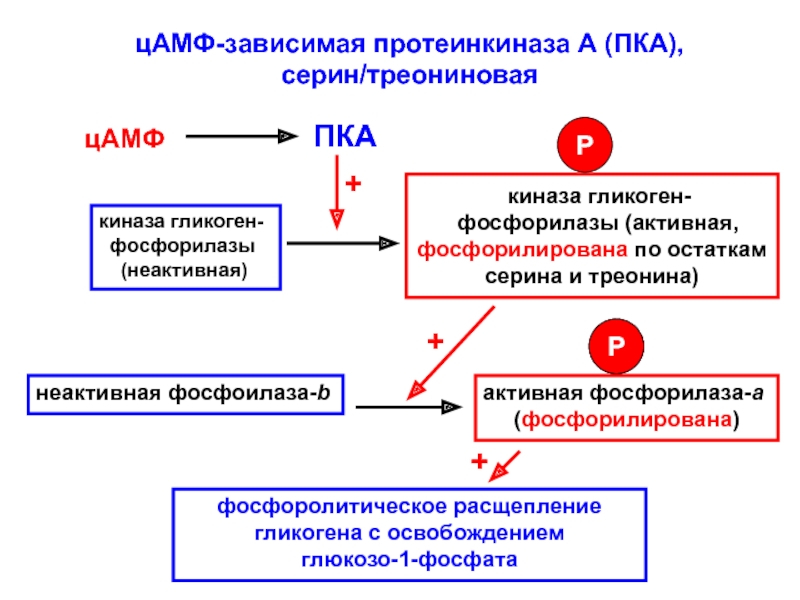
цАМФ-зависимая протеинкиназа А (ПКА),
серин/треониновая
цАМФ
ПКА
киназа гликоген-
фосфорилазы
(неактивная)
киназа
гликоген-
фосфорилазы (активная, фосфорилирована по остаткам серина и треонина)
неактивная фосфоилаза-b
активная
фосфорилаза-а
(фосфорилирована)
фосфоролитическое расщепление гликогена с освобождением
глюкозо-1-фосфата
+
+
+
P
P
P
Слайд 49Белки, заякоривающие протеинкиназу А
(AKAP – A kinase anchoring proteins).
Эти белки обеспечивают физическую связь между каталити-ческой субъединицей
(С) ПКА и специфической внутриклеточной структурой. Например: связывание и удерживание ПКА с микро-трубочками и актиновыми микрофиламинтами клеточного скеле-та, с Са2+-каналами, с митохондриями и ядром.
Благодаря различным заякоревающим белкам, содержащимся в различных типах клеток, цАМФ получает возможность в одних клетках стимулировать фосфорилирование белков в митохонд-риях, а в других клетках – фосфорилировать актиновые фила-менты.
Иными словами, ПКА «привязана к нужным белкам»; цАМФ её активирует, а ПКА, фосфорилируя «нужный» белок, изменяет его активность. Близкое расположение цАМФ-активируемых фермен-тов к «месту» их действия, по-видимому, важно для максимальной быстроты ответа.
Слайд 50 В клетках-мишенях каждого типа экспрессируется собствен-ный набор протеинкиназ
А и киназа-активируемых путей.
Одна система передачи информации может
быть использова-на для контроля нескольких специфических биохимических процессов.
Слайд 51 Усиление сигнала от гормонов, действующих
посредством вторичного мессенджера цАМФ.
1
молекула гормона активирует 1 молекулу РЕЦЕПТОРА, который активирует несколько G-белков. Каждая молекула G-белка стимулирует несколько молекул АЦ. Каждая молекула АЦ синтез множество молекул цАМФ. цАМФ активирует одну молекулу ПКА, каждая из которых активирует множество мишеней: фосфорилаз гликогена. Итог каскада – усиление гормонального сигнала на несколько порядков.
Это объясняет, почему для эндокринной регуляции требуется очень низкая концентрация гормона в крови – как правило, 10-10 М.
Слайд 52Механизмы прекращения сигнализации посредством рецептора и синтеза цАМФ:
Включение собственной
ГТФазной активности α-субъединицы,
наступает через несколько минут после активации
рецептором
Gs-белка. Замена ГТФ на ГДФ в составе α-субъединицы приво-
дит к потере её активности и сборке неактивного гетеротри-
мерного Gs-белка;
2. Снижение концентрации адреналина в крови приводит к дис-
социации комплекса гормон – рецептор;
3. Рецептор (находящийся в форме комплекса с гормоном) фос-
форилируется по цитозольному домену специфической ПКС,
что лишает рецептор способности контактировать с Gs-белком
и активировать его. Окончательная инактивация рецептора
происходит с участием белка аррестина: комплекс фосфори-
лированный рецептор-аррестин поглощается клеткой путем
эндоцитоза.
Слайд 534. Сама цАМФ разрушается с участием специфической фосфоди-
эстеразы:
фосфодиэстераза
цАМФ АМФ (лишена свойств вторичного
мессенджера)
5. Специфические фосфатазы дефосфорилируют ферменты,
активированные ПКА.
Т.о., цАМФ образуется в пределах секундных интервалов вре-мени. Если не происходит постоянного образования всё новых комплексов гормон — рецептор, ответ также быстро прекраща-ется. Реакции, запускаемые цАМФ, быстрые, но скоротечные.
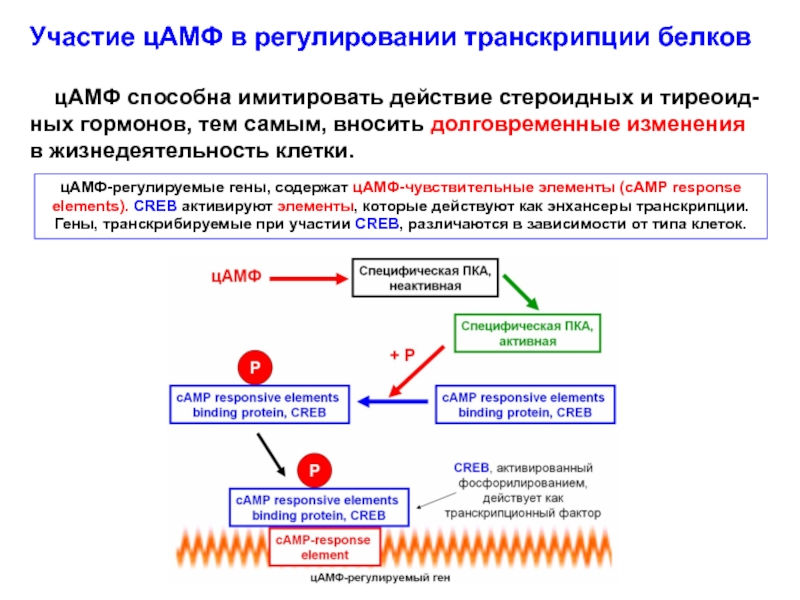
Слайд 54 Участие цАМФ в регулировании транскрипции белков.
цАМФ способна
имитировать действие стероидных и тиреоид-ных гормонов, тем самым, вносить долговременные
изменения в жизнедеятельность клетки.
Гены, регулируемые цАМФ, содержат цАМФ-чувствительные элементы (сАМР response elements): это последовательности, которые при стимуляции действуют в качестве энхансеров транскрипции.
Стимуляция цАМФ-чувствительных элементов идёт с участием специфической цАМФ-зависимой протеинкиназы, которая фосфорилирует белок, связывающий цАМФ-чувствительные элементы (cAMP responsive elements binding protein, CREB). Активированный CREB действует как транскрипционный фактор и связывается с цАМФ-чувствительными элементами ДНК.
цАМФ-регулируемые гены, содержат цАМФ-чувствительные элементы (сАМР response elements). CREB активируют элементы, которые действуют как энхансеры транскрипции. Гены, транскрибируемые при участии CREB, различаться в зависимости от типа клеток.
Слайд 55Участие цАМФ в регулировании транскрипции белков
цАМФ способна имитировать
действие стероидных и тиреоид-ных гормонов, тем самым, вносить долговременные изменения
в жизнедеятельность клетки.
цАМФ-регулируемые гены, содержат цАМФ-чувствительные элементы (сАМР response elements). CREB активируют элементы, которые действуют как энхансеры транскрипции. Гены, транскрибируемые при участии CREB, различаются в зависимости от типа клеток.











![Система мессенджеров в сигнальной трансдукции 5. Ионы Са2+. В цитоплазме нестимулированной клетке [Ca2+] = 10-7 5. Ионы Са2+. В цитоплазме нестимулированной клетке [Ca2+] = 10-7 М. Во всех клетках повышение](/img/thumbs/0cbc7617ede4e201fdb3672e3d2658c7-800x.jpg)