Слайд 1Состояние вещества в растворе
■ Концентрация (С)
Слайд 2Способы выражения концентрации
Молярная концентрация (С) – отношение числа молей растворенного
вещества к объему раствора. Выражают в молях растворенного вещества на
кубический дециметр раствора (моль•дм-3) или молях на литр (моль•л-1) и часто обозначают символом М.
Моль – количество вещества системы, содержащей столько же условных частиц (атомы, молекулы, ионы, электроны и др.), сколько содержится атомов в углероде – 12 массой 0,012 кг.
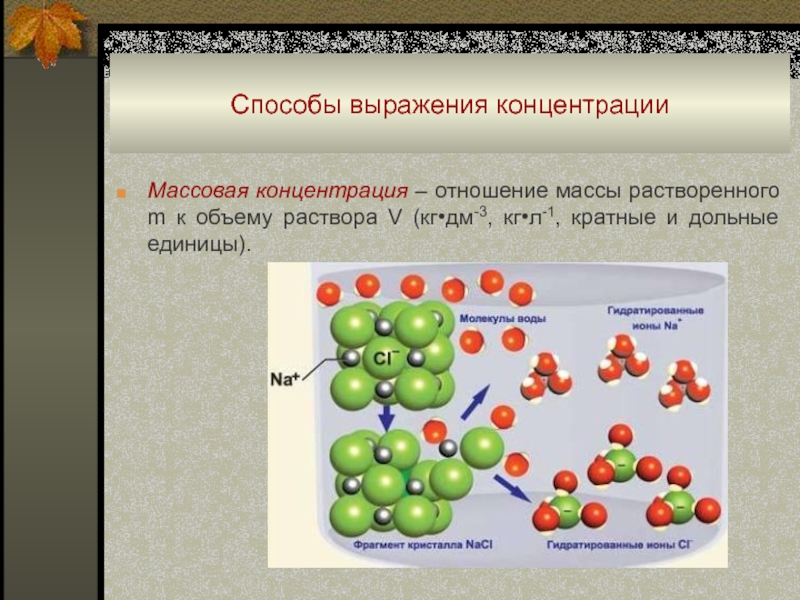
Слайд 3Способы выражения концентрации
Массовая концентрация – отношение массы растворенного m к
объему раствора V (кг•дм-3, кг•л-1, кратные и дольные единицы).
Слайд 4Общая и равновесная концентрации
(NH4)2 CO3 + CaCI2
= CaCO3 ↓ + 2NH4Cl (главная реакция)
CO32-
+ Ca2+ = CaCO3 ↓
Общая концентрация – C (СO32-) = [CO32-] + [HCO3-] + [H2CO3]
Равновесная концентрация – [CO32-]
[CO32-]
Мольная доля α(CO32- ) = ———
C (СO32-)
[CO32-] = α(CO32- )×C (СO32-)
Слайд 5Активность (aА )
aА = fA × [A]
Слайд 6Связь активности с концентрациями
■ Коэффициенты активности (f) играют роль поправок на
межионные взаимодействия. В очень разбавленных растворах (< 10-4 M) fi
практически равны единице, а аi = [A].
aA = f A × [A] = f A× αA× CA
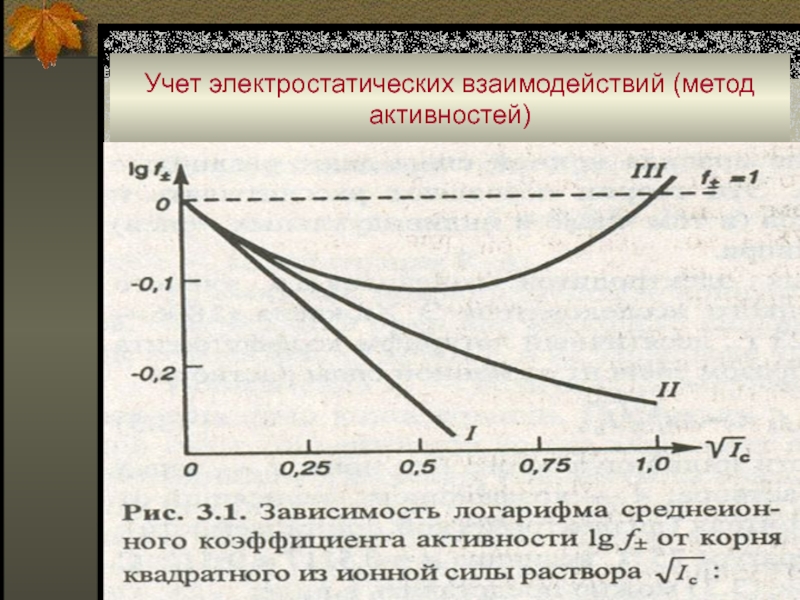
Слайд 7Учет электростатических взаимодействий (метод активностей)
■ На величину f(Х) влияет общая концентрация
всех ионов в растворе. В связи с этим Г. Льюис
(1907 г.) ввел понятие ионной силы раствора электролита.
■ Ионная сила раствора (μ) – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (Сi) каждого иона на квадрат его заряда (zi):
μ = ½ ∑ CiZi
■ В 1923 г. Дебай и Хюккель вывели теоретическое выражение для расчета f(Х). Это выражение, известное как уравнение Дебая-Хюккеля, выглядит в упрощенном виде так:
Слайд 8Учет электростатических взаимодействий (метод активностей)
Для высоких значений ионной силы предложено
множество эмпирических уравнений. Чаще всего используется уравнение в модификации Дэвиса:
Ионная
сила плазмы крови человека равна 0,15 М, поэтому физиологический раствор – простейший заменитель плазмы крови – должен иметь соответствующую концентрацию NaCI (0,15 M, или 0,9 %).
Слайд 9Учет электростатических взаимодействий (метод активностей)
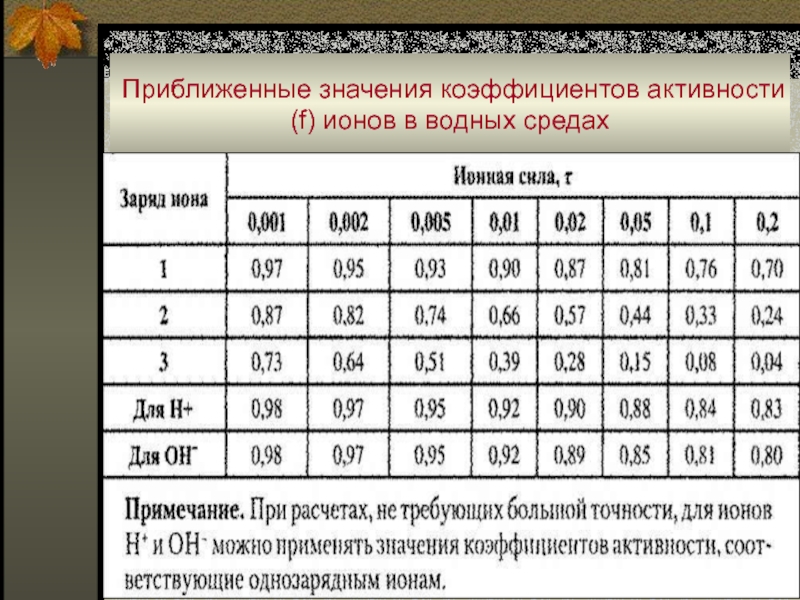
Слайд 10Приближенные значения коэффициентов активности (f) ионов в водных средах
[A]
αA = ——— ,
CA
где [A] – равновесная концентрация;
CA – общая (аналитическая) концентрация.
aA = fA × [A] = fA×αA× CA
Слайд 12α – коэффициенты (протолитические конкурирующие реакции)
(NH4)2 CO3 +
CaCI2 = CaCO3 ↓ + 2NH4Cl (главная
реакция).
СO32- + H2O ↔ HCO3- + OH-
HCO3- + H2O ↔ H2CO3 + OH- (конкурирующие реакции).
Для нахождения α (СO32- ) проводим следующие расчеты.
C (СO32-) = [CO32-] + [HCO3-] + [H2CO3] (уравнение материального баланса).
Слайд 13α – коэффициенты (протолитические конкурирующие реакции)
Через соответствующие константы кислотности найдем
[HCO3-] и [H2CO3]:
[H3O+] [HCO3-]
H2CO3 + H2O ↔ HCO3- + H3O+ ; Kα1 = ———————.
[H2CO3]
[CO32-] [H3O+]
HCO3- + H2O ↔ CO32- + H3O+ ; Kα2 = ——————.
[HCO3-]
Слайд 14α – коэффициенты (протолитические конкурирующие реакции)
[CO32-] [H3O+]
Отсюда [HCO3-] = ———————.
Kα2
[H3O+]2 [CO32-]
[H2CO3] = ————————.
Kα1 • Kα2
[CO32-] [H3O+] [H3O+]2 [CO32-]
Тогда C (СO32- ) = [CO32-] + —————— + —————— .
Kα2 Kα1 • Kα2
Слайд 15α – коэффициенты (протолитические конкурирующие реакции)
Далее:
[H3O+] [H3O+]2
С(CO32-) = [CO32-] ( 1 + ——— + ————— ) =
Kα2 Kα1 • Kα2
Kα1 • Kα2 + Kα1 [H3O+] + [H3O+]2
[CO32-] × [ ———————————————————]
Kα1 • Kα2
Kα1 • Kα2
Отсюда α(CO32- ) = —————————————————
Kα1 • Kα2 + Kα1 [H3O+] + [H3O+]2
Слайд 16α – коэффициенты (протолитические конкурирующие реакции)
[H+]n
αHnA = ——————————————————————————.
Kα,1 Kα,2 … Kα,n + Kα,1 Kα,2 … Kα,n-1[H+] +…..+ [H+]n
Kα,1 Kα,2 … Kα,n-
α An- = ——————————————————————————.
Kα,1 Kα,2 … Kα,n + Kα,1 Kα,2 … Kα,n-1[H+] + …+ [H+]n
aА = fА ×αА × CА
Слайд 17α – коэффициенты (протолитические конкурирующие реакции)
Задача.
Оценить возможность реакции 1,25
×10-3М (NH4)2CO3 + 0,01М CaCI2 = CaCO3 ↓
+ 2NH4Cl при рН 6.00.
ПР (CaCO3 ↓) = 2.88×10 -9. Следовательно, [Ca2+]×[CO32-] > ПР (CaCO3 ↓).
[CO32-] = С(CO32-)× α(CO32-).
Слайд 18α – коэффициенты в реакциях комплексообразования
0,01 М Ag(NO3) + 0,01
М NaCI ↔ AgCI↓ + NaNO3 (основная реакция)
Ag(NO3) +
NH3 ↔ Ag(NH3)+ (конкурирующая реакция)
Ag(NH3)+ + NH3 ↔ Ag(NH3)2+ (конкурирующая реакция)
ПР(AgCI↓) = 1,78×10-10 [Ag+]×[CI-] > ПР(AgCI↓
[Ag+] = С(Ag+)× α(Ag+)
С(Ag+) = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+]
Слайд 19α – коэффициенты в реакциях комплексообразования
[Ag(NH3)+]
β[Ag(NH3)+] = ────────.
[Ag+]×[NH3]
[Ag(NH3)+] = β(Ag(NH3)+ × [Ag+]×[NH3].
[Ag(NH3)2+]
β[Ag(NH3)2+] = ────────.
[Ag+]×[NH3]2
[Ag(NH3)2+] = β[Ag(NH3)2+] × [Ag+]×[NH3]2.
Слайд 20α – коэффициенты в реакциях комплексообразования
С(Ag+) = [Ag+]
+ β(Ag(NH3)+ × [Ag+]×[NH3] +
β[Ag(NH3)2+] × [Ag+]×[NH3]2 =
[Ag+]
(1 + β(Ag(NH3)+ × [NH3] + β[Ag(NH3)2+] × [NH3]2).
α(Ag+) = [Ag+] / С(Ag+) =
1
= ———————————————————————.
(1 + β(Ag(NH3)+×[NH3] + β[Ag(NH3)2+]×[NH3]2)
Слайд 21α – коэффициенты в реакциях комплексообразования
2 М NH3
1
α(Ag+) = —————————————— ≈ 1,5•10-8
1 + 2.09 • 103 • 2 + 1,62 • 107 • 4
[Ag+]×[CI-] = 1•10-2• 1•10-2• 1,5•10-8 = 1,5•10-12 < ПР(AgCI↓).
Слайд 22α – коэффициенты в реакциях комплексообразования
СM = [M] + [ML]
+ [ML]2 + … + [ML]n
CL = [L] + [ML]
+ 2 [ML]2 + … +n [ML]n
[ML] [ML]2 [ML]n
β1= ————; β2= ————; βn= ————;
[M] [L] [M] [L]2 [M] [L]n
СM = [M](1 + β1 [L] + β2 [L]2 + βn [L]n);
[M] 1
αM = —— = ——————————————;
СM (1 + β1 [L] + β2 [L]2 + βn [L]n)
Слайд 23Константы равновесия
αA = [A] • fA = CA • αA
• fA;
aA + bB ↔ cC + dD;
aCc • aDd [C]C • [D]d CCc • CDd
Kт = —————; Kc = —————; Kу = —————;
aAa • aBb [A]a • [B]b CAa • CBb
[C]c • [D]d fCc•fDd fCc•fDd CCc • CDd αCc•αDd
Kт = ──────×────= Kc × ────= —————×————×
[A]a • [B]b fAa•fBb fAa•fBb CAa • CBb αAa•αBb
fCc•fDd αCc•αDd fCc•fDd
────= Kу ×————× ────.
fAa•fBb αAa•αBb fAa•fBb
Слайд 24Константы равновесия
αA = [A] • fA = CA • αA
• fA;
aA + bB ↔ cC + dD;
aCc • aDd [C]c • [D]d
Kт = —————; Kc = —————;
aAa • aBb [A]a • [B]b
CCc • CDd
Kу = —————;
CAa • CBb
Слайд 25Гравиметрический анализ и равновесие
осадок - раствор
«Некоторые нагрузки легки, некоторые
тяжелы. Есть люди, предпочитающие легкое тяжелому…»
(Мао Цзедун)
Гравиметрия – один из самых точных методов определения больших количеств веществ.
Слайд 26Гравиметрический анализ и равновесие
осадок - раствор
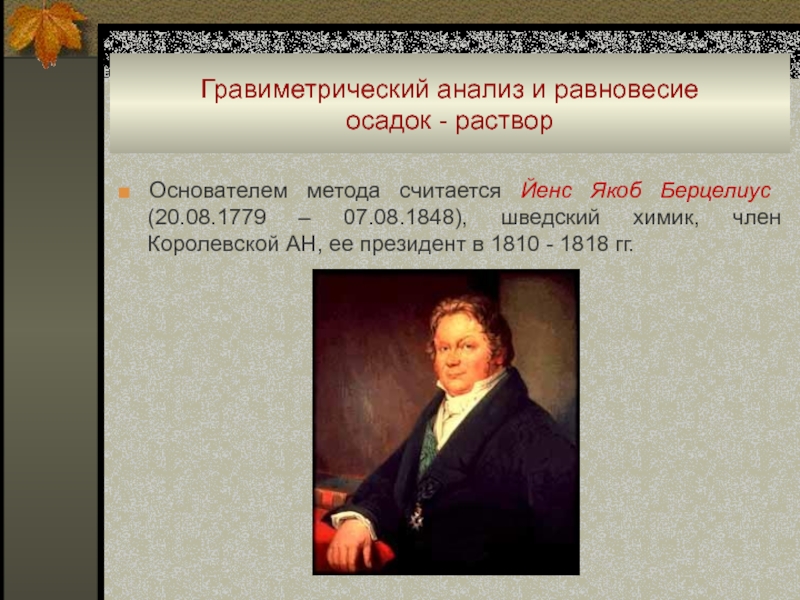
■ Основателем метода считается
Йенс Якоб Берцелиус (20.08.1779 – 07.08.1848), шведский химик, член Королевской
АН, ее президент в 1810 - 1818 гг.
Слайд 27Гравиметрический анализ и равновесие
осадок - раствор
Именно гравиметрию использовал Т.У.
Ричардс (31.01.1868 – 02.04.1928), американский химик для определения атомных масс
химических элементов, за что получил в 1941 г. Нобелевскую премию (посмертно).
Слайд 28Гравиметрический анализ
Гравиметрия – абсолютный (безэталонный) метод анализа, заключающийся в выделении
вещества и его взвешивании.
Аналитическим сигналом в гравиметрии является масса.
Достоинства метода:
высокая воспроизводимость (0,05-0,2 %), универсальность, простота.
Недостатки метода: длительность определения, малая селективность, чувствительность, деструктивность.
Слайд 29Классификация методов гравиметрии
Метод осаждения: определяемый компонент раствора вступает в химическую
реакцию с осадителем, образуя малорастворимый продукт (осадок), который отделяют, промывают,
высушивают (прокаливают) и взвешивают на аналитических весах;
Метод отгонки: определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества (прямой метод), либо массу остатка (косвенный метод);
Метод выделения: определяемый компонент выделяют, например, при электролизе на одном из электродов (электрогравиметрия), который промывают, высушивают и взвешивают;
Термогравиметрический метод: измерение массы анализируемого вещества при его непрерывном нагревании в заданном температурном интервале.
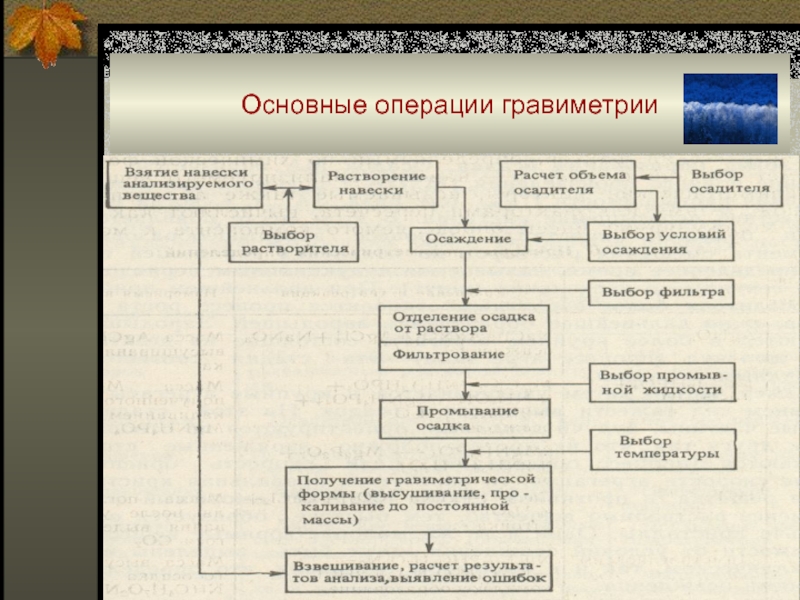
Слайд 31Основные операции гравиметрии
1. Подготовка раствора.
2. Осаждение определяемого вещества в виде
малорастворимого соединения (его называют осаждаемой формой).
3. «Старение осадка».
4. Фильтрование.
5. Промывание
осадка.
6. Высушивание для удаления влаги или прокаливание при высокой температуре для превращения осадка в более подходящую для взвешивания форму (ее называют гравиметрической формой).
7. Взвешивание.
8. Расчет содержания аналита.
Слайд 32Основные операции гравиметрии
Первый этап гравиметрического анализа - подготовка раствора пробы
к осаждению.
Среди факторов, которые следует при этом учитывать, - объем
раствора в ходе осаждения, диапазон концентраций определяемого компонента, наличие мешающих примесей, температура и рН раствора.
Например, оксалат кальция практически нерастворим в щелочных средах, но при низких рН его растворимость резко возрастает за счет связывания оксалат-ионов протонами с образованием слабой кислоты (конкурирующая реакция по аниону).
Слайд 33Основные операции гравиметрии
Алюминий можно осадить при рН 4 с 8-оксихинолином,
в то же время при более высоких рН осаждается магний.
Слайд 34Основные операции гравиметрии
Приступаем к осаждению (при правильно выбранных условиях).
В
осадок должна выделяться только осаждаемая форма. Селективность осаждения достигается выбором
адекватного осадителя, регулированием рН, маскированием примесей.
Осадок должен быть практически нерастворим.
Определяемый компонент должен выделяться в осадок количественно: его концентрация в растворе после осаждения должна быть 10 -6 M, а остаточное количество находится за пределами точности взвешивания на аналитических весах (0,0002 г.).
Слайд 35Основные операции гравиметрии
Приступаем к осаждению (при правильно выбранных условиях).
Осадок
не должен содержать посторонних примесей.
Осадок должен быть устойчивым к внешним
воздействиям.
Процесс перехода осаждаемой формы в гравиметрическую должен происходить без потерь определяемого компонента.
Структура осадка должна обеспечивать оптимальное проведение операций фильтрования и промывания. Наиболее удобными являются крупнокристаллические осадки.
Слайд 36Образование осадка
При добавлении реагента – осадителя к раствору осаждаемого вещества
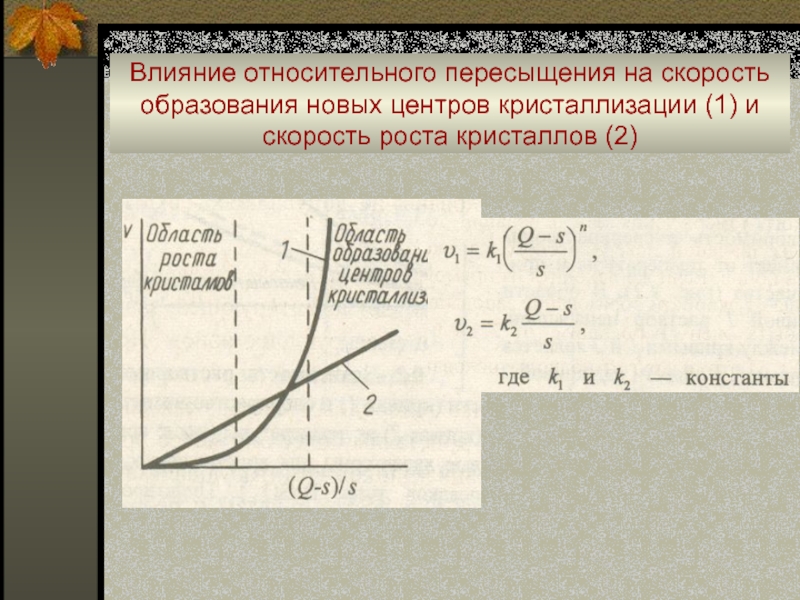
образование твердой фазы происходит не сразу, а через определенный период.
Слайд 37Влияние относительного пересыщения на скорость образования новых центров кристаллизации (1)
и скорость роста кристаллов (2)
Слайд 39Кристаллические осадки
Уменьшают относительное пересыщение раствора при медленном добавлении регентов, интенсивном
перемешивании, нагревании разбавленных растворов, а также осаждая из гомогенного раствора
– «метод возникающих реагентов»:
(NH2)2 CO + 2 H2O ↔ 2 NH4+ + CO32-
(C2H5)2SO4 + 2 H2O ↔ 2 C2H5OH + SO42- + 2 H +
[Co(C6H5N)4]2+ ↔ Co2+ + 4C6H5N
Избегать затравок, вызывающих индуцированную нуклеацию.
Замедлять осаждение.
Оставлять осадок под маточным раствором для старения.
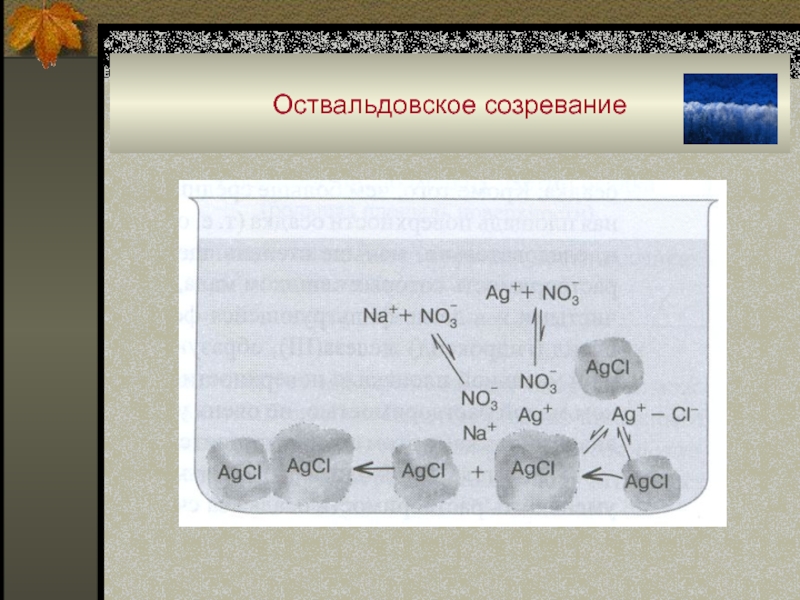
Слайд 40Старение осадков
«Старение осадка»:
- оствальдовское созревание (массоперенос от мелких крисаллов к
крупным);
- термическое старение (превращение метастабильных модификаций в устойчивые формы): CaC2O4
• 3H2O → CaC2O4 • 2H2O → CaC2O4 • H2O;
- химическое старение (переход в другую кристаллическую модификацию, полимеризация): -Al2O3* H2O (структура бëмита) → - Al2O3* 3H2O (структура гиббсита).
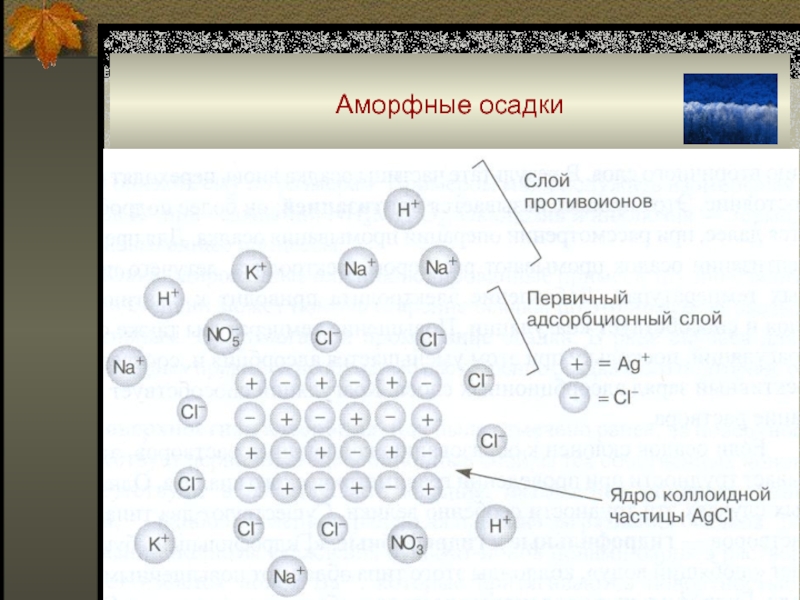
Слайд 44Аморфные осадки
Коллоидную частицу,
например, AgJ в растворе
AgNO3 можно представить
следующим образом:
Устойчивость
коллоидной
системы
определяется
толщиной двойного
электрического слоя
и ζ – потенциалом.
Слайд 45Аморфные осадки
Противоионы не могут
приблизиться к поверхности
ближе, чем на определенное
предельное
расстояние δ,
которое зависит от радиуса
ионов.
За δ плотный слой
противоионов
переходит в
диффузионный
слой.
Поверхность мицеллы и слой
противоионов составляют
двойной электрический слой.
Слайд 46Аморфные осадки
Двойной электрический слой сжимается, а ζ –потенциал понижается при
увеличении концентрации электролита и заряда противоионов.
Протяженность диффузионного слоя r также
зависит от концентрации электролита в растворе: r = k/√C.
При уменьшении толщины двойного электрического слоя до некоторого значения, когда силы притяжения между частицами становятся больше сил отталкивания, наступает коагуляция – агломерация частиц, оседающих под действием силы тяжести (седиментация).
Очевидно, что коагуляции способствует увеличение концентрации электролита и заряда ионов.
Слайд 47Влияние концентрации (а) и заряда (б) на
устойчивость коллоидной системы
[(С1< С2< С3); z=1(1), z=2(2), z=3(3)]
Слайд 48Факторы, влияющие на образование осадка
Слайд 49Загрязнение осадков
Соосаждение (захват примесей из ненасыщенного раствора):
1. Адсорбция
1.1. правило Панета-Фаянса-Хана:
AgI * Ag+ | CH3COO-
1.2. концентрационный фактор
1.3. заряд иона
1.4. преимущественно
сорбируются ионы примерно такого же размера, что и ионы решетки
2. Окклюзия (захват посторонних примесей в процессе образования осадка)
2.1. внутренняя адсорбция
2.2. инклюзия растворителя
3. Образование твердых растворов (изоморфизм)
Слайд 50Правило Панета-Фаянса-Хана
Из двух одинаково заряженных ионов равной концентрации преимущественно адсорбируется
тот, который сильнее притягивается ионами кристалла.
Сила ионного притяжения тем больше,
чем ниже растворимость образующегося соединения, чем больше степень ковалентности связи, чем больше поляризуемость аниона и поляризующая сила катиона.
Сильнее всего притягиваются собственные ионы осадка. В результате поверхность частиц заряжается (положительно или отрицательно) и из раствора адсорбируются противоионы: AgI Ag+ | CH3COO-.
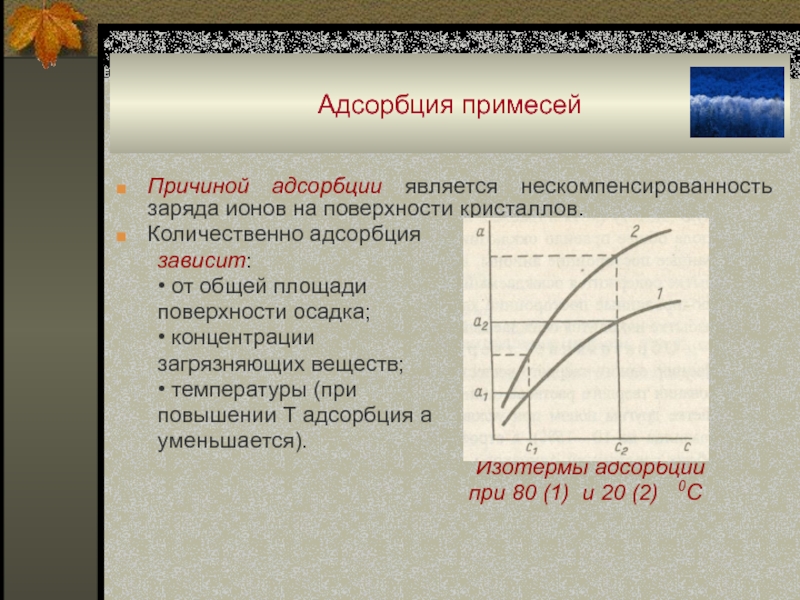
Слайд 51Адсорбция примесей
Причиной адсорбции является нескомпенсированность заряда ионов на поверхности кристаллов.
Количественно
адсорбция
зависит:
• от общей площади
поверхности осадка;
• концентрации
загрязняющих веществ;
• температуры (при
повышении
Т адсорбция а
уменьшается).
Изотермы адсорбции
при 80 (1) и 20 (2) 0С
Слайд 52Адсорбция примесей
Адсорбция потенциалопределяющих (как правило, собственных) ионов подчиняется уравнению:
Слайд 53Адсорбция примесей
При обменной адсорбции адсорбированные противоионы замещаются на ионы промывной
жидкости.
В этом случае константа равновесия равна:
Слайд 54Молекулярная адсорбция
Адсорбция молекул и ионных пар (молекулярная адсорбция) на однородной
поверхности при образовании мономолекулярного слоя описывается уравением Ленгмюра:
где k1, k2
- коэффициенты
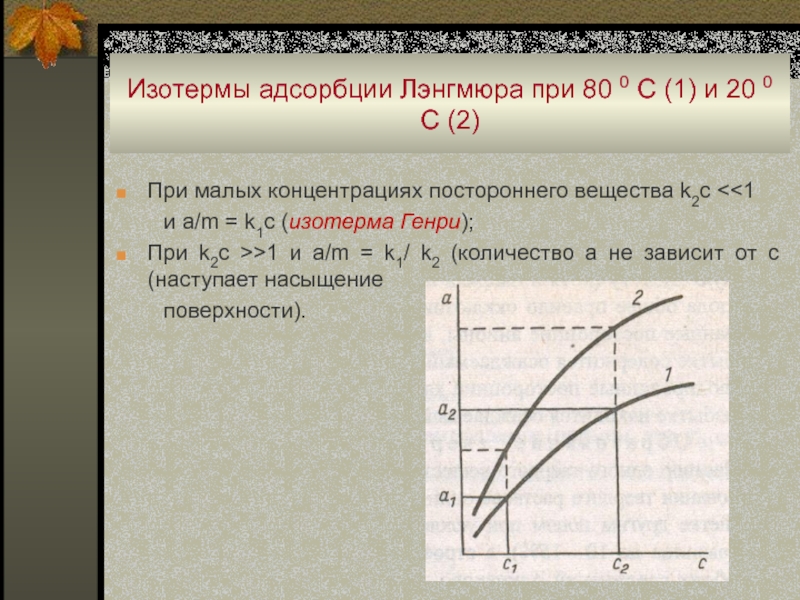
Слайд 55Изотермы адсорбции Лэнгмюра при 80 0 С (1) и 20
0 С (2)
При малых концентрациях постороннего вещества k2с
и a/m = k1с (изотерма Генри);
При k2с >>1 и a/m = k1/ k2 (количество a не зависит от с (наступает насыщение
поверхности).
Слайд 56Образование твердых растворов (изоморфизм)
Раствор одного твердого вещества в другом называют
твердым.
При образовании твердых растворов один из ионов замещается в кристаллической
решетке другим ионом при условии, что заряд их одинаков, размеры близки (разница до 10 – 15 %), а строение кристаллических решеток (сингония) одинаково.
Количественно изоморфное осаждение описывается законами распределения.
Например, при изоморфном соосаждении сульфатов бария и свинца (II) имеет место равновесие:
Слайд 57Образование твердых растворов (изоморфизм)
Это равновесие можно представит в виде двух
равновесий:
Слайд 58Образование твердых растворов (изоморфизм)
Эти константы есть произведения растворимости, но активности
твердых соединений нельзя принять равными единице.
Разделив одну константу на другую,
заменив активности ионов на концентрации и учитывая, что отношение констант равновесия величина постоянная, получим (D – коэффициент распределения):
Слайд 59Образование твердых растворов (изоморфизм)
В идеальном твердом растворе активность каждого компонента
равна его мольной доле:
Тогда получим:
Слайд 60Правило Хлопина
A + R ↔ AR↓ (основная реакция)
B + R
↔ BR↓ (изоморфное замещение)
nBR
[B] ПР AR↓
—— = D ——; D = —————
nAR [A] ПР BR↓
Изоморфные пары: MgNH4PO4 ↔ MgKPO4; BaSO4 ↔ SrSO4;
MgNH4PO4 ↔ ZnNH4PO4
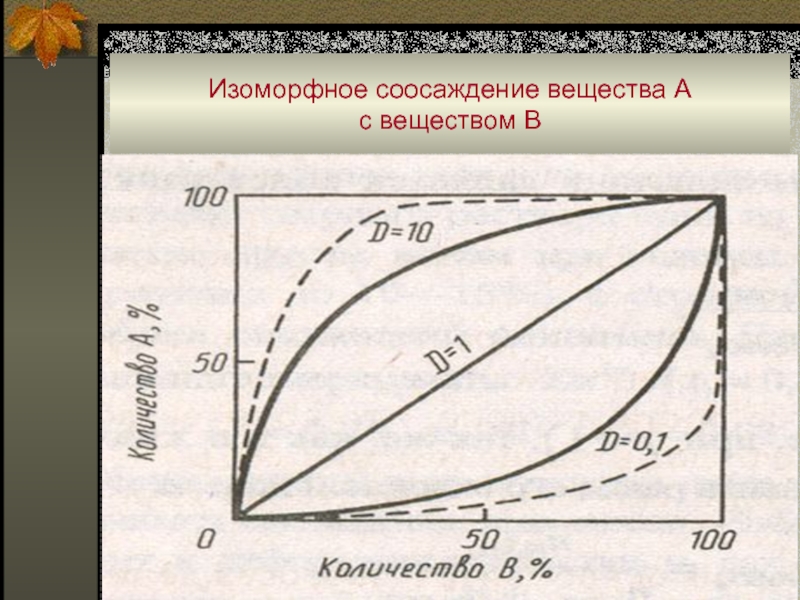
Слайд 61Изоморфное соосаждение вещества А
с веществом В
Слайд 62Способы уменьшения соосаждения
примесей
Промывание осадка соответствующими растворителями.
Переосаждение осадка.
Маскирование примесей.
Использование органических
осадителей.
Работа с кристаллическими осадками. Использование процесса «старения» для этих осадков.
Слайд 63Требования к гравиметрической форме
Состав гравиметрической формы должен точно соответствовать ее
стехиометрии: CaSO4, BaSO4, BiPO3, Al2O3, CaO, Mg2P2O7, NiC8H14O4.
Гравиметрическая форма должна
быть устойчива: не окисляться, не разлагаться, не поглощать из воздуха влагу или CO2.
Гравиметрический фактор F должен иметь по возможности минимальное значение, т.к. при этом понижается относительная ошибка и повышается чувствительность гравиметрического определения:
BaCrO4↓ FCr = 0,2053; Cr2O3↓ FCr = 0,6842;
1
M г.ф. = M x
F
Слайд 65Расчеты в гравиметрии
А.с. = k × C;
Мг.ф. = 1/F × Мх; F – гравиметрический
фактор.
a Мол. масса опред. в – ва
F = ————————————— ,
b Мол. масса грав. формы
где a и b – коэффициенты, необходимые для уравнивания числа молей определяемого вещества в числителе и знаменателе;
Слайд 66Расчеты в гравиметрии
Мг.ф.× F
Величина навески (g), г; g = ———— × 100,
w
где w – массовая доля выделяемого компонента, %.
Масса определяемого компонента (mx), г
mx = Мг.ф.× F .
Массовая доля определяемого компонента (w), %
Мг.ф.× F
w = ———— × 100.
g
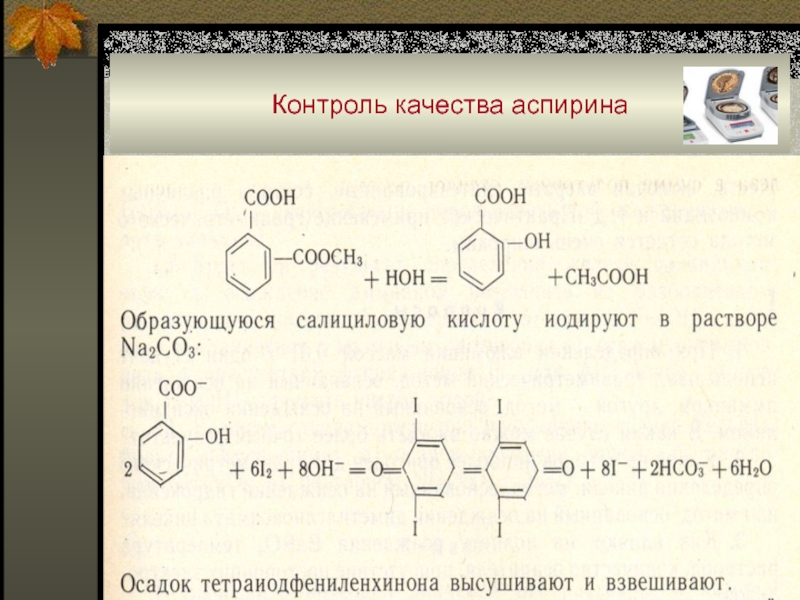
Слайд 67Примеры гравиметрических определений
Метод осаждения:
салициловая кислота с иодом → осадок
тетраиодидфениленхинона (проверка качества аспирина);
определение никотина в ядохимикатах → осаждение с
кремнефольфрамовой кислотой.
Метод отгонки:
определение CO2 в CaCO3 (CaCO3 + 2HCl → CO2↑ + CaCl2 + H2O);
фармакопейные тесты на лекарственные препараты.
Метод выделения:
электролитическое отделение золота от меди (II) в растворе.
Термогравиметрический метод:
анализ салицилатного комплекса цинка Zn(HOC6H4COO)2.
Слайд 68Примеры гравиметрических определений (неорганические осадители)
Слайд 69Примеры гравиметрических определений (органические осадители)
Слайд 70Гравиметрические методы определения функциональных групп
Слайд 72Контроль качества лекарственных препаратов
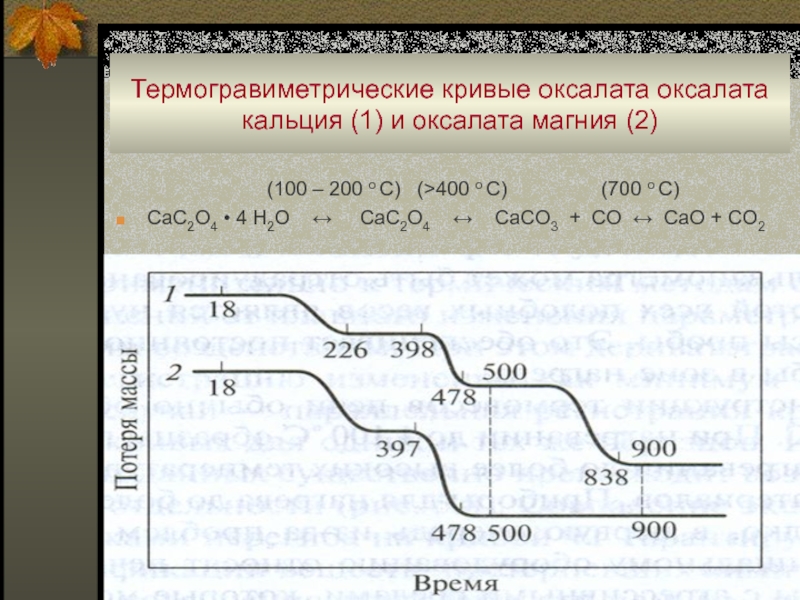
Слайд 74Термогравиметрические кривые оксалата оксалата кальция (1) и оксалата магния (2)
(100 – 200 o C) (>400 o C) (700 o C)
CaC2O4 • 4 H2O ↔ CaC2O4 ↔ CaCO3 + CO ↔ CaO + CO2
Слайд 75Литература
1. Основы аналитической химии. Учебник для вузов. В 2 т.
Под ред. Ю.А. Золотова. М.: Издательский центр «Академия», 2010. Т.
1. 384 с.; Т. 2. 408 с.
2. В.И. Вершинин, И.В. Власова, И.А. Никифорова. Аналитическая химия. М.: Издательский центр «Академия», 2011. 448 с.
3. И.К. Цитович. Курс аналитической химии. СПб.: Издательство «Лань». 2004. 496 с.



![Состояние вещества в растворе Активность (aА )aА = fA × [A] Активность (aА )aА = fA × [A]](/img/thumbs/041d3d885e2426e633401868bd507651-800x.jpg)





![Состояние вещества в растворе α – коэффициенты (протолитические конкурирующие реакции)Через соответствующие константы кислотности найдем [HCO3-] α – коэффициенты (протолитические конкурирующие реакции)Через соответствующие константы кислотности найдем [HCO3-] и [H2CO3]:](/img/thumbs/a8712bfd36bc88f620d5579e4a14d669-800x.jpg)






![Состояние вещества в растворе α – коэффициенты в реакциях комплексообразованияС(Ag+) = [Ag+] + β(Ag(NH3)+ × α – коэффициенты в реакциях комплексообразованияС(Ag+) = [Ag+] + β(Ag(NH3)+ × [Ag+]×[NH3] + β[Ag(NH3)2+] ×](/img/thumbs/b6f002147669ac1fed3b335f16146052-800x.jpg)

![Состояние вещества в растворе α – коэффициенты в реакциях комплексообразованияСM = [M] + [ML] + α – коэффициенты в реакциях комплексообразованияСM = [M] + [ML] + [ML]2 + … + [ML]nCL =](/img/thumbs/516dcefa0ff3aeae257e1992a3db0596-800x.jpg)
![Состояние вещества в растворе Константы равновесияαA = [A] • fA = CA • αA • Константы равновесияαA = [A] • fA = CA • αA • fA;aA + bB ↔ cC +](/img/thumbs/0789030dd288cedf7c4869c608b3abac-800x.jpg)
![Состояние вещества в растворе Константы равновесияαA = [A] • fA = CA • αA • Константы равновесияαA = [A] • fA = CA • αA • fA;aA + bB ↔ cC +](/img/tmb/4/338153/5f446133fa8122f4a1ea819d3e29d65e-800x.jpg)

















![Состояние вещества в растворе Влияние концентрации (а) и заряда (б) на устойчивость коллоидной системы [(С1< С2< С3); z=1(1), z=2(2), z=3(3)] Влияние концентрации (а) и заряда (б) на устойчивость коллоидной системы [(С1< С2< С3); z=1(1), z=2(2), z=3(3)]](/img/thumbs/923cc0f0786e2a83e069d2cc216649d7-800x.jpg)