Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
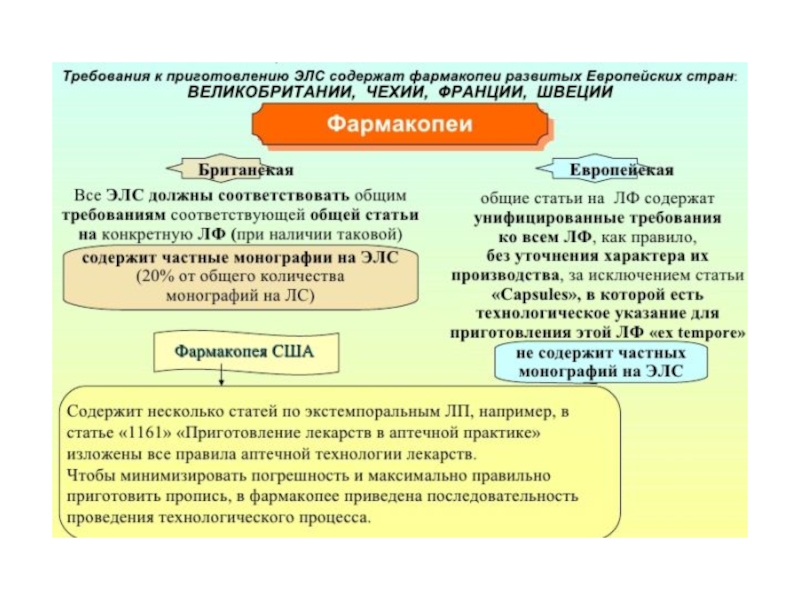
СОВРЕМЕННОЕ СОСТОЯНИЕ И ЗАДАЧИ КОНТРОЛЯ КАЧЕСТВА ПРИ ВНУТРИАПТЕЧНОМ
Содержание
- 1. СОВРЕМЕННОЕ СОСТОЯНИЕ И ЗАДАЧИ КОНТРОЛЯ КАЧЕСТВА ПРИ ВНУТРИАПТЕЧНОМ
- 2. Внутриаптечный контроль – это комплекс мероприятий, направленный
- 3. Качественное изготовление ЛС достигается за счет строгого
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. ВНУТРИАПТЕЧНОЕ ПРОИЗВОДСТВО – ВАЖНЕЙШАЯ ФУНКЦИЯ БОЛЬНИЧНЫХ АПТЕК
- 10. Слайд 10
- 11. Автоматизация производства в больничных аптекахAPOTECAchemo - автоматизированная
- 12. ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ КАЧЕСТВА ЛС включает аналитический контроль
- 13. При осуществлении ВНУТРИАПТЕЧНОГО контроля руководствуются инструктивными документами:
- 14. Приказ Минздрава России от 26.10.2015 №751н "Об
- 15. В соответствии с частью 1 статьи 56
- 16. Приказом Минздрава РФ от 26.10.2015 г. №
- 17. Приказ МЗ РФ № 214 от 16.07.1997г.
- 18. Приказ Министерства здравоохранения Российской Федерации от 31.08.2016
- 19. Приказ Министерства здравоохранения РФ от 31.08.2016 № 646н
- 20. Приказ МЗ РФ № 308 от 21.10.1997г.
- 21. Нормы естественной убыли при изготовлении лекарственных средств
- 22. Производство ЛС осуществляется организациями – производителями ЛС
- 23. Таким образом, в соответствии с действующим законодательством
- 24. При осуществлении контроля в сфере обращения ЛС
- 25. Должностные обязанности уполномоченного по качеству На Уполномоченного по
- 26. Обязанности Уполномоченного по качеству 1).Осуществление приёмочного контроля ЛС
- 27. 6). Контроль за оперативностью изъятия из оборота
- 28. Согласно приказу № 751н от 26.10.2015г. в
- 29. Провизор-аналитик обязан владеть всеми видами внутриаптечного контроля. Зав.
- 30. Журнал регистрации результатов органолептического, физического и химического
- 31. Химический контроль заключается в определении подлинности (качественный
- 32. Процедура осуществления приёмочного контроля Приёмочный контроль осуществляется с
- 33. При поступлении ЛС на склад аптечной организации
- 34. В случае сомнения в качестве ЛС изымают
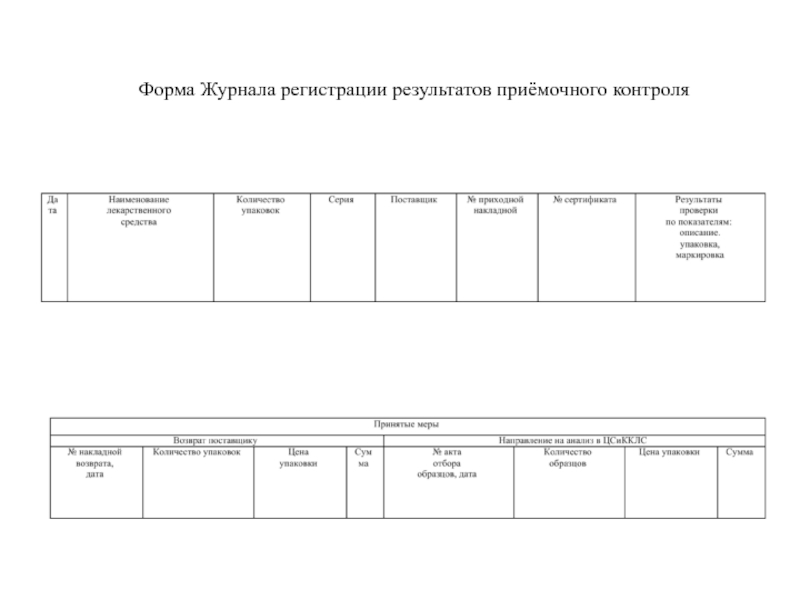
- 35. Форма Журнала регистрации результатов приёмочного контроля
- 36. Предупредительные мероприятия В аптеке осуществляются предупредительные мероприятия,
- 37. 3. Обеспечение исправности и точности приборов, аппаратов и весового хозяйства, регулярности их проверки.
- 38. 4. Тщательный просмотр поступающих в аптеку рецептов
- 39. 5. Соблюдение технологии ЛС (в том числе
- 40. 6. Обеспечение в аптеке условий и сроков
- 41. Правильность заполнения и оформления штангласов с ЛС6.1.
- 42. 7. Номенклатура концентратов, полуфабрикатов и внутриаптечной заготовки
- 43. 8. Руководители аптеки обязаны один раз в
- 44. Алгоритм письменного контроля (проверить паспорт письменного контроля
- 45. Алгоритм опросного контроляНазвать первое входящее вещество и
- 46. Алгоритм органолептического контроляОбязательный вид контроля1.Проверить:-внешний вид, в
- 47. Алгоритм физического контроля1. Проверить:-общую массу или общий
- 48. Химический контроль Лекарственные формы содержат обычно 3-4 и
- 49. Проводится качественный анализ по показателям «Подлинность» и
- 50. Алгоритм химического контроля1. Провести качественный анализ лекарственных
- 51. 2. Качественному анализу подвергаются обязательно: 1)вода очищенная
- 52. 2)все ЛС, концентраты и полуфабрикаты (в том
- 53. 3.Качественному анализу подвергаются выборочно:лекарственные формы, изготовленные по
- 54. 4. Качественному и количественному анализу (полный химический
- 55. все лекарственные формы для новорожденных детей и
- 56. растворы атропина сульфата, кислоты хлористоводородной (для внутреннего
- 57. концентрация спирта этилового при разведении в аптеке,
- 58. 5. Качественному и количественному анализу (полный химический
- 59. 6. Результаты химического контроля регистрируются в «Журнале
- 60. Особые требования к контролю качества стерильных
- 61. Вторичному контролю подлежат также 100% бутылок и
- 62. Алгоритм контроля при отпуске1. Проверить:упаковку: ее соответствие
- 63. Порядок оценки качества лекарственных средств, изготовленных в
- 64. ЛС может «не удовлетворять» установленным требованиям:По физическим
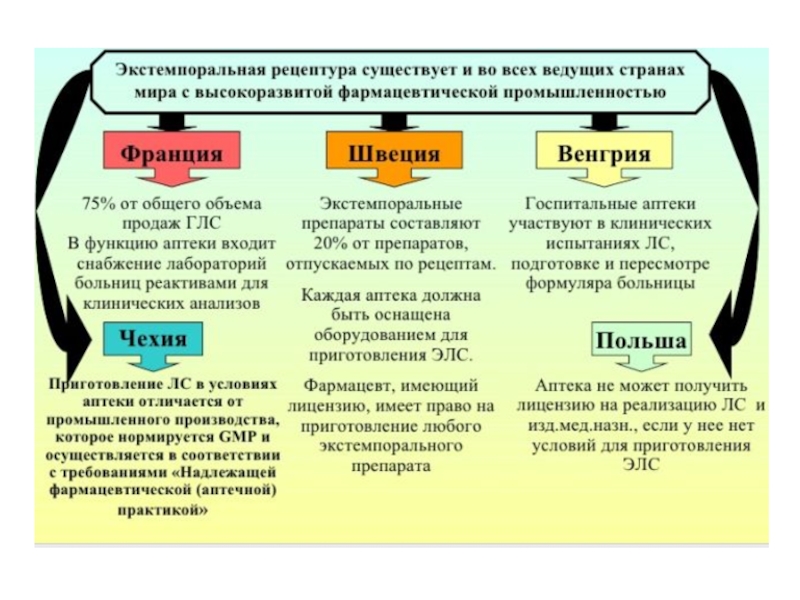
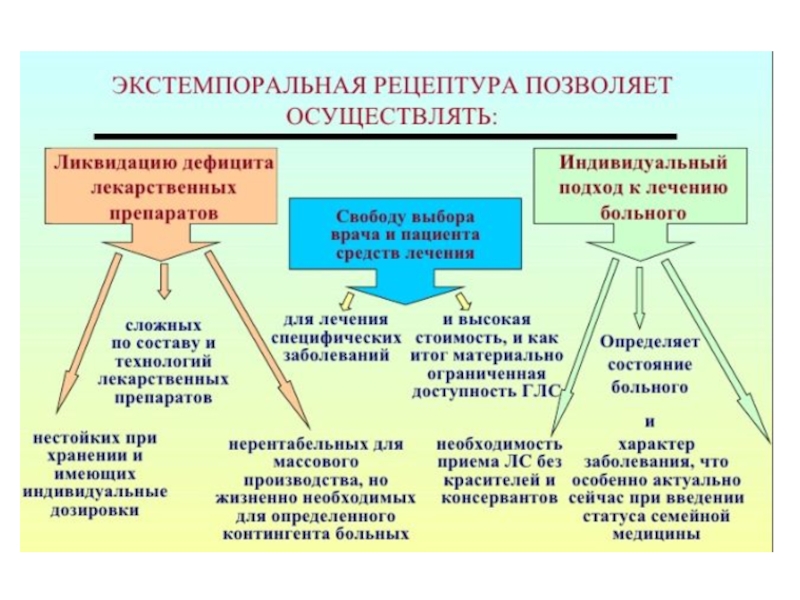
- 65. В экстемпоральной рецептуре аптек определённый объём составляют
- 66. СПАСИБО ЗА ВНИМАНИЕ!
- 67. Скачать презентанцию
Внутриаптечный контроль – это комплекс мероприятий, направленный на своевременное предупреждение и выявление ошибок, неточностей, возникающих при изготовлении, оформлении и отпуске ЛС. От уровня организации контроля качества ЛС в аптеке зависит качество
Слайды и текст этой презентации
Слайд 2 Внутриаптечный контроль – это комплекс мероприятий, направленный на своевременное предупреждение
и выявление ошибок, неточностей, возникающих при изготовлении, оформлении и отпуске
ЛС.От уровня организации контроля качества ЛС в аптеке зависит качество и культура лекарственного обслуживания населения и лечебно-профилактических учреждений.
Вся производственная деятельность аптеки направлена на обеспечение высококачественного изготовления ЛС для населения и лечебно-профилактических учреждений.
Слайд 3 Качественное изготовление ЛС достигается за счет строгого выполнения технологии изготовления
ЛФ, соблюдения фармацевтического порядка и санитарного режима, правильно и четко
организованного внутриаптечного контроля, правил и сроков хранения и отпуска ЛС.Слайд 9ВНУТРИАПТЕЧНОЕ ПРОИЗВОДСТВО – ВАЖНЕЙШАЯ ФУНКЦИЯ БОЛЬНИЧНЫХ АПТЕК В МИРЕ
-Индивидуализация производства
– изготовление ЛС в соответствии с индивидуальными потребностями пациентов в
зависимости от возраста, медицинских показаний, индивидуальной предрасположенности- Введение стандартов:
GMP (Good Manufacturing Practice) — Надлежащая производственная практика
GPP (Good Pharmacy Practiсe) — Надлежащая аптечная практика
19 января 2011г Комитет Министров Совета Европы принял «Резолюцию о требованиях к качеству и обеспечению безопасности медицинских препаратов, изготавливаемых в аптеках» с целью упорядочить систему аптечного производства и исключить разницу в производимой продукции в различных больницах
Слайд 11Автоматизация производства в больничных аптеках
APOTECAchemo - автоматизированная система с роботом-
манипулятором, готовящим противоопухолевые ЛС, минимизируя человеческий контакт с токсическими веществами
(безопасность персонала).На каждом шаге система тщательно проверяет запрошенное изготовление ЛС с использованием сканеров штрих-кодов, автоматизированной системы визуального управления и высокоточной проверки дозировки ЛС (безопасность пациентов).
Слайд 12 ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ КАЧЕСТВА ЛС
включает аналитический контроль и систему мероприятий,
обеспечивающих правильное хранение,
приготовление и отпуск ЛС, для чего необходимо
строгое соблюдение фармацевтического и санитарного режима.Слайд 14Приказ Минздрава России от 26.10.2015 №751н
"Об утверждении правил изготовления
и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными
предпринимателями, имеющими лицензию на фармацевтическую деятельность" (Зарегистрировано в Минюсте России 21.04.2016 № 41897)приказ вступил в силу 1 июля 2016 года.
Приложение к приказу
ПРАВИЛА ИЗГОТОВЛЕНИЯ И ОТПУСКА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ АПТЕЧНЫМИ ОРГАНИЗАЦИЯМИ, ИНДИВИДУАЛЬНЫМИ ПРЕДПРИНИМАТЕЛЯМИ, ИМЕЮЩИМИ ЛИЦЕНЗИЮ НА ФАРМАЦЕВТИЧЕСКУЮ ДЕЯТЕЛЬНОСТЬ
Слайд 15 В соответствии с частью 1 статьи 56 ФЗ РФ от
12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (в ред. от
03.07.2016) изготовление ЛП аптечными организациями осуществляется по рецептам на ЛП и по требованиям медицинских организаций в соответствии с правилами изготовления и отпуска ЛП, утвержденными уполномоченным федеральным органом исполнительной власти.Согласно пункту 5 «е» утвержденного Постановлением Правительства РФ от 22.12.2011 № 1081 «Положения о лицензировании фармацевтической деятельности» (в ред. от 15.04.2013) одним из лицензионных требований при осуществлении фармацевтической деятельности является соблюдение лицензиатом, осуществляющим изготовление ЛП для медицинского применения, - правил изготовления и отпуска ЛП для медицинского применения.
Слайд 16 Приказом Минздрава РФ от 26.10.2015 г. № 751н, который вступил
в силу 1 июля 2016 года, утверждены «Правила изготовления и
отпуска ЛП для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность». Поскольку именно на эти Правила ссылаются как Закон, так и Положение о лицензировании, то именно они имеют приоритет по отношению к любым другим ведомственным актам, регулирующим порядок изготовления ЛП. Кроме того, по общему правилу большую юридическую силу имеют более поздние нормативно-правовые акты одного и того же ведомства. Приказ Минздрава № 751н, зарегистрирован в Минюсте РФ и официально опубликован.Таким образом, с 1 июля 2016 года производственные аптеки должны применять Правила, утвержденные Приказом Минздрава РФ от 26.10.2015 г. № 751н. При этом нормы некоторых требований ранних Инструкций могут также применяться в части не противоречащей нормам указанного Приказа.
Слайд 17 Приказ МЗ РФ № 214 от 16.07.1997г. «О контроле качества
лекарственных средств, изготовляемых в аптеках».
Приказ утверждает:
Инструкцию по контролю качества ЛС,
изготовляемых в аптеках.Сроки годности, условия хранения и режим стерилизации ЛС, изготовляемых в аптеках.
Типовые профессионально-должностные требования к провизору, занятому контролем качества ЛС, изготовляемых в аптеках.
Слайд 18 Приказ Министерства здравоохранения Российской Федерации от 31.08.2016 № 647н
«Об утверждении Правил надлежащей
аптечной практики лекарственных препаратов для медицинского применения»
Слайд 19 Приказ Министерства здравоохранения РФ от 31.08.2016 № 646н «Об утверждении Правил надлежащей
практики хранения и перевозки лекарственных препаратов для медицинского применения»
Приказ
№ 706н «Об утверждении Правил хранения лекарственных средств» (ред. от 28.12.2010 г. № 1221).Слайд 20 Приказ МЗ РФ № 308 от 21.10.1997г. «Об утверждении инструкции
по изготовлению в аптеках жидких лекарственных форм»
Приказ МЗ РФ №
309 от 21.10.1997г. «Об утверждении инструкции по санитарному режиму аптечных учреждений».Инструкции по изготовлению и контролю качества лекарств в условиях аптеки (МЗ РФ, областные центры контроля качества лекарств).
Слайд 21
Нормы естественной убыли при изготовлении лекарственных средств по рецептам и
требованиям учреждений здравоохранения (приказ Минздрава России от 20.07. 2000 №
284, зарегистрирован Минюстом России 26.10.2001 № 2997),а также:
Методические указания Минздрава России по обработке посуды и укупорочных средств, используемых в технологии стерильных растворов, изготовленных в аптеке от 12.12.99 № 99/144;
Методические указания Минздрава России по правилам оформления лекарств, приготовляемых в аптечных учреждениях (предприятиях) различных форм собственности от 24.07.97.
Слайд 22 Производство ЛС осуществляется организациями – производителями ЛС в соответствии с
правилами организации производства и контроля качества ЛС, утвержденными федеральным органом,
в компетенцию которого входят осуществление функций по выработке государственной политики и нормативно-правовому регулированию в сфере обращения ЛС.Отраслевой стандарт «Правила организации производства и контроля ЛС (GMP)» утвержден МЗ РФ 25.02.98 и введен в действие совместным приказом Минздрава России и Минэкономики России от 03.12.99 № 432/512.
Кроме того, введен в действие Национальный стандарт
ГОСТ Р 52249-2009 «Правила организации производства и контроля качества ЛС» (Российские национальные GMP)
ГОСТ Р 52249-2009 (GMP)
Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил организации производства и контроля качества ЛС" (Зарегистрировано в Минюсте России 10.09.2013 N 29938)
Слайд 23 Таким образом, в соответствии с действующим законодательством и нормативными правовыми
актами процесс изготовления в аптеках ЛС ex tempore (по мере
необходимости), строго по заявкам, прописям конкретных отделений или кабинетов лечебно-профилактических учреждений для конкретных больных (с указанием Ф.И.О.)не является серийным производством готовых ЛС.
ПИСЬМО МИНЗДРАВСОЦРАЗВИТИЯ РФ ОТ 19.12.2006 № 6768-ВС
Минздравсоцразвития РФ разъясняет порядок отнесения деятельности аптек по серийному изготовлению ЛС по требованиям учреждений здравоохранения к деятельности по производству ЛС.
Слайд 24 При осуществлении контроля в сфере обращения ЛС должностные лица органа
государственного надзора получили право посещать здания (сооружения), используемые субъектами обращения
ЛС, и проводить отбор ЛС для проверки их качества.В соответствии с изменениями, внесенными Федеральным законом № 93-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам государственного контроля (надзора) и муниципального контроля» в Федеральный закон № 61-ФЗ «Об обращении лекарственных средств», с 25 июня 2012 года должностные лица органа государственного надзора получили право в целях проведения мероприятий контроля беспрепятственно посещать территории, здания, помещения и сооружения, используемые субъектами обращения ЛС, и проводить отбор образцов ЛС для проверки их качества.
Слайд 25Должностные обязанности уполномоченного по качеству
На Уполномоченного по качеству возлагается оперативное
управление вопросами качества аптечной организации.
Уполномоченный по качеству назначается из сотрудников
руководящего состава Приказом руководителя аптечной организации. Функциональные обязанности Уполномоченного по качеству прописываются в должностной инструкции работника , назначенного Уполномоченным по качеству. Слайд 26Обязанности Уполномоченного по качеству
1).Осуществление приёмочного контроля ЛС при поступлении их
на склад аптечной организации. Контроль за ведением Журнала регистрации результатов
приёмочного контроля.2). Изъятие ЛС, вызвавших сомнение в качестве при проведении приёмочного контроля на анализ в территориальный ЦСККЛС.
3). Получение сведений от Росздравнадзора о забракованных и фальсифицированных ЛС и доведение этих сведений до Ответственных по качеству в структурных подразделениях сети аптечной организации.
4). Организация возврата поставщику ЛС серий, забракованных или фальсифицированных согласно письмам Росздравнадзора или изоляция в карантинную зону ЛС серий, реализация которых приостановлена до получения сведений об окончательных результатах анализов ЛС данных серий.
5). Изъятие некачественных ЛС для передачи организации, уполномоченной уничтожать ЛС, пришедшие в негодность в соответствии с Постановлением Правительства РФ №674 от 03.09.2010 « Об утверждении Правил уничтожения недоброкачественных , фальсифицированных и контрафактных ЛС».
Слайд 27 6). Контроль за оперативностью изъятия из оборота в структурных подразделениях
сети аптечной организации ЛС забракованных серий, серий, содержащих фальсификацию и
серий, реализация которых приостановлена.7). Формирование банка данных аптечной организации о забракованных и фальсифицированных ЛС.
8). Проведение самоинспекции аптечной организации.
9). Разработка форм документирования результатов самоинспекции аптечной организации.
10). Разработка организационных мер по устранению и предотвращению выявленных нарушений при проведении самоинспекции.
11). Периодический контроль структурных подразделений сети аптечной организации за соответствием требованиям приказов Министерства здравоохранения РФ
12). При наличии в сети аптечной организации аптек, занимающихся изготовлением ЛС - периодический контроль за соответствием производственной деятельности требованиям приказов Минздрава РФ
13). Участие на уровне аптечной организации в мероприятиях по систематическому повышению профессиональной компетенции специалистов по вопросам качества ЛС.
Слайд 28 Согласно приказу № 751н от 26.10.2015г. в аптеке предусмотрены следующие
виды контроля: приемочный,
письменный, опросный, органолептический, физический, химический и контроль
при отпуске.Химический контроль проводится в соответствии с требованиями приказа № 751н
(или Инструкции 214, раздел 8).
Слайд 29 Провизор-аналитик обязан владеть всеми видами внутриаптечного контроля.
Зав. аптекой и заместители
обязаны обеспечить условия выполнения всех видов контроля.
Результаты контроля качества ЛС
регистрируются в журналах, срок хранения журналов – 1 год. По итогам за год составляется
отчет о работе по контролю
качества ЛС,
изготовленных
в аптеке, который
направляется в ЦСККЛС.
Слайд 30Журнал регистрации результатов органолептического, физического и химического контроля лекарственных форм,
концентратов, полуфабрикатов, тритураций, спирта, фасовки
Журнал регистрации результатов контроля «Воды очищенной»,
«Воды для инъекций» Журнал регистрации результатов контроля ЛС на подлинность
Журнал регистрации результатов контроля отдельных стадий изготовления растворов для инъекций и инфузий
Журнал регистрации режима стерилизации исходных ЛВ, изготовленных ЛС, вспомогательных материалов, посуды
Слайд 31 Химический контроль заключается в определении подлинности (качественный анализ) и количественного
содержания лекарственных средств, входящих в состав препаратов.
Для выполнения качественного и
количественного анализа препаратов в условиях аптеки были разработаны приемы экспресс-анализа. Слайд 32Процедура осуществления приёмочного контроля
Приёмочный контроль осуществляется с целью предупреждения поступления
в аптеку некачественных ЛС.
При заключении договоров о закупке ЛС проверяется
наличие лицензии (копии) на право производства, реализации ЛС, осуществления заявленной фармацевтической деятельности производителя закупаемых ЛС у поставщиков.Слайд 33При поступлении ЛС на склад аптечной организации проверяется:
-
регистрация ЛС в РФ;
- наличие оригиналов и/или заверенных
подлинной (синей) печатью поставщика и голограммой копий сертификатов качества или деклараций о соответствии с неистекшим сроком действия на данные серии ЛС.- соответствие требованиям по показателям:
а) описание;
б) упаковка;
в) маркировка.
Слайд 34 В случае сомнения в качестве ЛС изымают из обращения препараты
данной серии, изолируют от других ЛС в карантинную зону, отбирают
образцы ЛС, составляют акт отбора образцов ЛС и направляют на анализ в ЦСККЛС.При уверенности в несоответствии качества ЛС требованиям по указанным показателям составляют возвратную накладную поставщику забракованных серий ЛС.
Результаты приёмочного контроля заносятся в Журнал регистрации результатов приёмочного контроля
Слайд 36Предупредительные мероприятия
В аптеке осуществляются предупредительные мероприятия, которые заключаются в выполнении
требований:
Соблюдение санитарных норм и правил, противоэпидемического режима, а также правил
асептики при изготовлении ЛС; фармацевтического порядка.Соблюдение правил получения, сбора и хранения воды очищенной, воды для инъекций; своевременная санитарная обработка трубопровода; контроль за своевременным изъятием стерильных растворов, воды очищенной, воды для инъекций для испытания на стерильность в соответствии с действующими требованиями.
Слайд 373. Обеспечение исправности и точности приборов, аппаратов и весового хозяйства,
регулярности их проверки.
Слайд 384. Тщательный просмотр поступающих в аптеку рецептов и требований лечебных
учреждений с целью проверки правильности их выписывания; совместимости веществ, входящих
в состав ЛС; соответствия прописанныхдоз возрасту больного
и наличия указаний
о способах
применения ЛС.
Слайд 395. Соблюдение технологии ЛС (в том числе гомеопатических) в соответствии
с требованиями действующей ГФ, НД. Изготовление ЛС по индивидуальным прописям,
концентратов и полуфабрикатовсчитается законченным
только после
оценки качества
их изготовления
и правильности
оформления.
Слайд 406. Обеспечение в аптеке условий и сроков хранения ЛС в
соответствии с их физико-химическими свойствами и требованиями действующих ГФ и
НД.Слайд 41 Правильность заполнения и оформления штангласов с ЛС
6.1. В помещениях хранения
на всех штангласах с ЛС должны быть указаны: номер серии
предприятия-изготовителя, номер анализа ЦСККЛС, срок годности, дата заполнения и подпись заполнившего штанглас. На штангласах с ЛС, содержащими сердечные гликозиды, должно быть указано количество ЕД в 1г лекарственного растительного сырья или в 1 мл ЛС.6.2. В ассистентских комнатах на всех штангласах с ЛВ должны быть указаны: дата, подпись заполнившего штанглас и проверившего подлинность ЛВ. На штангласах с ядовитыми и сильнодействующими ЛВ должны быть указаны высшие разовые и суточные дозы, а на штангласах с ЛВ, для изготовления стерильных лекформ, должна быть предупредительная надпись "Для стерильных лекарственных форм".
6.3. Штангласы с растворами, настойками и жидкими полуфабрикатами должны быть обеспечены каплемерами или пипетками. Число капель в определенном объеме должно быть установлено взвешиванием и обозначено на штангласе.
6.4. Заполнение штангласа, бюретки в бюреточной установке, штангласа с каплемером или пипеткой должно проводиться только после полного использования ЛС и соответствующей обработки штангласа (бюретки).
Слайд 42 7. Номенклатура концентратов, полуфабрикатов и внутриаптечной заготовки ЛС, изготовляемых в
аптеках, должна утверждаться территориальной КАЛ и доводиться до сведения всех
аптек соответствующей территории.В данный перечень могут включаться только прописи, содержащие совместимые ЛВ, на которые имеются методики анализа для химического контроля и установлены сроки годности.
Слайд 43 8. Руководители аптеки обязаны один раз в квартал осуществлять контроль
за соблюдением правил хранения ЛС в отделениях лечебных учреждений, прикрепленных
к аптеке.Запрещается в отделениях лечебных учреждений изготовление ЛС, расфасовка, перемещение из одной емкости (упаковки) в другую и замена этикеток. ЛС должны храниться в отделениях только в оригинальной (заводской фабричной или аптечной) упаковке.
Для контроля за сроком годности на упаковке фасовки, отпускаемой аптекой в отделение лечебного учреждения, должна быть указана серия предприятия - изготовителя.
ЛС из аптек в лечебные учреждения должны отпускаться по доверенности только медицинскому персоналу.
Слайд 44Алгоритм письменного контроля (проверить паспорт письменного контроля ППК):
Номер ППК (он
же номер рецепта).
Взятые лекарственные вещества.
Порядок их введения.
Количество лекарственных веществ (расчеты).
Общий
объем или общая масса.Масса отдельных доз и их количество.
Дата.
Подпись изготовившего лица.
Примечание:
Для инъекционных растворов проверить записи в «Журнале регистрации отдельных стадий изготовления инъекционных растворов».
Для концентратов, полуфабрикатов, внутриаптечной заготовки и фасовки проверить записи в «Журнале учета лабораторных и фасовочных работ».
Паспорта хранятся 2 месяца. Обязательный вид контроля.
Слайд 45Алгоритм опросного контроля
Назвать первое входящее вещество и его количество (для
сложных лекарственных форм).
Выслушать информацию фармацевта, который продолжает называть все взятые
вещества и их количества.Сравнить
данную информацию с ППК.
4. Проводится выборочно
после изготовления
фармацевтом (провизором)
не более пяти ЛФ.
Слайд 46Алгоритм органолептического контроля
Обязательный вид контроля
1.Проверить:
-внешний вид, в том числе наличие
или отсутствие цвета;
-запах;
-однородность смешения (для твердых и мягких лекарственных форм
– до -разделения массы на дозы);-отсутствие механических включений (для жидких лекарственных форм).
2.Органолептическому контролю подвергаются выборочно:
-детские лекарственные формы для внутреннего применения (вкус);
-порошки, мази, суппозитории (однородность смешения).
3. Зарегистрировать результаты контроля в журнале (по прилагаемой форме).
Слайд 47Алгоритм физического контроля
1. Проверить:
-общую массу или общий объем лекформы (в
недозированных лекарственных формах);
-количество и массу отдельных доз (не менее
3 доз – в дозированных ----лекарственных формах; -качество упаковки.2. Рассчитать норму отклонения.
3. Сравнить полученный результат с нормой отклонения.
4. Зарегистрировать результаты контроля в журнале (по прилагаемой форме).
Физическому контролю подвергаются обязательно:
каждая серия фасовки (не менее 3 упаковок), в том числе фасовки промышленной продукции и гомеопатические ЛС;
каждая серия лекформ, требующих стерилизации, после расфасовки до их стерилизации (не менее пяти флаконов)
Физическому контролю подвергаются выборочно:
лекформы, изготовленные по индивидуальным рецептам (требованиям), но не менее 3% от количества лекформ, изготовленных за день.
Слайд 48Химический контроль
Лекарственные формы содержат обычно 3-4 и более веществ, для
разделения, идентификации и количественного определения нужны быстрые и надежные методы
анализа. Также возросли требования к технологии изготовления и контролю качества растворов для инъекций, глазных капель, лекформ для новорожденных и др.Из разных видов контроля, применяемых в аптеке, самым надежным и эффективным на всех участках работы является химический, позволяющий установить соответствие ЛС выписанному рецепту и доброкачественность его изготовления.
Слайд 49 Проводится качественный анализ по показателям «Подлинность» и «Испытания на чистоту
и допустимые пределы примесей»;
и количественный анализ
(количественное определение)
веществ,
входящих в состав.
Слайд 50Алгоритм химического контроля
1. Провести качественный анализ лекарственных форм по показателю
«Подлинность» входящих веществ.
2. Качественному анализу подвергаются обязательно:
Слайд 512. Качественному анализу подвергаются обязательно: 1)
вода очищенная – ежедневно, на
отсутствие хлоридов, сульфатов и солей кальция;
вода для изготовления стерильных растворов
– на отсутствие хлоридов, сульфатов, солей кальция, восстанавливающих веществ, солей аммония и диоксида углерода в соответствии с требованиями действующей ГФ. Вода очищенная и вода для инъекций должны ежеквартально подвергаться полному качественному и количественному анализу. Результаты анализов заносятся в «Журнал регистрации результатов контроля: «Воды очищенной», «Воды для инъекций»;
Слайд 522)
все ЛС, концентраты и полуфабрикаты (в том числе гомеопатические), поступающие
из помещений хранения в ассистентскую комнату;
концентраты, полуфабрикаты и жидкие ЛС
в бюреточной установке и в штангласах с пипетками в ассистентской комнате при заполнении. Результаты анализов заносят в «Журнал регистрации результатов контроля ЛС на подлинность».ЛС в случае возникновения сомнения в их качестве;
расфасованные ЛС промышленного производства;
Слайд 533.Качественному анализу подвергаются выборочно:
лекарственные формы, изготовленные по индивидуальным рецептам и
требованиям ЛПУ, у каждого фармацевта, в течение рабочего дня, не
менее 10% от общего количества изготовленных лекарственных форм.Слайд 544. Качественному и количественному анализу (полный химический контроль) подвергаются обязательно:
все
растворы для инъекций и инфузий до стерилизации, включая определение рН
изотонирующих и стабилизирующих веществ;все растворы для инъекций и инфузий после стерилизации на величину рН, подлинность и количественное содержание действующих веществ (отбирается 1 флакон);
стерильные растворы для наружного применения;
глазные капли и мази, содержащие наркотические и ядовитые вещества (изотонирующие и стабилизирующие вещества определяются до стерилизации);
Слайд 55все лекарственные формы для новорожденных детей и детей до года;
При
отсутствии методик количественного анализа лекформ для новорожденных, эти лекформы должны
быть проверены методиками качественного анализа.Как исключение, сложные лекформы, для которых не существует методик качественного и количественного анализа, изготавливают в присутствии провизора-аналитика или провизора-технолога («под наблюдением»).
Слайд 56растворы атропина сульфата, кислоты хлористоводородной (для внутреннего употребления), растворы серебра
нитрата;
все концентраты, полуфабрикаты, тритурации, кроме гомеопатических;
вся внутриаптечная заготовка ЛС (каждая
серия), кроме гомеопатических ЛП;стабилизаторы, применяемые при изготовлении растворов для инъекций, и буферные растворы, применяемые при изготовлении глазных капель;
Слайд 57концентрация спирта этилового при разведении в аптеке, а в случае
необходимости – при приеме со склада;
инъекционные гомеопатические растворы;
гомеопатические гранулы
– на распадаемость (каждая серия) в соответствии с требованиями действующих НД;Слайд 585. Качественному и количественному анализу (полный химический контроль) подвергаются :
ЛФ,
изготовленные по рецептам и требованиям, в количестве не менее трех
ЛФ при работе в одну смену с учетом различных видов ЛФ.Особое внимание должно обращаться на ЛФ для детей, применяемые в офтальмологической практике, содержащие наркотические и ядовитые средства, растворы для лечебных клизм.
Слайд 59 6. Результаты химического контроля регистрируются в «Журнале регистрации результатов органолептического,
физического и химического контроля внутриаптечной заготовки лекарственных форм, изготовленных по
индивидуальным рецептам (требованиям лечебных учреждений), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки».В журнале обязательно регистрируются все случаи неудовлетворительного изготовления ЛС.
Слайд 60
Особые требования к контролю качества стерильных растворов
Изготовление стерильных растворов запрещается
при отсутствии данных о совместимости веществ, технологии и режиме стерилизации,
а также при отсутствии методик анализа для их полного химического контроля.Контроль стерильных растворов
на отсутствие механических включений:
Первичный контроль осуществляется после фильтрования и фасовки раствора. При этом просматривается каждая бутылка или флакон с раствором. При обнаружении механических включений растворов повторно фильтруют, вновь просматривают, укупоривают, маркируют и стерилизуют. Растворы, изготовленные асептически, просматривают один раз после фасовки или стерилизующего фильтрования.
Слайд 61 Вторичному контролю подлежат также 100% бутылок и флаконов с растворами,
прошедшие стадию стерилизации перед их упаковкой.
Одновременно с проверкой на механические
включения проверяют объём растворов в о флаконах и качество укупорки.Стерилизация растворов должна проводиться не позднее трех часов от начала изготовления.
По истечении сроков годности стерильные растворы подлежат изъятию.
Повторная стерилизация растворов не допускается.
Слайд 62Алгоритм контроля при отпуске
1. Проверить:
упаковку: ее соответствие с физико-химическими свойствами
входящих веществ, ее герметичность;
оформление: в соответствии с действующими требованиями, в
соответствии с физико-химическими свойствами входящих веществ; маркировка – этикетки, надписи, сигнальные цвета…дозы ядовитых, наркотических и сильнодействующих веществ – в соответствии с возрастом;
номер рецепта и номер на этикетке;
фамилию больного на этикетке, на рецепте, на квитанции (или спросить у больного – при жетонной форме);
копии рецептов.
2. Поставить свою подпись
на обратной стороне рецепта
(требования).
3. Отпустить ЛС больному.
Слайд 63Порядок оценки качества лекарственных средств, изготовленных в аптеке
Порядок оценки
качества ЛС, изготовленных в аптеке, и нормы допустимых отклонений при
изготовлении лекарств установлены:Приложение №3 к Правилам изготовления и отпуска лекарственных препаратов для медицинского применения от 26 октября 2015 г. №751н
(приказ №305 от 16.10.1997 г. «О нормах отклонений, допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках») .
Для оценки качества используют термины «удовлетворяет» или «не удовлетворяет» требованиям инструкций, ГФ, ФС.
Слайд 64ЛС может «не удовлетворять»
установленным требованиям:
По физическим свойствам (не достаточная
чистота раствора, плохое смешение и растирание ингредиентов порошка);
По подлинности (ошибочная
замена одного препарата другим, отсутствие прописанного или наличие непрописанного ингредиента, замена прописанного аналогом без внесения изменений в рецепт);По отклонениям от прописанных количеств;
По общей массе (объёму), по развеске отдельных доз;
По массе отдельных ингредиентов.
Слайд 65 В экстемпоральной рецептуре аптек определённый объём составляют многокомпонентные лекарственные формы,
для идентификации и количественного анализа которых нужны быстрые и достоверные
методики.Внутриаптечная рецептура лабильна и отличается разнообразием. В отличии от индивидуальных ЛС создать НД на каждую пропись невозможно, что вызывает затруднения в работе провизора-аналитика.
В настоящее время проводятся работы по стандартизации ЛС, изготовляемых в аптеке, по унификации часто повторяющихся прописей и разработке на них НД с включением технологии и способов контроля качества. Проекты НД апробируются в базовых аптеках, КАЛ; затем рассматриваются на комиссии по стандартизации, НЦ ЭСМП, утверждаются.